肺部受累嗜酸性肉芽肿性多血管炎的临床特点
侯小萌 肖楚吟△▲ 李 菁 施举红
(中国医学科学院北京协和医学院北京协和医院呼吸内科,北京100730)
血管炎 (vasculitis)是指以血管壁炎症和纤维素样坏死为病理特征的一组异质性疾病,可累及各种类型的血管,临床表现复杂多样。2012年新版Chapel Hill Conference Consensus(CHCC)分类方法[1-2],根据组织病理学特点将抗中性粒细胞胞浆抗体 (antineutrophil cytoplasmic antibody,ANCA)相关血管炎(antineutrophil cytoplasmic antibody-associated vasculitis,AAV)分为显微镜下多血管炎 (microscopic polyangiitis,MPA)、肉芽肿性多血管炎 (granulomato-sis with polyangiitis,GPA)和嗜酸性肉芽肿性多血管炎 (eosinophilic granulomatosis with polyangiitis,EGPA)。 EGPA原称为Churg-Strauss综合征,是累及中、小动脉和静脉的系统性坏死性血管炎,以血管周围及邻近组织嗜酸性粒细胞浸润为特征,与GPA相比,主要特点为大量嗜酸性粒细胞浸润及哮喘症状,当肾脏受累时ANCA阳性率高。由于EGPA发病率低,早期经常仅累及肺部,临床医师在诊断及疾病转归的判断上经常存在疑问。现回顾性分析北京协和医院近3年住院诊治的EGPA肺部受累患者资料,完善和补充临床医师对EGPA肺部受累疾病特征的认识,以提高临床诊断及治疗水平。
对象与方法
对象
检索2014年1月至2017年1月北京协和医院住院治疗、出院诊断为EGPA的患者,沿用1990年美国风湿病学会对EGPA的诊断标准。本研究将CT影像学检查与EGPA明确相关的实质性肺部异常 (lung parenchymal abnormalities)定义为EGPA肺部受累,肺部影像学无实质性肺部异常定义为无肺部受累。诊断由2名风湿免疫科医师及2名呼吸内科医师进行核实 (主要基于发病年龄、上呼吸道受累、肺脏表现、肾脏表现、ANCA等),并共同分检出近3年中明确诊断EGPA且存在肺部受累的患者12例作为观察组,同时分检北京协和医院2000年1月至2017年1月住院诊治的无肺部受累的EGPA患者17例作为对照组。
方法
将病例分为肺部受累EGPA组与无肺部受累EGPA组。(1)收集患者病历资料中临床信息、影像资料及病理资料,分析EGPA肺部受累患者一般资料、诊断标准符合情况、ANCA及各系统受累情况;(2)比较肺部受累EGPA组与无肺部受累EGPA组ANCA及各个系统受累情况;(3)具体分析EGPA肺部受累患者呼吸系统症状、肺功能、肺部影像学的特征。其中,肾脏受累定义为活动性尿沉渣和 (或)24 h尿蛋白定量>0.5 g和 (或)血肌酐水平升高。神经系统受累定义为无法用其他原因解释的感觉或运动异常以及与病程相关的中枢神经系统症状及影像学表现。消化系统受累定义为无法用其他原因解释的反复腹痛、腹泻、消化道出血 (包括便隐血阳性)和肠梗阻等表现。心脏受累定义为无法用其他原因解释的心包及心肌异常改变。
统计学处理
应用SAS 6.1软件,正态分布计量资料描述以均数±标准差 (±s)表示,非正态计量资料的描述以中位数 (四分位间距)[M(Q1,Q3)]表示。计数资料描述应用数值 (百分比)表示,计数资料两组之间比较采用卡方检验及Fisher精确检验,以P<0.05为差异有统计学意义。
结 果
肺部受累EGPA组一般情况
12例肺部受累EGPA患者中男性6例,女性6例,男 ∶女为1∶1;年龄 25~73岁,中位年龄为46.5(25,60)岁。12例 (100%)均以哮喘起病,从哮喘起病到明确诊断EGPA的时间为3~120个月,中位时间为31(14,51)个月。EGPA诊断均符合1990年美国风湿病学会对EGPA的诊断标准 (表1)。
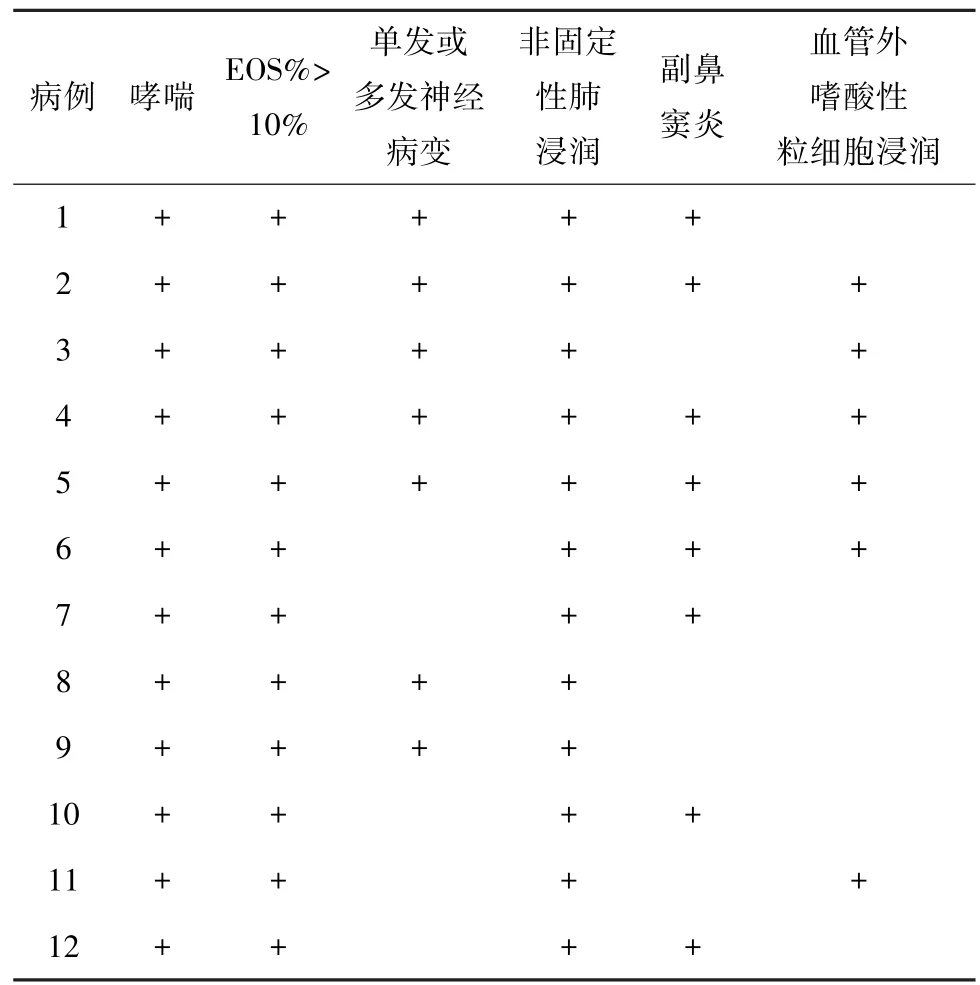
表1 12例肺部受累EGPA患者诊断标准符合情况Table 1 Clinical features according to ACR diagnostic criteria of 12 EGPA patients with pulmonary involvement
肺部受累EGPA组与无肺部受累EGPA组ANCA及各系统受累情况比较
12例肺部受累EGPA患者中10例 (83.3%)出现发热、乏力、纳差、消瘦等全身消耗症状;9例(75.0%)患者出现神经系统症状,包括中枢神经系统缺血及出血共2例,肢体感觉障碍6例,肢体运动障碍3例,听神经受累1例;4例 (33.3%)患者存在心脏受累,2例超声心动图可见心肌浸润性改变,3例可见其他原因不能解释的心包积液;消化道受累5例 (41.7%),表现为其他原因不能解释的腹痛、腹泻或便隐血阳性;耳鼻喉受累10例 (83.3%),包括鼻窦炎8例,过敏性鼻炎7例,中耳炎1例;肾脏受累1例 (8.3%),表现为肌酐升高;9例 (75.0%)出现皮疹,分别分布在肢体、颜面及躯干部,表现为丘疹、风团或紫癜;12例患者中3例 (25.0%)ANCA阳性,2例为p-ANCA,1例为核周型ANCA。肺部受累EGPA组出现全身消耗症状 (P=0.004)及耳鼻喉受累 (P=0.012)发生率高于无肺部受累EGPA组,而肺部受累EGPA组出现外周血管受累 (P=0.003)、尤其是肢端坏疽 (P=0.009)的发生率低于无肺部受累EGPA组,差异有统计学意义 (表2)。
肺部受累EGPA组肺部临床特征
12例肺部受累EGPA患者均有呼吸系统症状:12例 (100%)以哮喘起病、存在不同程度的呼吸困难;12例 (100%)出现咳嗽咳痰症状;2例 (16.7%)出现咯血症状;1例 (8.3%)出现胸痛症状;8例(66.7%)存在显著的鼻塞流涕症状。12例中9例在本院进行了肺功能检测:55.6%(5/9)的患者为阻塞性通气功能障碍,11.1%(1/9)的患者为限制性通气功能障碍,11.1%(1/9)的患者为混合性通气功能障碍。12例患者确诊EGPA时的肺部CT影像资料,由研究者再次阅片评估:存在细支气管管壁增厚、管腔扩张等细支气管炎表现的10例(83.3%),片状磨玻璃阴影9例 (75.0%),实变影1例 (8.3%),间质网格改变2例 (16.7%)(图1)。在12例 (100%)中,不同特征的影像病变均为多发表现 (表3)。
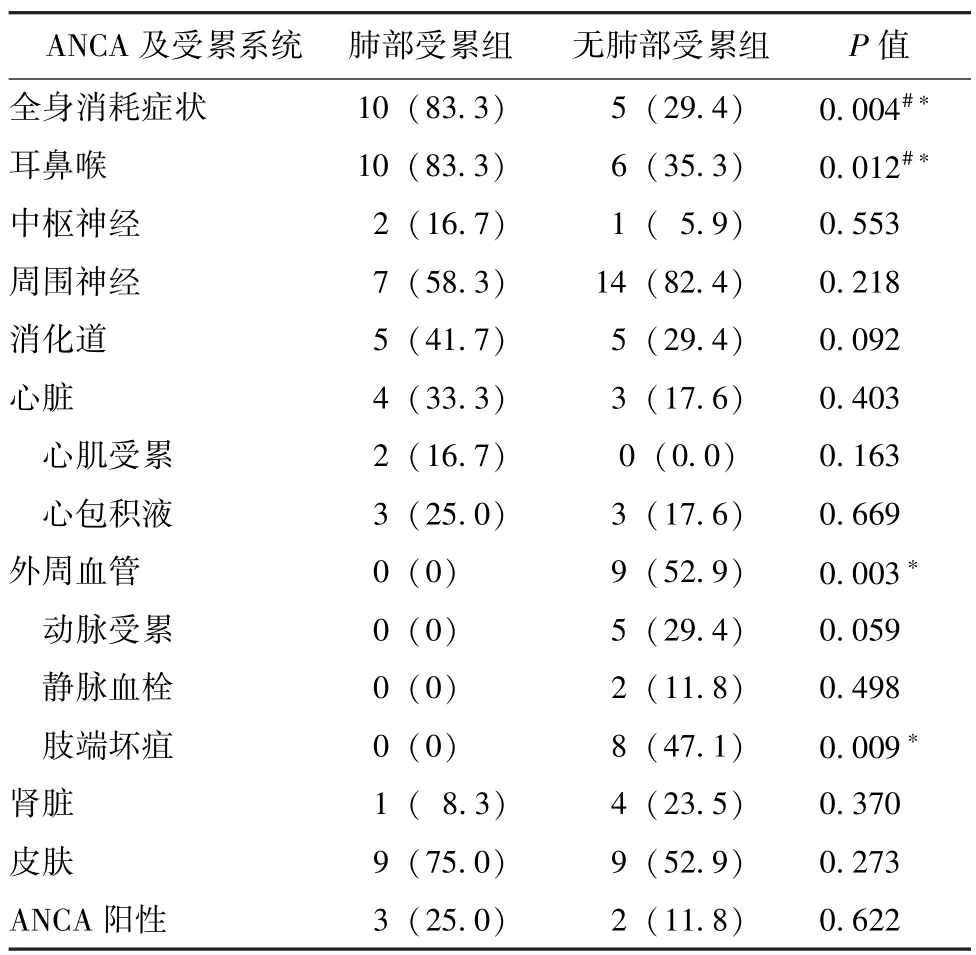
表2 肺部受累EGPA组与无肺部受累EGPA组ANCA及各系统受累情况比较Table 2 Clinicalmanifestation of involved systems in EGPA patients with and without pulmonary involvement[n(%)]
讨 论
EGPA为少见的系统性血管炎,因累及多个组织和器官而出现相应的临床表现,伴发热、体重下降、乏力等全身症状,以及外周血白细胞、红细胞沉降率、C反应蛋白增高等异常。与其他血管炎不同,EGPA最早且最容易累及呼吸道和肺部,首发表现多为过敏性鼻炎、副鼻窦炎、哮喘样发作和阻塞性通气功能障碍[3]。
哮喘几乎是所有EGPA患者均出现的特征性表现,通常在出现血管炎表现前出现,前驱期往往较长,中位时间为4年[3-5]。当反复发作的过敏性鼻炎或鼻窦炎伴有哮喘时,应注意探查有无系统性血管炎的征象。由于鼻窦炎伴哮喘的病例在临床中非常多见,且又常发生在系统性血管炎出现前较长时间,在疾病的早期很难作出EGPA的诊断。在众多的哮喘伴有鼻窦炎的病例中应该重视那些外周血嗜酸性粒细胞明显增多或肺部影像检查发现浸润性阴影的患者[5]。本研究100%肺部受累EGPA患者以哮喘起病,从哮喘起病到明确诊断EGPA中位时间为31(14,51)个月。
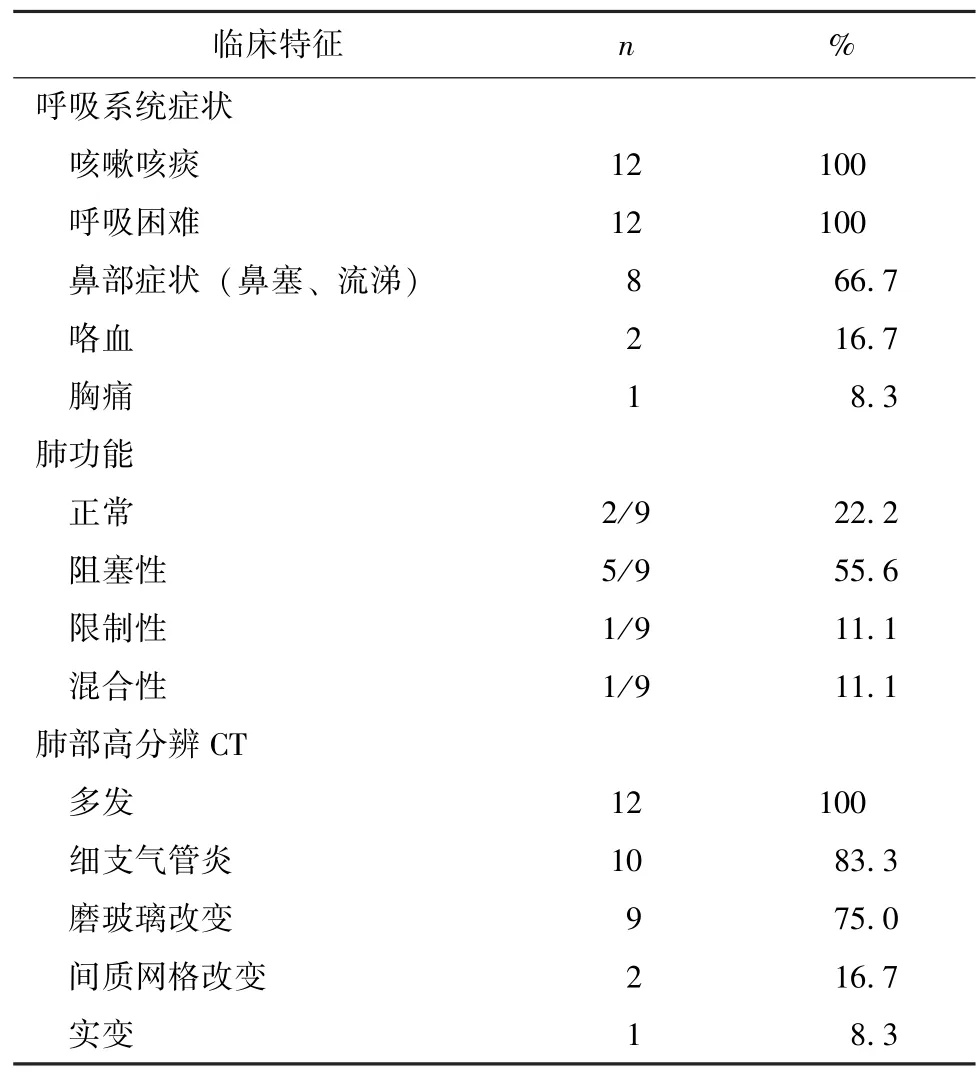
表3 EGPA肺部受累患者肺部临床特征Table 3 Features of respiratory system abnormalities in 12 EGPA patientswith pulmonary involvement
虽然全身消耗症状,包括发热、乏力、纳差、消瘦等,可以在很多系统性疾病中出现,对EGPA诊断本身没有特异性,但本研究发现肺部受累EGPA组中出现全身消耗症状的频率 (83.3%)高于无肺部受累EGPA组 (29.4%)。过敏性鼻炎通常作为疾病最早期的表现,出现在75.0%的EGPA组,常伴有鼻窦炎和鼻息肉[6],本研究发现肺部受累EGPA组出现耳鼻喉受累的频率 (83.3%)高于无肺部受累EGPA组(35.3%)。多发单神经炎在EGPA组是常见表现,哮喘与外周血嗜酸性粒细胞升高合并多发单神经炎时诊断的特异性高[7];本研究两组发生率都较高,组间不存在统计学差异。EGPA胃肠道受累很常见,最容易出现的是腹痛,其次是血便,少数情况下胰腺、胆囊甚至腹膜均可受累[6]。本研究肺部受累EGPA组消化系统受累占41.7%,最常见的表现为腹痛,其次为大便隐血阳性。EGPA组的皮肤病变非常多见,病理可见皮肤的小血管炎[8];本研究75.0%的肺部受累EGPA组出现皮疹,分别分布在肢体、颜面及躯干部,表现为丘疹、风团或紫癜。肾脏受累在EGPA中较为少见[3],本研究肺部受累EGPA组肾脏受累的发生率仅为8.3%。本研究所有肺部受累EGPA组均无外周血管受累的表现,但发现在无肺部受累的EGPA组中外周血管受累 (52.9%)、尤其是肢端坏疽(47.1%) 的现象非常突出 (P=0.003,P=0.009)。
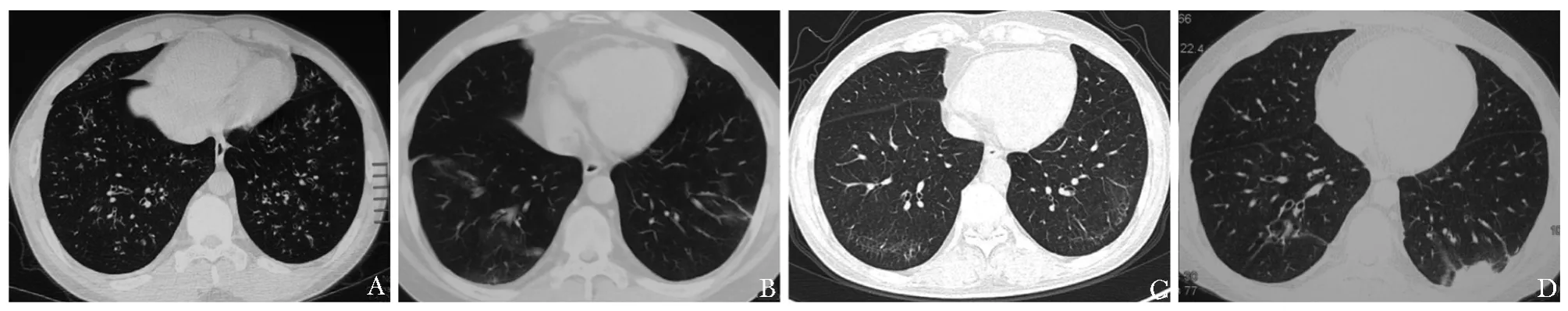
图1 EGPA肺部受累患者肺部高分辨率CT表现A:双肺弥漫性细支气管炎样 (细支气管管壁增厚、管腔扩张)改变;B:双肺下叶基底段片状磨玻璃改变;C:双肺下叶基底段周边分布间质网格改变;D:肺部CT:左肺下叶基底段近胸膜片状实变Fig 1 HRCT findings of EGPA patients with pulmonary involvementA:HRCT of EGPA patient shows bronchialwall thickening,tree-in-bud opacities and small nodules in both lungs;B:Pulmonary CT scan shows patchy ground-glass opacities localizing peripherally in both lower lobes;C:Pulmonary CT scan shows thickening of the interlobular septa localizing peripherally in the basal segments of both lungs;D:Pulmonary CT scan shows wedge-shaped sub-pleural consolidation in the basal segment of left lower lobe
近期一些学者将EGPA患者按ANCA的状态分为2个亚型:ANCA阳性的EGPA患者被称为血管炎型,更容易出现肾小球肾炎、肺泡出血等,但是EGPA患者中ANCA阳性率较低,肺泡出血及肾小球肾炎较之其他类型的系统性血管炎也较为少见[9];ANCA阴性的EGPA患者被称为组织型,更常出现心肌病变[10-11]。进一步的研究发现消瘦、肌痛及关节痛在“血管炎型”的患者中更突出,而在ANCA阴性的患者要警惕无症状隐匿起病的心肌受累[12]。EGPA冠状动脉受累和心肌受累是本病的主要死亡原因[13]。本研究肺部受累EGPA患者中:25.0%ANCA阳性,包括本研究中唯一1例肾脏受累的患者;75.0%的患者ANCA阴性,包括2例心肌受累的患者,与文献报道结果相似。
肺脏是EGPA最常累及的器官。多数EGPA患者肺部病变按前驱期-嗜酸性粒细胞浸润期-血管炎期的顺序发展,部分阶段重叠。不同阶段的病理表现有其相应的临床及影像特征[14-17]。前驱期嗜酸性粒细胞在支气管管壁及小叶间隔浸润,形成支气管炎和小叶间隔增厚。症状表现为支气管哮喘,影像学上以小叶中心性结节、树枝发芽征、支气管管壁增厚及管腔扩张等细支气管炎表现多见,也可出现以小叶间隔增厚为突出改变的间质网格影,提示嗜酸性粒细胞、中性粒细胞在前驱期分别向小叶中心及小叶周边趋化[18]。肺功能相应的表现以阻塞性通气功能障碍为主。嗜酸性粒细胞浸润期支气管管壁和小叶间隔的浸润更加突出,同时出现嗜酸性粒细胞肺炎,影像学上多表现为游走性片状影、磨玻璃样浸润影、实变影[15]。肺功能呈限制或混合性通气功能障碍。一旦进入血管炎期,往往是致命的,病理表现为坏死性肉芽肿累及中小动脉、静脉和毛细血管,临床上多表现为发热、胸痛、咯血,影像学表现为多发外周实变,伴或不伴有空洞[18]。本研究肺部受累患者100%出现哮喘样症状,肺功能以阻塞性通气功能障碍为主,EGPA确诊阶段肺部影像学上表现出的征象依次为细支气管炎83.3%、磨玻璃样片影75.0%、间质网格改变16.7%和实变8.3%(图1)。因此,对EGPA认识的逐步深入,让广大临床医师可以更早的辨识出EGPA肺部受累的征象,避免延误EGPA的诊断。
由于EGPA发病率较低,诊断难度大,目前使用的诊断标准特异性、敏感性较低,因此本研究在1990年美国风湿病学会诊断标准的基础上,进一步应用高年资专科医师讨论的方法以明确诊断及肺部受累情况,可能会导致选择偏倚。
EGPA总体发病率低,ANCA阳性率低,多以哮喘及过敏性鼻炎等常见呼吸系统表现起病,无血管炎系统性表现的哮喘前驱期长,临床难以辨识。肺脏是EGPA最常受累的脏器之一,病变特征与血管炎的不同阶段密切相关。肺受累与非肺受累的EGPA其他各系统受累情况相比,更多出现全身消耗症状及耳鼻喉受累,更少出现外周血管受累。重视那些外周血嗜酸性粒细胞明显增多及肺部影像学出现浸润性阴影的患者,掌握EGPA肺部受累各阶段影像学特征以及其他各系统受累情况与无肺部受累EGPA的差别,对提高前驱期和嗜酸性粒细胞浸润期肺受累EGPA的诊断率非常重要。
[1]Jennette JC,Falk RJ,Bacon PA,et al.2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides[J].Arthritis Rheum,2013,65:1-11.
[2]Jennette JC.Overview of the 2012 revised International Chapel Hill Consensus Conference nomenclature of vasculitides[J].Clin Exp Nephrol,2013,17:603-606.
[3]Noth I,Strek ME,Leff AR.Churg-Strauss syndrome[J].Lancet,2003,361:587-594.
[4]Keogh KA,Specks U.Churg-Strauss syndrome:clinical presentation,antineutrophil cytoplasmic antibodies,and leukotriene receptor antagonists[J].Am JMed,2003,115:284-290.
[5]Guillevin L,Cohen P,Gayraud M,et al.Churg-Strauss syndrome.Clinical study and long-term follow-up of 96 patients[J].Medicine(Baltimore),1999,78:26-37.
[6]Lanham JG,Elkon KB,Pusey CD,et al.Systemic vasculitis with asthma and eosinophilia:a clinical approach to the Churg-Strauss syndrome[J].Medicine(Baltimore),1984,63:65-81.
[7]Ramakrishna G,Midthun DE.Churg-Strauss syndrome[J].Ann Allergy Asthma Immunol,2001,86:603-613.
[8]Jennette JC,Falk RJ.Small-vessel vasculitis[J].N Engl JMed,1997,337:1512-1523.
[9]Choi YH,Im JG,Han BK,etal.Thoracicmanifestation of Churg-Strauss syndrome:radiologic and clinical findings[J].Chest,2000,117:117-124.
[10]Oka N,Kawasaki T,Matsui M,et al.Two subtypes of Churg-Strauss syndrome with neuropathy:the roles of eosinophils and ANCA[J].Mod Rheumatol,2011,21:290-295.
[11]Comarmond C,Pagnoux C,Khellaf M,et al.Eosinophilic granulomatosis with polyangiitis(Churg-Strauss):clinical characteristics and long-term followup of the 383 patients enrolled in the French Vasculitis Study Group cohort[J].Arthritis Rheum,2013,65:270-281.
[12]Cottin V,Bel E,Bottero P,et al.Revisiting the systemic vasculitis in eosinophilic granulomatosis with polyangiitis(Churg-Strauss):A study of157 patients by the Groupe d'Etudes et de Recherche sur les Maladies Orphelines Pulmonaires and the European Respiratory Society Taskforce on eosinophilic granulomatosis with polyangiitis(Churg-Strauss)[J].Autoimmun Rev,2017,16:1-9.
[13]Solans R,Bosch JA,Perez-Bocanegra C,et al.Churg-Strauss syndrome:outcome and long-term follow-up of 32 patients[J].Rheumatology(Oxford),2001,40:763-771.
[14]Kim YK,Lee KS,Chung MP,etal.Pulmonary involvement in Churg-Strauss syndrome:an analysis of CT,clinical,and pathologic findings[J].Eur Radiol,2007,17:3157-3165.
[15]Silva CI,Muller NL,Fujimoto K,et al.Churg-Strauss syndrome:high resolution CT and pathologic findings[J].JThorac Imaging,2005,20:74-80.
[16]Feng RE,Xu WB,Shi JH,et al.Pathological and high resolution CT findings in Churg-Strauss syndrome[J].Chin Med Sci J,2011,26:1-8.
[17]Cottin V,Cordier JF.Churg-Strauss syndrome[J].Allergy,1999,54:535-551.
[18]Castaner E,Alguersuari A,Gallardo X,et al.When to suspect pulmonary vasculitis:radiologic and clinical clues[J].Radiographics,2010,30:33-53.

