甘肃部分地区致羔羊腹泻大肠埃希菌的分离鉴定及耐药性分析
妥 鑫,王胜义,王 慧,崔东安,黄美州,刘永明
(中国农业科学院 兰州畜牧与兽药研究所,农业部兽用药物创制重点实验室,甘肃省新兽药工程重点实验室,甘肃省中兽药工程技术研究中心,兰州 730050)
甘肃部分地区致羔羊腹泻大肠埃希菌的分离鉴定及耐药性分析
妥 鑫,王胜义,王 慧,崔东安,黄美州,刘永明
(中国农业科学院 兰州畜牧与兽药研究所,农业部兽用药物创制重点实验室,甘肃省新兽药工程重点实验室,甘肃省中兽药工程技术研究中心,兰州 730050)
为调查甘肃地区大肠埃希菌对新生羔羊腹泻的致病性及其耐药性,从甘肃省8个养殖场采集新生腹泻羔羊粪便92份。采用16S rDNA扩增结合微生物鉴别培养技术对病料中的致病性大肠埃希菌进行鉴定,随机选取分离的6株菌株进行致病性试验,并采用Kirby-Bauer纸片琼脂扩散法对分离得到的菌株进行耐药性分析。结果表明,从92份病料中分离得到21株致病性大肠埃希菌,选取的6株菌均有一定的致病性,耐药性分析结果显示该地的大肠埃希菌对羊场常用的多种抗生素耐药。表明大肠埃希菌仍是引起甘肃地区新生羔羊腹泻的主要病原菌,而且耐药性严重。
新生羔羊;腹泻;大肠埃希菌;致病性;耐药性
引起羔羊腹泻的病因多样[1-4];其发生可以由B型产气荚膜梭菌(Clostridiumperfringens)、沙门氏菌(Salmonella)、轮状病毒(Rotavirus RV)、牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)等病原所致,但环境条件如气温等改变、饲养管理不善、羔羊本身消化不良等因素也可导致该病的发生。羔羊腹泻症的病原有地域差异性,且时常发生变异并无规律可循[5- 6]。因此,如何有效防治羔羊腹泻症,对养殖业意义重大。大肠埃希菌作为一种动物肠道常在菌,大多数情况下无致病性,仅少数致病性大肠埃希菌能导致各种幼龄动物的腹泻和败血症;由该菌引起的羔羊腹泻症俗称羔羊白痢,主要危害1~4日龄的新生羔羊[7-9]。为了解甘肃地区大肠埃希菌对羔羊的致病情况及其对常用抗生素的耐药情况,笔者对2014年1月-2016年2月引起甘肃部分地区新生羔羊腹泻的病原进行分离鉴定,并对分离的病原菌进行耐药性分析。通过对病原的分离鉴定和耐药性分析,了解当地羔羊大肠埃希菌的感染情况及其耐药现状,对临床诊断和防治提供参考。
1 材料与方法
1.1 病料来源
2014年1月-2016年2月无菌采集甘肃省玉门、永昌、兰州、天水8个集约或半集约养殖场发生腹泻症的新生羔羊(10日龄以内)粪便92份,放入粪便采集器中,-80 ℃保存。腹泻羔羊的选择依据:粪便性状改变,呈水样、粥样,颜色异常,异臭;羔羊臀部超过1/3被粪便污染且精神状态异常;排便次数明显增多且伴有腹痛现象;满足其中之一者判为腹泻。
1.2 细菌分离培养
无菌环境下,将粪便棉拭子放入5 mL的灭菌EP管中,加入2 mL无菌生理盐水,漩涡2 min,4 500 r/min离心5 min,制备菌悬液。取制备好的菌悬液200 L接种于营养肉汤,37 ℃过夜培养。营养肉汤浑浊者接种血平板(购自广州环凯胜物技术有限公司),37 ℃培养16 h后,挑取单菌落在营养肉汤中增菌培养后镜检,已纯化的菌液置4 ℃保存,备用。
1.3 分离菌的鉴定
1.3.1 分离菌DNA的提取 用细菌DNA提取试剂盒[TakaRaMiniBEST Bacteria Genomic DNA Extraction Kit Ver.3.0,宝生物工程(大连)有限公司,大连]提取已纯化的分离菌DNA,具体操作按照该试剂盒说明书进行,将提取的DNA置-20 ℃保存。
1.3.2 分离菌的16S rDNA鉴定 用细菌16S rDNA鉴定试剂盒[TakaRa16S rDNA Bacterial Identification PCR Kit,宝生物工程(大连)有限公司,大连]对提取的DNA扩增,具体操作按照试剂盒说明书进行。PCR产物经凝胶电泳检测后送北京华大基因研究中心测序。在NCBI数据库中对测序结果进行比对,确定分离菌种类。
1.3.3 分离菌的培养鉴别 对经16S rDNA鉴定仍不能确定的分离菌株,用伊红美蓝培养基和麦康凯培养基(购自广州环凯生物技术有限公司)进一步鉴别,依据培养基使用说明判定结果。
1.4 分离菌致病性试验
将36只体质量约125 g的昆明系小鼠(购自兰州大学实验动物中心)分成6组,记为Ⅰ~Ⅵ组,每组雌雄各半;另取同批次的8只小鼠作为对照组(雌雄各半),记为C组。随机选取在麦康凯培养基上生长良好且菌落为粉红色或红色的6株分离菌,接种于营养肉汤,37 ℃培养14 h后,用无菌生理盐水将菌液中的菌落数调至1.5×108cfu/mL,分别经腹腔注射Ⅰ~Ⅵ组小鼠;C组中的4只小鼠(雌雄各半)腹腔注射无菌生理盐水,另外4只(雌雄各半)腹腔注射同条件培养的营养肉汤;依据小鼠体质量腹腔注射剂量均为0.025 mL/g。
1.5 分离菌耐药性分析
将确定的分离菌纯培养物接种于营养肉汤中,37 ℃培养12 h后,用无菌生理盐水将菌液的菌落数调整至1.5×108cfu/mL。用灭菌棉签将菌液均匀涂布于MH药敏培养基(购自广州环凯微生物科技有限公司),分别贴上青霉素、氨苄西林、阿莫西林、头孢氨苄、头孢噻肟、头孢西丁、杆菌肽、复方新诺明、磺胺甲基异恶唑、诺氟沙星、氧氟沙星、环丙沙星、丁胺卡那、链霉素、庆大霉素、新霉素、卡那霉素、克林霉素、红霉素、四环素的药敏纸片(均购自杭州微生物试剂有限公司),37 ℃培养24 h,观察并用游标卡尺测量抑菌圈直径。根据《抗微生物药物敏感性试验执行标准》(第24版信息增刊)判定结果。
2 结果与分析
2.1 细菌分离培养
从92份粪便样品中分离到23株可疑大肠埃希菌。疑似菌在血平板上生长为中等大小(直径约2 mm)、圆形、表面光滑湿润、边缘整齐、中央有隆起、灰白色、或有β溶血,见图1-A;革兰染色镜检可见红色、两端钝圆、散在或成对存在,见图1-B。

A.血平板上的疑似菌落形态:箭头所示 The colonial morphology of suspectedE.colicultured on the blood agar medium as indicated by the arrow;B.显微镜下的疑似菌形态(革兰染色 ×1 000) The bacterial morphology of suspectedE.coliexamined under a microscope (Gram staining ×1 000)
图1 分离菌的培养特点与染色形态
Fig.1 The bacterial culture characteristics and morphology
2.2 分离菌鉴定
对分离的疑似大肠埃希菌16S rDNA扩增、测序比对及鉴定培养,确定分离得到23株大肠埃希菌。23株分离菌在伊红美蓝培养基上生长为紫黑色、带有金属光泽的菌落。其中的21株(占92份病料的22.8%)菌在麦康凯培养基上生长良好,菌落为粉红色或红色;另外2株未生长。见图2、图3。
2.3 分离菌致病性试验
Ⅰ~Ⅵ组的36只小白鼠经腹腔注射分离菌菌液21 h后,3只未见任何症状;10只死亡,其中雌性7只,雄性3只;23只出现腹泻症状,其中雌性12只,雄性11只。C组小白鼠未出现任何症状(表1)。
2.4 分离菌耐药性分析
用20种抗生素(青霉素、氨苄西林、阿莫西林、头孢氨苄、头孢噻肟、头孢西丁、杆菌肽、复方新诺明、磺胺甲基异恶唑、诺氟沙星、氧氟沙星、环丙沙星、丁胺卡那、链霉素、庆大霉素、新霉素、卡那霉素、克林霉素、红霉素、四环素)对分离得到的21株(23株分离菌中的2株未在麦康凯培养基上生长)致病性大肠埃希菌进行药敏分析,结果显示,21株大肠埃希菌均表现多重耐药,3~18重都有分布,其中11~14重分布相对较多(图4)。分离菌对杆菌肽、青霉素、链霉素、克林霉素等有较高的耐药性(超过80%)(表2)。
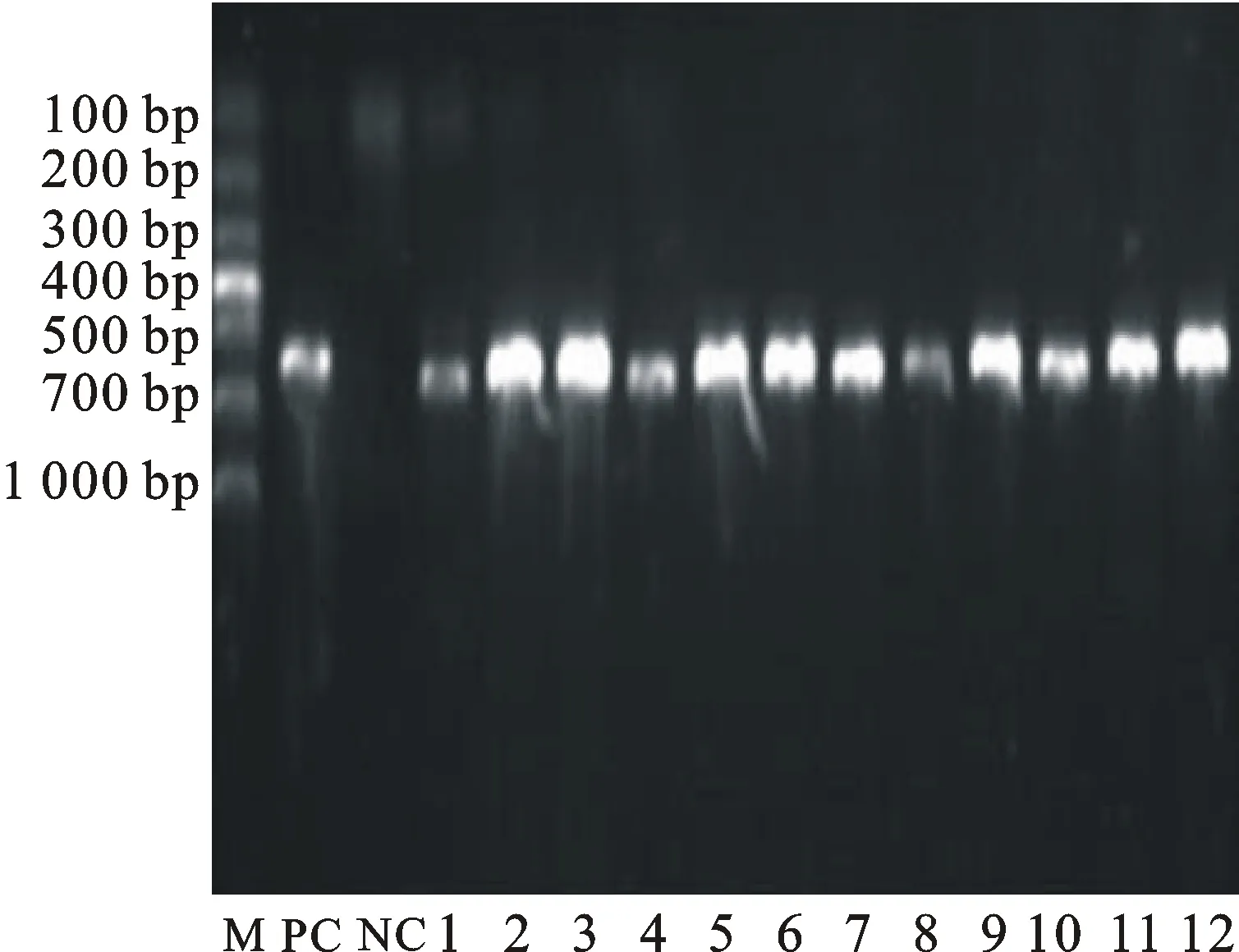
M.DL1000;PC.阳性对照 Positive control;NC.阴性对照 Negative control;1~12.分离菌16S rDNA产物 Amplification products of bacterial 16S rDNA
图2 部分分离菌16S rDNA鉴定
Fig.2 Amplification products of bacterial 16S rDNA

A.伊红美蓝培养基的鉴别结果:箭头所示为分离菌的菌落形态 The identification of Eosin-Methy Blue Agar Medium: the colony morphology of clinical isolates indicated by the arrow; B.麦康凯培养基的鉴别结果:箭头所示为致病性分离菌的菌落形态 The identification of MacConkey Agar Medium: the colony morphology of pathogenic and clinical isolates indicated by the arrow
图3 分离菌在伊红美蓝培养基和麦康凯培养基上形成的菌落
Fig.3 The colony morphology of bacteria on Eosin-Methy Blue and MacConkey Agar Medium
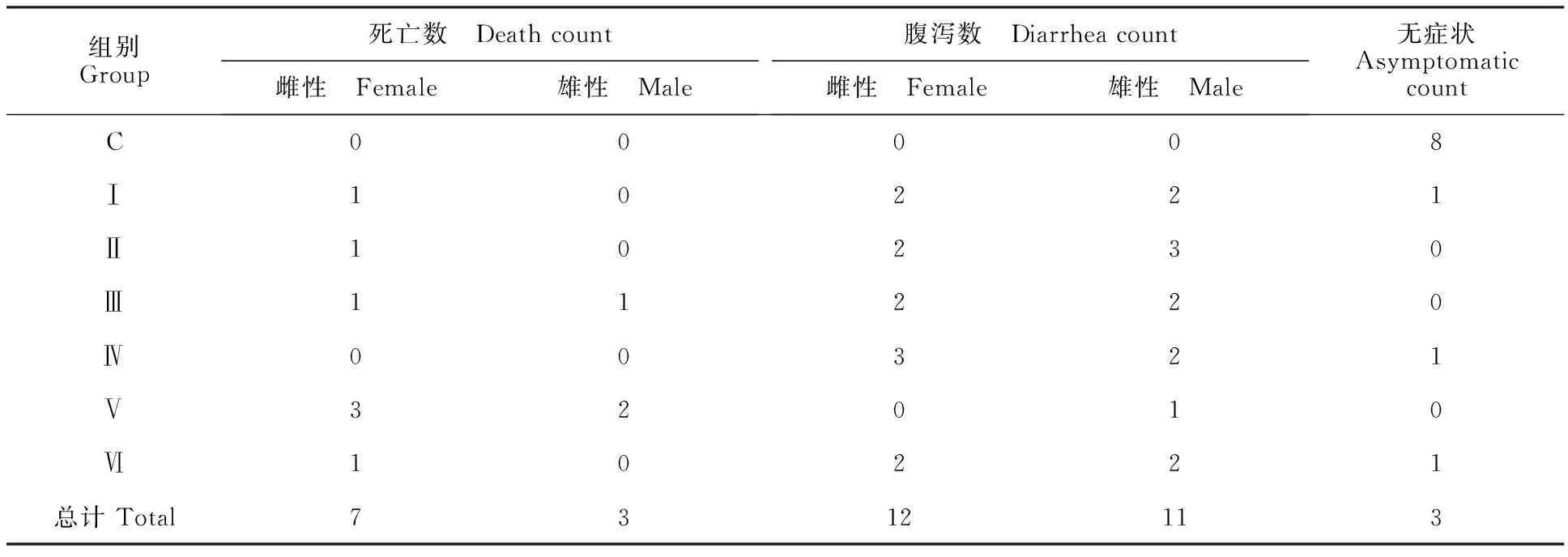
表1 分离菌对小白鼠的致病情况Table 1 The bacterial pathogenicity to mouse
3 讨 论
各地区引起羔羊腹泻的优势病原不尽相同,细菌、病毒等病原均可导致该病的发生、传播,甚至暴发流行,给临床防治带来巨大挑战[10-11],弄清病原是防治该病的关键。随着分子生物学技术的发展,PCR技术已成为病原检测的主要手段,细菌16S rDNA鉴定更是细菌鉴定的金标准;但是有些病原,如肠杆菌科的大肠埃希菌属和志贺菌属的细菌同源性较高,仅用16S rDNA扩增后进行比对可能无法区分[12-13]。因此,本研究采用16S rDNA扩增结合细菌鉴别培养,对甘肃地区导致羔羊腹泻的大肠埃希菌进行分离鉴定。结果从92份腹泻病料中分离得到21株(检出率为22.8%)致病性大肠埃希菌(麦康凯培养基上生长良好,菌落为粉红色;部分菌株致小鼠腹泻或死亡),由此可推断大肠埃希菌是甘肃地区致羔羊腹泻的主要病原之一。

图4 分离菌多重耐药性分析Fig.4 Multidrug resistance analysis of clinical isolates

抗生素Antimicrobialdrug耐药菌株数Drugresistantstrains耐药率/%Drugresistantrate抗生素Antimicrobialdrug耐药菌株数Drugresistantstrains耐药率/%Drugresistantrate青霉素 Penicillin2095.2氧氟沙星 Ofloxacin314.3氨苄西林 Ampicillins838.1环丙沙星 Ciprofloxacin628.6阿莫西林 Amoxicillin1257.1丁胺卡那 Amikacin628.6头孢氨苄 Cephalexin1047.6链霉素 Streptomycin1885.7头孢噻肟 Cefotaxime1152.4庆大霉素 Gentamicin733.3头孢西丁 Cefoxitin523.8新霉素 Neomycin838.1杆菌肽 Bacitracin21100卡那霉素 Kanamycin942.9复方新诺明 Co-trimoxazole733.3克林霉素 Clindamycin1781.0磺胺甲基异恶唑 SMZ942.9红霉素 Erythromycin1676.2诺氟沙星 Noroxin419.0四环素 Tetracycline628.6
致病性大肠埃希菌可导致几乎所有动物发病,在养羊企业中更是屡见不鲜,其主要症状表现为腹泻和败血症[1-2, 14-16]。中国在20世纪80年代有报道[8],17%的新生羔羊腹泻症由大肠埃希菌所致。然而,有些致病性大肠埃希菌在机体肠道环境好转时可能会失去致病性而变为常在菌株[17-18]。本研究从甘肃地区分离的23株细菌中有2株在麦康凯培养基上不生长,可能这2只羔羊的腹泻症是由其他原因所致,分离到的是肠道常在大肠埃希菌;也可能是由于该2只羊机体好转(免疫力增强)而使菌株失去致病性(不再产生毒素)。致病性试验结果表明,随机选取在麦康凯培养基上生长良好的菌株对条件相似小鼠的致病性有一定差异(Ⅱ、Ⅲ、Ⅴ组的小鼠全部死亡或发生腹泻,Ⅰ、Ⅳ、Ⅵ组均有1只小鼠无症状,而且死亡和腹泻的小鼠数量不同),说明该地区大肠埃希菌的致病性存在差异。
病原菌对抗生素的耐药情况日趋严重,特别是多重耐药大肠埃希菌的大量出现使临床防治变得愈加困难[19-21]。本研究对分离的21株致病性大肠埃希菌进行耐药性试验发现,甘肃地区羊源致病性大肠埃希菌的耐药情况严重,普遍出现多重耐药,对红霉素、链霉素、克林霉素等有较高的耐药性(超过76%),而且对杆菌肽、青霉素表现出接近100%的耐药性;说明这些羊场可能对抗生素的选用存在问题。细菌耐药性形成的主要原因是长期使用同类抗生素和滥用抗生素[19, 22];因此,合理、规范并且交替更换使用抗生素才能对羔羊腹泻发挥有效的防治作用。
4 结 论
通过对甘肃部分地区引起羔羊腹泻的病原进行分离鉴定,分离出21株致病性大肠埃希菌,说明大肠埃希菌仍然是该地区引起羔羊腹泻的主要病原之一;对分离的菌株进行耐药性分析发现,该地区的羊源致病性大肠埃希菌对多种抗生素具有耐药性,而且多重耐药情况严重。
Reference:
[1] ANDRE S,JIMENEZ A,SANCHEZ J,etal.Evaluation of some etiological factors predisposing to diarrhoea in lambs in ‘La Serena’(Southwest Spain)[J].SmallRuminantResearch,2007,70(2/3):272-275.
[2] SWEENY J P A,RYAN U M,ROBERTSON I D,etal.Prevalence and on-farm risk factors for diarrhoea in meat lamb flocks in Western Australia[J].TheVeterinaryJournal,2012,192(3): 503-510.
[3] 杨 耀,李小玲.甘南州藏羔羊腹泻病病原调查[J].畜牧与兽医,2015,47(1):90-93.
YANG Y,LI X L.Etiology investigation of the Tibetan lamb diarrhea in Gannan Tibetan Autonomous Prefecture[J].AnimalHusbandryandVeterinaryMedicine,2015,47(1):90-93(in Chinese).
[4] 丁清泉.羔羊腹泻病毒病原的研究进展[J].内蒙古畜牧科学,1988,7(4):18-22.
DING Q Q.Progress of the viral etiology in lamb diarrhea disease [J].InnerMongoliaAnimalHusbandryScience,1988,7(4):18-22(in Chinese).
[5] GALINDO-CARDIEL I,FEMANDEZ-JIMENEZ M,LUJAN L,etal.Novel group A rotavirus G8 P [1]as primary cause of an ovine diarrheic syndrome outbreak in weaned lambs[J].VeterinaryMicrobiology,2011,149(3/4):467-471.
[6] BHAT M A,NISHIKAWA Y,WANI S A.Prevalence and virulence gene profiles of Shiga toxin-producingEscherichiacoliand enteropathogenicEscherichiacolifrom diarrhoeic and healthy lambs in India [J].SmallRuminantResearch,2008,75(1):65-70.
[7] 妥 鑫,刘永明,黄美州,等.羔羊腹泻细菌和病毒病原的研究进展[J].中国畜牧兽医,2016,43(3):831-836.
TUO X,LIU Y M,HUANG M ZH,etal.Research progress on the bacterial and viral etiology of lamb diarrhea [J].ChinaAnimalHusbandryandVeterinaryMedicine,2016,43(3):831-836(in Chinese with English abstract).
[8] 杨正时.动物病原性大肠杆菌与大肠杆菌病[J].中国兽医科技,1987(6):25-29.
YANG ZH SH.Animal pathogenicEscherichiacoliandEscherichiacolidisease[J].ChineseJournalofVeterinaryScienceandTechnology,1987(6):25-29(in Chinese).
[9] 武庭斌.高原地区羔羊大肠杆菌病病因分析及防治措施[J].畜牧兽医杂志,2016,35(1):123-126.
WU T B.Etiological analysis and prevention measures of theE.colidisease in plateau lambs [J].JournalofAnimalScienceandVeterinaryMedicine,2016,35(1):123-126(in Chinese).
[10] 徐文忠,陆承平.动物的腹泻[J].中国人兽共患病杂志,1993,9(2):45-48.
XU W ZH,LU CH P.Animal diarrhea [J].ChineseJournalofZoonoses,1993,9(2):45-48(in Chinese).
[11] 胡先春,金利峰,李彩红,等.动物急性感染性腹泻的病原、发病机制和治疗[J].黄牛杂志,2005,31(4):81-83.
HU X CH,JIN L F,LI C H,etal.Etiology,pathogenesis and therapy of acute infective diarrhea in animal[J].JournalofYellowCattleScience,2005,31(4):81-83(in Chinese).
[12] 刘朝军,沈定霞.16S rDNA序列测定在细菌鉴定中的应用[J].军医进修学院学报,2011,12(7):774-776.
LIU CH J,SHEN D X.Application of 16S rDNA sequencing for identification of bacteria [J].JournalofChinesePeople’sLiberationArmyPostgradMedicalSchool,2011,12(7):774-776(in Chinese).
[13] 詹銮峰,郭维植.病原菌鉴定分型方法的研究概况[J].海峡预防医学杂志,2006,12(2):26-28.
ZHAN L F,GUO W ZH.The research situation of identification classification method of etiology [J].StraitJournalofPreventiveMedicine,2006,12(2):26-28(in Chinese).
[14] LARSEN J W,ANDERSON N,VIZARD A L.The pathogenesis and control of diarrhoea and breech soiling in adult Merino sheep [J].InternationalJournalforParasitology,1999,29(6):893-902.
[15] MARTELLA V,DECARO N,BUONAVGLIA C.Enteric viral infections in lambs or kids [J].VeterinaryMicrobiol,2015,181(1/2):154-160.
[16] WANI S A,BHAT M A,SAMANTAI,etal.Epidemiology of diarrhoea caused by rotavirus andEscherichiacoliin lambs in Kashmir valley,India[J].SmallRuminantResearch,2004,52(1/2):145-153.
[17] 孙和涛.致病性大肠杆菌对动物机体免疫机能及肠道形态结构的影响[D].呼和浩特:内蒙古农业大学,2013.
SUN H T.Effect of bovine pathogenicE.colion animal immune function and intestinal morphology [D].Hohhot:Inner Mongolia Agricultural University,2013(in Chinese with English abstract).
[18] 刘栓奎,李 明,党荣理,等.致病性大肠杆菌和出血性大肠杆菌研究进展[J].现代预防医学,2011,38(24):5123-5124.
LIU SH K,LI M,DANG R L,etal.Progress of enteropanthogenicEscherichiacoliand enterohemphagicEscherichiacoli[J].ModernPreventiveMedicine,2011,38(24):5123-5124(in Chinese with English abstract).
[19] 朱力军.动物大肠杆菌耐药性的变化趋势[J].中国兽药杂志,2001,35(2):16-18.
ZHU L J.Changes of antimicrobial resistance ofE.coli[J].ChineseJournalofVeterinaryMedicine,2001,35(2):16-18(in Chinese with English abstract).
[20] GASCOIGNEE,MILLARM.Multidrug resistance in enterotoxigenic K99E.coliinfection in lambs[J].VeterinaryRecord,2015,177(2):52-52.
[21] 杨 微.大肠杆菌耐药性的研究进展[J].畜牧与饲料科学,2011,32(6):116-118.
YANG W.The progress of drug resistance ofE.coli[J].AnimalHusbandryandFeedScience,2011,32(6):116-118(in Chinese).
[22] 肖永红.细菌耐药:挑战与对策[J].中国执业药师,2011,8(6):3-8.
XIAO Y H.Bacterial resistance:challenge and strategies [J].ChinaLicensedPharmacist,2011,8(6):3-8(in Chinese with English abstract).
(责任编辑:顾玉兰 Responsible editor:GU Yulan)
Identification and Drug Resistance Analysis ofEscherichiacoliIsolated from Diarrheic Neonatal Lambs in Gansu Area
TUO Xin, WANG Shengyi, WANG Hui, CUI Dong’an, HUANG Meizhou and LIU Yongming
(Key Laboratory of Veterinary Pharmaceutical Development of Ministry of Agriculture/Key Laboratory of New Animal Drug Project of Gansu Province / Engineering & Technology Research Center of Traditional Chinese Veterinary Medicine of Gansu Province,Lanzhou Institute of Husbandry and Pharmaceutics Sciences of Chinese Academy of Agricultural Sciences,Lanzhou 730050,China)
The objective of the study was to research the pathogenesis and drug resistance ofEscherichiacoliin diarrheic neonatal lambs in Gansu area.The 92 feces samples were collected from 8 lamb farms in Gansu province, where the lambs appeared diarrhea symptoms.The pathogenicE.coliwas isolated and identified using amplification technology of 16S rDNA and microbial cultivation methods and 6 strains were selected randomly to conduct pathogenicity and drug resistance test.The results showed that 21 pathogenicE.colistrains were isolated from 92 samples; the 6 strains selected randomly possessed of certain pathogenicity; and these pathogenicE.coliin Gansu area had appeared high resistance to commonly used antimicrobial drugs.The results suggested that theE.coliwas still the etiology of the diarrheic neonatal lambs in Gansu area and with very serious drug resistance.
Neonatal; Diarrhea;E.coli; Pathogenicity; Drug resistance.
TUO Xin, male, master student.Research area: prevention and treatment diarrhea of lambs.E-mail:tuoxin232@163.com
LIU Yongming, male, research fellow.Research area: animal nutrition and metabolic diseases.E-mail:myslym@sina.com
日期:2016-12-29
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20161229.1005.004.html
2016-03-15
2016-04-28
公益性行业专项课题(20130304-17);国家科技支撑计划(2012BAD12B03)。
妥 鑫,男,硕士研究生,研究方向为羔羊腹泻病与防治。E-mail:tuoxin232@163.com
刘永明,男,研究员,研究方向为动物营养与代谢病。E-mail: myslym@sina.com
S857.3+1
A
1004-1389(2017)02-0167-06
Received 2016-03-15 Returned 2016-04-28
Foundation item The Special Found for Agro-scientific Research in the Public Interest(No.20130304-17); the National Key Technology Research and Development of the Ministry of Science and Technology of China(No.2012BAD12B03).

