基于真空渗入法的转基因大白菜植株的获得
赵 静,吴俊清,李庆飞,张 静,张鲁刚
(1.西北农林科技大学 园艺学院,农业部西北地区园艺作物生物学与种质资源创新重点实验室,陕西杨凌 712100;2.山西农业大学 园艺学院,山西太古 030800)
基于真空渗入法的转基因大白菜植株的获得
赵 静1,吴俊清1,李庆飞1,张 静2,张鲁刚1
(1.西北农林科技大学 园艺学院,农业部西北地区园艺作物生物学与种质资源创新重点实验室,陕西杨凌 712100;2.山西农业大学 园艺学院,山西太古 030800)
采用真空渗入法,将萝卜 VPE1基因的干扰载体pRNAi- RsVPE1转入大白菜中,共收获2 414粒种子,在质量浓度为30 mg/L的卡那霉素筛选下获得抗性株297株,其中9株经PCR检测呈阳性,转化率为0.37%。Real-time PCR检测结果表明,pRNAi- RsVPE1的转入导致转基因大白菜叶片中同源的BraVPE在RNA水平上的表达量下降,验证了转基因植株的可靠性,为进一步深入研究BraVPE基因功能奠定了基础。
真空渗入法;大白菜;BraVPE转基因;RNAi载体
大白菜[BrassicacampestrisL.spp.pekinensis(Lour.) Olsson](AA,2n=20) 属于十字花科芸薹属白菜种,原产中国,有着悠久的栽培历史[1]。因其产量高、营养丰富及其食用方法的多样性深受中国及世界人民的喜爱。近年来,利用转基因技术,将外源目的基因转入到植物体内可以更快、更直接地进行目标性状的改良。转基因技术与常规育种技术相结合,不仅可以缩短育种周期、稳定后代选择,而且可以增强育种目的性,提高育种效率。随着生物技术的飞速发展与运用,已出现多种植物转基因技术[2],且其在植物育种方面的应用也日益广泛,并取得很大进展[3]。
目前,在大白菜上研究较多的遗传转化是基于组织培养技术的叶盘转化法,虽然许多研究者用此方法得到了转基因植株[4-6],但由于大白菜的脱分化与再分化较困难、转化率低、农杆菌感染效果差、感染后不易分化且受基因型的影响较大等缺点限制了该技术的普及[7-9]。因此,探索不依赖于组织培养的转化方法一直是相关领域的研究重点以及热点。非组织培养转基因技术是对活体植株的受体细胞直接进行基因转化,然后经植株正常的生长发育,最终获得转基因植株[10]。植株原位真空渗入法避开了组织培养的过程,具有操作简单,实用性强的优点,目前该法已在拟南芥[11]、油菜[12]、甘蓝型油菜[13]、芥菜[14]和不结球白菜[15]上进行了尝试,并获得了成功。
大白菜基因组测序工作于2011年完成,后基因组学时代急需建立简单高效的转基因技术体系,以此来探索基因的功能。本研究旨在利用真空渗入法将RNA干扰载体pRNAi- RsVPE1转入大白菜,通过卡那霉素筛选以及PCR的进一步检测获得转基因植株,以此建立基于真空渗入法的大白菜原位转化体系,为进行大白菜的遗传改良好基因功能验证提供技术支撑。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 本试验所用的大白菜转化受体为92S105纯系和雄性不育系94C9,由西北农林科技大学园艺学院大白菜课题组提供。
1.1.2 菌株与载体 根癌农杆菌(Agrobacterium tumefaciens)菌株为GV3101,由旱区作物逆境生物学国家重点实验室保存并提供。RNA干扰载体pRNAi- RsVPE1(含NPT基因)由西北农林科技大学园艺学院大白菜课题组构建保存。
1.1.3 培养基 用于培养农杆菌以及大肠杆菌的LB 培养基:酵母提取物5 g/L,胰蛋白胨10 g/L,NaCl 10 g/L,调至pH为7.0,如果是固体培养基,1 L的体积中还应加入琼脂15 g。
1.1.4 试剂 RNA提取试剂盒,卡那霉素(Kanamycin)、利福平(Rifampicin)、硫酸庆大霉素(Gentamicin)、乙酰丁香酮(Acetosyringone)为OMEGA公司产品;PrimeScriptTM一链cDNA合成试剂盒和SYBR GREEN I染料为TaKaRa公司产品;大肠杆菌感受态Top10为天根生化科技有限公司;DNA Marker DL2000由西安沃尔森生物技术公司进口分装,其他试剂均为国产分析纯。
1.2 方 法
1.2.1 大白菜的遗传转化 转化植株的准备:大白菜种子浸种、催芽之后待培养皿中2/3的种子露白时,在培养皿中加入4~5 mL质量分数为20%的聚乙二醇,将培养皿置于4 ℃冰箱。光照培养30 d后,播种于西北农林科技大学科研温室,待其开始抽薹开花时即可进行遗传转化。
转化液的制备:挑取含有目的基因载体的农杆菌GV3101单个菌落,接种于2 mL含有50 mg/L利福平(Rif),50 mg/L硫酸庆大霉素(Gen)和50 mg/L卡那霉素(Kan)的LB液体培养基中,于28 ℃ 180 r/min下培养过夜。将培养过夜的农杆菌菌液以1∶100稀释于500 mL大瓶培养基中,再在28 ℃ 180 r/min条件下培养至OD600约为0.8。然后在4 ℃ 5 000 r/min离心3 min,收集菌体,将菌体悬浮于当天配制的转化缓冲液中。转化缓冲液配置如下:MS粉2.236 g,蔗糖50.0 g,Silwet L-77 1 mL,乙酰丁香酮(As) 1 mL,将以上试剂混匀。用1 mol/L的NaOH调至pH约为5.8,定容至1 L。
遗传转化:先将配置好的转化缓冲溶液置于冰上3~4 h。因为转化缓冲液中加入As的作用原理是:As可诱导农杆菌Vir基因活化,从而促进外源基因的整合[16]。在转化进行的当天尽量使转化植株处于失水萎蔫的状态,转化前必须去掉转化植株上的果荚和当天开的花,用已消毒的镊子对当天长至最终大小的花蕾进行剥蕾,用保鲜膜固定好营养钵中的基质,以防其松散落入转化液中。将转化液倒入真空干燥器中(20 L),然后将处理好的转化植株倒置放入真空干燥器,尽可能使更多的花序浸入到转化液中,进行真空渗入处理。对转化植株进行真空渗入处理可以增加植株的转化率[17-19]。
试验采用的真空渗入转化参数为:0.07 MPa、7 min +5 min,抽真空后观察到植株叶片表面呈现水渍状。由于湿润的柱头不利于花粉的萌发以及花粉管的伸长,因此必须立即将吹风机调至冷风挡将花蕾柱头吹干,然后对其进行授粉。将植株置于黑暗条件下[11]生长2 d之后移至正常环境生长,直到正常结籽。
1.2.2 抗卡那霉素质量浓度筛选 首先对大白菜种子进行消毒,具体的做法是:用体积分数为70%的酒精浸泡30 s,用蒸馏水冲洗1遍,体积分数为12.5%的次氯酸钠冲洗10 min,蒸馏水冲洗3~5遍,然后将消毒的种子放到质量浓度分别为0、10、20、30、40和50 mg/L的带有卡那霉素溶液的培养皿中,每个培养皿中20粒种子,每个处理重复3次。置于12 h的光照培养间,第7天时,根据幼苗子叶的颜色以及新叶的生长状况,确定适宜的卡那霉素质量浓度。将真空渗入处理得到的T0种子消毒后播种于卡那霉素溶液中,萌发后观察子叶颜色及新叶生长状况,进行抗性筛选。
1.2.3 转基因植株的PCR检测 将经过卡那霉素抗性筛选得到的植株种植于温室,待植株长至7~8片叶,用改良的CTAB法[20]分别提取转基因植株和非转基因植株的总DNA,以未转基因植株的DNA为阴性对照,质粒DNA 检测为阳性的为阳性对照,并以其为模板进行PCR扩增。RNA干扰载体pRNAi- RsVPE1序列引物(F:5′- GGGATTGGCTGAGACGAAA -3′和R:5′- CGAGATTTTCAGGAGCTAAGGA -3′)和筛选标记基因NPTⅡ引物(F:5′-GGCGATACCGTAAAGCAC-3′和R:5′-GACCACCAAG-CGAAACAT-3′)由上海生工生物工程技术服务有限公司合成。PCR扩增体系:基因组DNA 1 μL,2×TaqMasterMix 5 μL,Primer 0.5 μL,ddH2O 3.5 μL。PCR 反应程序:94 ℃预变性4 min;94 ℃变性30 s,62 ℃退火30 s(NPTⅡ:58 ℃),72 ℃延伸1 min,28 次循环(NPTⅡ:32);72 ℃延伸10 min。PCR 产物用质量浓度为15 g/L的琼脂糖凝胶电泳进行检测。
1.2.4 转基因植株的Real-time PCR检测 分别以转基因植株(Tr)及未转基因植株(CK)的叶片为材料。采用Bioflux公司Biozol试剂提取总RNA;反转录用Takara公司的 PrimeScriptTM1st Strand cDNA Synthesis Kit;荧光定量PCR按照Takara公司的SYBR○RPremix ExTaqTMI荧光染料说明书进行。以大白菜 EF-1-α基因(GO479260)为内参基因,分析了与 RsVPE1基因同源性最高的基因BraVPE的表达水平。 EF-1-α内参基因引物(F:5′- ATACCAGGCTTGAGCATACCG-3′,R:5′- GCCAAAGAGGC-CA TCAGACAA-3′);目的基因荧光定量引物为(BraVPEF:5′- GACTGCTGGTGGTGCG-TCTGCT-3′,BraVPER:5′- GGTGCCTTTCGGTACTTATCCC-3′)。扩增条件为:95 ℃预变性30 s;95 ℃变性5 s,62 ℃退火并延伸30 s,40个循环。每个样品设3次生物学重复。用 2-△△CT法获得目标基因的相对表达量。
2 结果与分析
2.1 卡那霉素抗性质量浓度筛选
利用标记基因对大量转基因后代进行鉴定、筛选,是一种经济简便的方法[21]。本试验所用的载体中含有卡那霉素抗性的标记基因,因此试验中需要筛选适宜的卡那霉素质量浓度,以此来对转基因得到的种子进行筛选。在预试验中将卡那霉素的质量浓度设置为0、50、100、150、200和250 mg/L时,结果只有0 mg/L的条件下的幼苗为绿色,其余质量浓度下幼苗全部黄化。因此在正式试验时,将抗生素质量浓度梯度设置为0、10、20、30、40和50 mg/L(图1),处理第7天时,大白菜幼苗的子叶颜色、生长点和根的伸长等都表现不同程度抑制,具体表现为,随着卡那霉素质量浓度的递增,大白菜幼苗子叶的颜色从绿色到浅绿、黄绿、黄色,直至白化。当培养基中无卡那霉素时,子叶颜色为正常的绿色,当卡那霉素质量浓度为10 mg/L 时,部分幼苗子叶开始变成浅绿色或黄色;当卡那霉素质量浓度为20 mg/L 时,大部分幼苗子叶颜色黄化,部分子叶开始白化;卡那霉素增加至 30 mg/L 以上时,幼苗表现相似,大约3/4的幼苗子叶白化,幼苗生长点无新叶长出。因此该试验中将卡那霉素30 mg/L设定为筛选转基因大白菜种子的适宜质量浓度。
取单个幼苗进一步观察发现,卡那霉素对幼苗生长点也有明显的影响,具体表现为生长点发紫,且无新叶长出。另外,由于卡那霉素的作用,幼苗根的生长也受到抑制,在0 mg/L的卡那霉素溶液中,大白菜幼苗的主根较长,且须根多;而在30 mg/L的卡那霉素溶液中,幼苗主根短且须根少,如图2。
2.2 转基因植株的获得以及PCR检测
对转化得到的种子进行卡那霉素抗性筛选,具体做法是先对种子进行消毒,然后置于30 mg/L 的卡那霉素溶液,7 d后生长健壮且存活的植株即为抗性植株。本试验中经转化共得到2 414粒种子,卡那霉素抗性筛选得到297株。将经过卡那霉素抗性筛选存活的植株移栽至温室,待其长至7~8片叶,取其叶片提取DNA进行PCR检测。以未转基因植株的DNA为阴性对照,以检测为阳性的质粒DNA 为阳性对照,结果共有9株在目的基因pRNAi- RsVPE1和筛选标记基因NPTⅡ2个位点均表现阳性,因此将其确认为转基因植株,其转化效率为0.37%,检测结果如图3所示。

A、B、C、D、E和F 分别代表0 mg/L、10 mg/L、20 mg/L、30 mg/L、40 mg/L和50 mg/L的卡那霉素。
A,B,C,D,E and F:Kanamycin mass concentration of 0 mg/L,10 mg/L,20 mg/L,30 mg/L,40 mg/L and 50 mg/L.
图1 抗性卡那霉素适宜质量浓度的筛选
Fig.1 Screening of suitable mass concentration of kanamycin with resistance

A,B分别代表在0 mg/L 和30 mg/L的卡那霉素作用下幼苗的生长状况。
A and B :Growth condition of seedlings under kanamycin mass concentration of 0 mg/L and 30 mg/L.
图2 卡那霉素对大白菜幼苗的影响
Fig.2 Effect of kanamycin on Chinese cabbage seedlings
2.3 转基因植株的VPE基因表达分析
以转基因植株和未转基因植株叶片的cDNA为模板,进行real-time PCR分析,检测了与 RsVPE1基因同源性最高的白菜基因BraVPE(Bra011398)的表达水平。由于pRNAi- RsVPE1通过真空渗入法转入大白菜,干扰了大白菜中与其同源的BraVPE基因的表达,从而导致转基因植株中BraVPE基因表达量的下降,其表达量仅为对照植株中表达量的1/10(图4)。此结果表明,pRNAi- RsVPE1在转基因植株RNA水平上得到了表达,再次验证了该试验中得到的转基因植株的可靠性。

A.NPTⅡ引物检测 Indentification ofNPTⅡ primers; B.pRNAi- RsVPE1引物检测 Identification of pRNAi- RsVPE1 primers;M.100 bp Marker;W.模板为水 DNA template is water; -.阴性对照 Negative control;+.阳性对照 Positive control;1~9.独立的转基因植株 1 to 9.Independent transgenic plants
图3 转基因植株PCR检测
Fig.3 Identification of positive transgenic plants by PCR
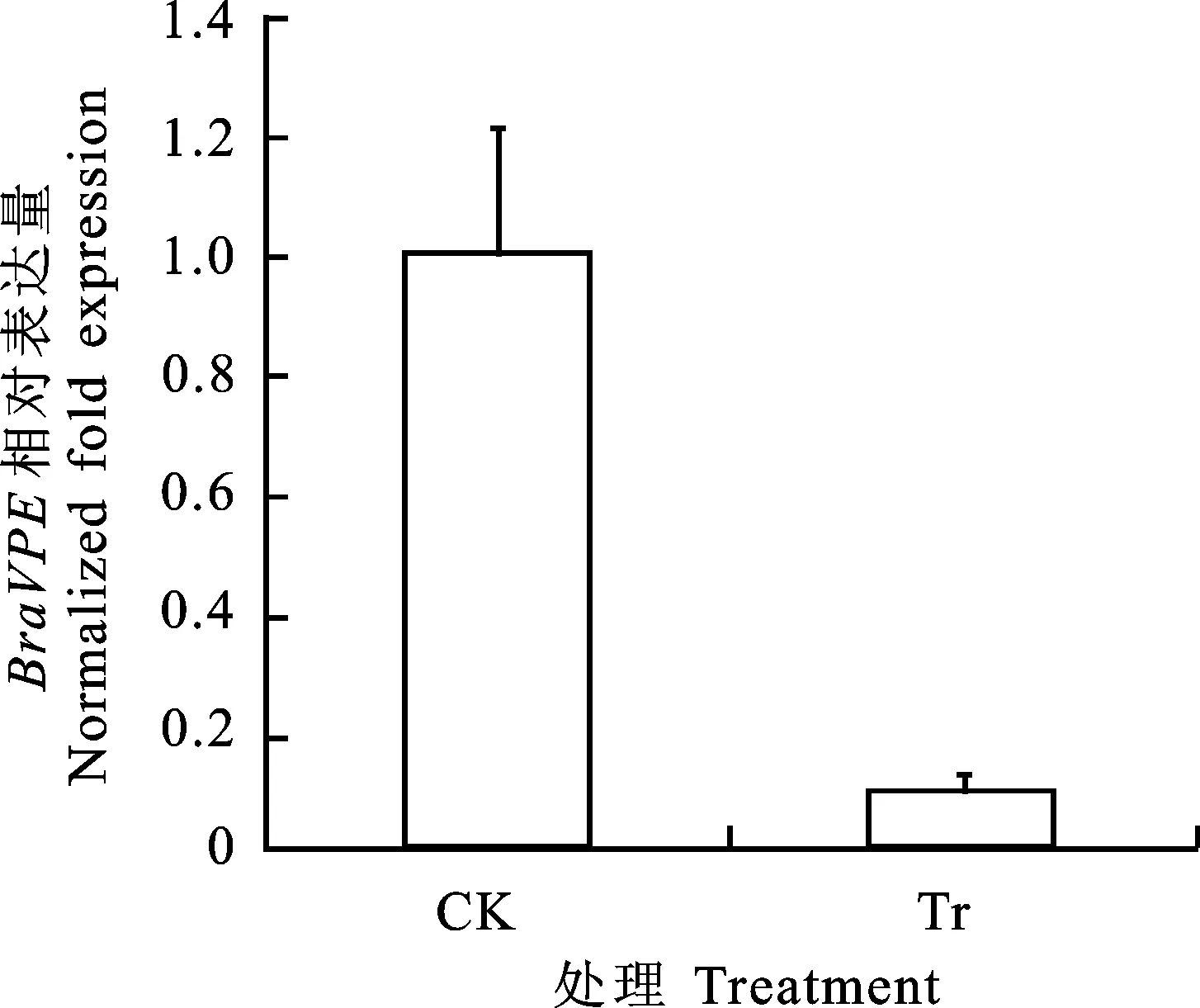
CK.未转基因植株CK Non-transgenic plants;Tr.pRNAi- RsVPE1 大白菜转基因植株Tr Transgenic plants
图4 转基因大白菜叶片中BraVPE表达水平
Fig.4 Expression level ofBraVPEin transgenic Chinese cabbage
3 结论与讨论
本试验利用真空渗入法对已抽薹的大白菜植株进行原位转化,将萝卜的RNA干扰载体pRNAi- RsVPE1转入大白菜受体植株,经过卡那霉素抗性筛选、DNA以及RNA分子水平的检测,证明pRNAi- RsVPE1载体已经成功整合到大白菜的基因组,为进一步深入研究BraVPE基因功能奠定了基础。
近年来,各国科研工作者对大白菜的遗传转化进行了一系列的探究,研究最多的是组织培养法[22],但是该法转化率较低,为0.35%~1.13%,并且影响转化率的各种因素还有待进一步的优化[7]。真空渗入法的原理是利用真空处理使受体植株受伤,直接促进农杆菌的侵染,不需要组织培养,简单易行,有效地缩短了培养周期。自Clough等[23]首次在拟南芥上用蘸花法取得成功尝试之后,该法已在萝卜[24]、甘蓝型油菜[25]以及苜蓿[26]上取得成功。Bechtold等[27]最早将该法运用在蒺藜苜蓿(Medicagotruncatula)上,Trieu等[28]用该法在豆科植物百脉根中获得2.9%~76%的转化率,Xu等[29]在小白菜上也得到了0.39%的转化率,芥菜的转化率为0.56%[30],油菜的转化率为11.2%[12]。但在大白菜上应用真空渗入法成功进行遗传转化的报道很少,本研究获得9株PCR阳性转基因植株,其转化效率为0.37%,说明应用真空渗入法进行大白菜遗传转化是可行的。
目前,通过真空渗入法获得的转化植株的遗传稳定性的研究还不够,用该方法得到转基因植株的检测都在基因整合阶段,报道最多的就是PCR、PCR- Southern以及Southern。此外基因沉默的发生在转基因过程中很常见,因此,在转录以及翻译水平上的检测显得至关重要[9]。
Reference:
[1] 林维申.中国白菜分类的探讨[J].园艺学报,1980(2):21-28.
LIN W SH.A study on the classification of Chinese cabbages[J].ActaHorticulturaeSinica,1980(2):21-28(in Chinese with English abstract).
[2] 张 彬,张怀渝.植物转基因技术及其应用[J].安徽科技,2005(5):54-56.
ZHANG B,ZHANG H Y.Application and technology of transgenic plants[J].AnhuiScienceandTechnology,2005(5):54-56(in Chinese).
[3] 黄 珊.植物转基因技术及其应用[J].福建稻麦科技,2012(1):84-86.
HUANG SH.Transgenic technology andapplication in plants[J].FujianScienceandTechnologyofRiceandWheat,2012(1):84-86(in Chinese with English abstract).
[4] 张凤兰.白菜根癌农杆菌介导法基因转化体系的建立[C]//蔬菜分子育种研讨会论文集.北京:中国园艺学会蔬菜专业委员会、中国农业科学院蔬菜花卉研究所,2004:22-29.
ZHANG F L.Transformation of Chinese Cabbage by Agrobacterium-mediated Method [C]//Seminar on Molecular Breeding of Vegetables.Beijing:Institute of Vegetables and Flowers, Chinese Academy of Agricultural Sciences,Chinese Academy of Horticulture,2004:22-29(in Chinese with English abstract).
[5] 茹 磊.大白菜离体再生体系的建立及遗传转化[D].陕西杨凌:西北农林科技大学,2011.
RU L.Regeration system in vitro and genetic transformation of heading Chinese cabbage[D].Yangling Shaanxi:Northwest A&F University,2011(in Chinese with English abstract).
[6] 贾艳丽.农杆菌介导的白菜高效遗传转化体系研究[D].北京:中国农业科学院,2014.
JIA Y L.Study on highly efficient transformation system ofBrassicarapamediated byAgrobacterium[D].Beijing:Chinese Academy of Agricultural Sciences,2014(in Chinese with English abstract).
[7] 陈泠先,崔丽洁,钱忠英,等.普通白菜遗传转化研究进展[J].中国蔬菜,2012(24):1-6.
CHEN L X,CUI L J,QIAN ZH Y,etal.Research progress in genetic transformation ofBrassicacampestrisL.spp.chinensis(L.) Makino var.communisTsen et Lee[J].ChinaVegetables,2012(24):1-6(in Chinese with English abstract).
[8] RAO A Q,BAKHSH A,KIANI S,etal.The myth of plant transformation[J].BiotechnologyAdvances,2009,27(6):753-763.
[9] 高 丽,崔崇士,屈淑平.白菜类蔬菜转基因研究进展[J].中国蔬菜,2010,1(12):7-13.
GAO L,CUI CH SH,QU SH P.Research progress on transgenosis technology of Chinese cabbage group[J].ChinaVegetables,2010,1(12):7-13(in Chinese with English abstract).
[10] 黄国中,丁 博,王俊斌,等.小麦非组织培养转基因技术研究及展望[J].分子植物育种,2014,12(4):817-824.
HUANG G ZH,DING B,WANG J B,etal.Advances in wheat transformation using non-tissue culture technology[J].MolecularPlantBreeding,2014,12(4):817-824(in Chinese with English abstract).
[11] 巩振辉,何玉科.拟南芥基因转移新方法一真空渗入法的研究[J].西北植物学报,1996(3):277-283.
GONG ZH H,HE Y K.Studies on a new gene transformation method-vacuum infiltration transformation [J].ActaBotanicaBoreali-occidentaliaSinica,1996(3):277-283(in Chinese with English abstract).
[12] 张广辉,巩振辉,薛万新,等.大白菜和油菜真空渗入遗传转化法初报[J].西北农业大学学报,1998(4):6-9.
ZHANG G H,GONG ZH H,XUE W X,etal.Vacuum infiltration genetic transformation method in Chinese cabbage and rape [J].JournalofNorthwestSci-TechUniversityofAgricultureandForestry,1998(4):6-9(in Chinese with English abstract).
[13] WANG W C,MENON G,HANSEN G.Development of a novelAgrobacterium-mediated transformation method to recover transgenicBrassicanapusplants[J].PlantCellReports,2003,22(4):274-281.
[14] CHHIKARA S,CHAUDHARY D,YADAV M,etal.A non-tissue culture approach for developing transgenicBrassicajunceaL.plants withAgrobacteriumtumefaciens[J].InVitroCellular&DevelopmentalBiology-Plant,2012,48(1):7-14.
[15] QING C M,FAN L,LEI Y,etal.Transformation of Pakchoi (BrassicarapaL.sppchinensis) byAgrobacteriuminfiltration[J].MolecularBreeding,2000,6(1):67-72.
[16] 董喜才,杜建中,王安乐,等.乙酰丁香酮在植物转基因研究中的作用[J].中国农学通报,2011,27(5):292-299.
DONG X C,DU J ZH,WANG A L,etal.Role of acetosyringone in plants transformation researcher [J].ChineseAgriculturalScienceBulletin,2011,27(5):292-299(in Chinese with English abstract).
[17] 刘 凡,王国英,曹鸣庆.农杆菌介导的植物原位转基因方法研究进展[J].分子植物育种,2003,1(1):108-115.
LIU F,WANG G Y,CAO M Q.Research progress on in planta transformation mediated byAgrobacterium[J].MolecularPlantBreeding,2003,1(1):108-115(in Chinese with English abstract).
[18] 熊换英,钟伟光,张寿文.农杆菌介导的植物遗传转化影响因素研究进展[J].安徽农业科学,2012,40(17):9214-9217.
XIONG H Y,ZHONG W G,ZHANG SH W.Research progress in the influencing factors ofAgrobacterium-mediated genetic transformation of plants[J].JournalofAnhuiAgriculturalSciences,2012,40(17):9214-9217(in Chinese with English abstract).
[19] ZUPAN J R,WARD D,ZAMBRYSKI P.Assembly of the VirB transport complex for DNA transfer fromAgrobacteriumtumefaciensto plant cells[J].CurrentOpinioninMicrobiology,1998,1(6):649-655.
[20] ALLEN G C,FLORES-VERGARA M A,KRASNYANSKI S,etal.A modified protocol for rapid DNA isolation from plant tissues using cetyltrimethy lammonium bromide[J].NatureProtocols,2006,1(5):2320-2325.
[21] 王 峰,卢永恩,李汉霞.几种白菜类蔬菜卡那霉素抗性的研究[J].武汉植物学研究,2006,24(4):377-380.
WANG F,LU Y E,LI H X.Kanamycin resistance of several vegetableBrassicas[J].JournalofWuhanBotanicalResearch,2006,24(4):377-380(in Chinese with English abstract).
[22] 贾艳丽,吴 磊,卢长明.白菜高效遗传转化体系研究进展[J].中国油料作物学报,2013(10):16-24.
JIA Y L,WU L,LU CH M.Research progress of high efficiency of transformation system in Chinese cabbage[J].ChineseJournalofOilCropSciences,2013(10):16-24.(in Chinese with English abstract).
[23] CLOUGH S J,BENT A F.Floral dip:a simplified method for Agrobacterium-mediated transformation ofArabidopsisthaliana[J].PlantJournal,1998,16(6):735-743.
[24] CURTIS I S,NAM H G.Transgenic radish (RaphanussativusL.longipinnatusBailey) by floral-dip method-plant development and surfactant are important in optimizing transformation efficiency[J].TransgenicResearch,2001,10(4):363-371.
[25] VERMA S S,CHIINNUSARNY V,BANSAL K C.A simplified floral dip method for transformation ofBrassicanapusand B-carinata[J].JournalofPlantBiochemistryandBiotechnology,2008,17(2):197-200.
[26] TRIEU A T,BURLEIGH S H,KARDAILSKY I V,etal.Transformation ofMedicagotruncatulavia infiltration of seedlings or flowering plants withAgrobacterium[J].PlantJournal,2000,22(6):531-541.
[27] BECHTOLD N,PELLETIER G.In planta Agrobacterium-mediated transformation of adultArabidopsisthalianaplants by vacuum infiltration[J].MethodsinMolecularBiology(Clifton,N.J.),1998,82(10):259-266.
[28] TRIEU A T,BURLEIGH S H,KARDAILSKY I V,etal.Transformation ofMedicagotruncatulavia infiltration of seedlings or flowering plants withAgrobacterium[J].PlantJournal,2000,22(6):531-541.
[29] XU H,WANG X,ZHAO H,etal.An intensive understanding of vacuum infiltration transformation of pakchoi (Brassicarapaspp.chinensis)[J].PlantCellReports,2008,27(8):1369-1376.
[30] 金万梅,巩振辉,宋正旭,等.通过植株原位真空渗入遗传转化获得转基因芥菜[J].西北农林科技大学学报(自然科学版),2003,31(5):39-42.
JIN W M,GONG ZH H,SONG ZH X,etal.Transfo rmation of mustards (Brassicajuncea) by the plant in situ vacuum infitration[J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2003,31(5):39-42(in Chinese with English abstract).
(责任编辑:潘学燕 Responsible editor:PAN Xueyan)
Obtaining Transgenic Plants of Chinese Cabbage Based on Vacuum Infiltration
ZHAO Jing1,WU Junqing1,LI Qingfei1,ZHANG Jing2and ZHANG Lugang1
(1.College of Horticulture,Northwest A&F University;Key Laboratory of Horticulture Plant Biology and Germplasm Innovation in Northwest China,Ministry of Agriculture of P.R.China,Yangling Shaanxi 712100,China; 2.College of Horticulture,Shanxi Agricultural University,Taigu Shanxi 030800,China)
The vector pRNAi- RsVPE1 was transformed into Chinese cabbage by vacuum infiltration method and total 2 414 seeds were obtained.The kanamycin concentration 30 mg/L was determined to be the most suitable for selecting transgenic plants.297 transgenic plants resistant to kanamycin were obtained,of which 9 positive transgenic plants were verified by PCR detection,and the transgenic rate was 0.37%.RT-PCR detection showed that the expression level ofBraVPEin transgenic plants decreased significantly,reliability of transgenic plants was verified.Therefore ,the above results laid a foundation for further study inBraVPEgene functions.
Vacuum infiltration; Chinese cabbage;BraVPE; Genetic transformation; RNAi vector
ZHAO Jing,female,master.Research area:vegetable genetics and breeding,biotechnology.E-mail:ZhaoJing7_16@126.com
ZHANG Lugang,male,professor,Ph.D,doctoral supervisor.Research area:biotechnology of vegetable genetic breeding.E-mail:lugangzh@163.com
日期:2016-12-29
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20161229.1008.026.html
2016-03-28
2016-04-25
国家科技支撑计划(2012BAD02B015);西北农林科技大学唐仲英育种基金;陕西省蔬菜产业体系。
赵 静,女,硕士,研究方向为蔬菜遗传育种与生物技术。E-mail:ZhaoJing7_16@126.com
张鲁刚,男,教授,博士,博士生导师,主要从事蔬菜生物技术与遗传育种研究。E-mail:lugangzh@163.com
S634.1
A
1004-1389(2017)02-0248-07
Received 2016-03-28 Returned 2016-04-25
Foundation item National Science and Technology Support Program (No.2012BAD02B015);Cyrus Tang Breeding Foundation of Northwest A&F University;Vegetable Industry System of Shaanxi Province.

