生物炭对减弱土壤盐渍化的贡献及其机理探讨
唐珺瑶,赵永杰,曲 东,孙 林
(西北农林科技大学 资源环境学院,陕西杨凌 712100)
生物炭对减弱土壤盐渍化的贡献及其机理探讨
唐珺瑶,赵永杰,曲 东,孙 林
(西北农林科技大学 资源环境学院,陕西杨凌 712100)
以3种不同盐碱化水稻土(吉林、宁夏和天津)为材料,采用土壤泥浆厌氧培养法,通过对添加不同用量生物炭的培养体系中游离碳酸盐质量摩尔浓度、pH、脱氢酶活性及Fe(II) 质量分数的变化趋势分析,以期验证生物炭在减弱土壤盐渍化过程中的贡献及进行必要的机理探讨。结果表明:生物炭能够促进碳酸盐的溶出,在吉林、宁夏和天津3种水稻土中添加生物炭后,碳酸盐的溶出量较CK分别增长0.405~1.590、0.894~3.592、0.725~2.278 μmol/g,且碳酸盐的溶出量随生物炭用量的增加而升高;添加生物炭对体系脱氢酶活性具有显著促进作用,3种土壤中脱氢酶活性较CK分别增加6.53~15.45、1.76~4.25和8.81~21.13 μg/(mL·g·min);土壤pH在淹水过程均有降低,但由于土壤的缓冲性导致不同生物炭处理间无显著差异;生物炭的添加显著促进微生物铁还原进程,3种水稻土在培养过程中最大铁还原潜势较CK分别增长0.017~0.034、0.088~0.436、0.023~0.437 μg/mL,且生物炭用量与Fe(Ⅱ)质量分数呈正相关。典范对应分析表明,土壤初始pH与碳酸氢盐变化量极显著相关,说明生物炭对碳酸盐溶出量的影响因土壤性质不同而存在差异;吉林和宁夏水稻土各处理差异显著,天津水稻土中,添加生物炭对铁还原过程有促进作用,但生物炭用量的作用差异不明显。推测生物炭通过促进土壤的脱氢-产氢过程进而增加碳酸盐向碳酸氢盐的转化,通过强化微生物铁还原过程增加对碳酸盐的固定。
生物炭;水稻土;微生物铁还原;盐碱土改良;碳酸盐
根据联合国教科文组织和粮农组织不完全统计,中国盐碱地面积约占全世界的10%。土壤盐碱严重地区植物几乎不能生存。中国针对盐碱土改良的研究已积累大量成果,其措施也表现出多样性[1-4],其中利用“旱改水”措施在一些地区已体现出显著功效[5-6]。然而,在“旱改水”过程中,土壤中的盐分依旧存在,如何有效地降低盐分的影响,是该措施推广和扩大利用范围的核心。生物炭(biochar)是有机质在缺氧环境下经热化学转化而成的多孔含碳固体,具有适于在环境中长时间安全贮存碳的物理化学性质[7]。土壤中加入生物炭,不仅可改变土壤中的离子平衡、调节盐基离子浓度和pH,而且能够显著提高土壤中微生物的活性及多样性,改善微生物的附着性,促进土壤微生物的生长,进而可强化生物抗盐和生物净化的能力。在中国各大农业区进行的试验表明,在盐碱瘠薄土壤、环境污染土壤、退化板结土壤上施用生物炭,均表现出快速消除低产因子,规避和控制重金属污染,遏止盐分上升等作用[8-11]。然而,上述研究大多是基于旱地农田,对“旱改水”过程中生物炭的功效尚缺乏系统的认识。
在淹水稻田中,厌氧环境能够使土壤中的铁锰氧化物发生异化还原,Fe(Ⅲ)还原是其中重要的微生物代谢过程[12],添加生物炭能够改变盐基离子、微生物及有机物的聚集状态,所以伴随的厌氧微生物学过程也会发生改变。碱土和碱化土壤在形成过程中,大部分伴随着土壤中碳酸盐的累积,因此碱化度普遍较高,在“旱改水”过程中的土壤渍水层通常具有调节碳酸盐溶解平衡的作用,添加生物炭后,由于微生物的聚集可增加微生物对无机碳的利用[13],此外,厌氧环境下微生物铁还原过程可形成难溶性FeCO3,可减少土壤中碳酸盐的游离度[14-15]。本研究选取3种不同盐渍化程度的水稻土,采用厌氧泥浆培养法,添加不同用量的生物炭,通过对培养过程中碳酸盐溶出量和Fe(Ⅲ)还原过程的分析,探究添加生物炭后淹水土壤中碳酸盐赋存形态的变化特征,进一步阐明生物炭在“旱改水”措施中降低土壤盐碱化的机理。
1 材料与方法
1.1 供试材料
供试水稻土为采自吉林省松原市前郭尔罗斯县查干花镇(JL)、宁夏中卫市沙坡头区滨河镇大板村(NX)、天津市塘沽区四道桥农场(TJ)。采集收获后的稻田0~20 cm 土样,自然风干,磨细,过1 mm 土壤筛。JL、NX和TJ水稻土的有机质质量分数分别为6.42、26.51、24.22 g/kg;全N质量分数分别为0.81、1.75、1.25 g/kg;pH分别为10.51、7.59、8.69;游离铁质量分数分别为16.06、13.35、8.55 g/kg;无定形铁质量分数分别为3.19、1.59、2.54 g/kg。JL土壤为苏打碱土,通过“旱改水”耕作模式进行减少盐渍化改良;NX土壤为石灰性土壤,耕作方式为水旱轮作;TJ土壤属于滨海盐土,盐分质量分数较高。
1.2 供试生物炭
试验所用的生物炭为林果木枝条生物炭,购于陕西亿鑫能源科技有限公司。生产工艺流程为干燥除水,挤压成形,装釜加热(550 ℃,6~8 h)和停火冷却。生物炭基本组成中C、H、N和灰分质量分数分别占81.13%、2.36%、0.69%、2.67%。
1.3 试验设计
1.3.1 试验处理 采用土壤泥浆厌氧培养法,设置5种添加不同用量生物炭处理,并以不添加生物炭为对照(CK)共6个处理。称取过1 mm土壤筛的风干土样3.000 g若干份,置于容积为10 mL的血清瓶中,分别称取0.015、0.030、0.060、0.120、0.240 g粒径小于1 mm的生物炭,即土样质量的0.5%、1%、2%、4%、8%,按V(液)∶m(土)=1∶1加入去离子水,充N2除去瓶中O2,加橡胶盖及铝盖密封,于30 ℃下恒温避光培养,定期采集样品,每次处理采样3瓶,即3个重复,进行游离碳酸盐质量摩尔浓度、pH和Fe(Ⅱ) 质量分数的测定。
1.3.2 指标测定 泥浆中游离碳酸盐质量摩尔浓度测定采用酸碱滴定方法。用涡旋仪将厌氧培养的泥浆混合均匀,迅速吸取泥浆置于2 mL离心管中,在6 000 r/min下离心10 min,收集上清液。吸取1 mL上清液于100 mL锥形瓶中,加入10 mL无CO2的去离子水,加2滴酚酞指示剂,用 HCl标准溶液滴定至无色,记录HCl标准溶液的体积;再加2滴溴酚蓝指示剂,继续滴定至溶液由蓝紫色变为黄绿色,记录HCl标准溶液的体积,平行测定3次。依据消耗的标准盐酸量计算碳酸盐及碳酸氢盐质量摩尔浓度。
Fe(Ⅱ)测定采用邻菲罗啉比色法[16]。采样前用涡旋仪充分混匀泥浆样品,迅速取0.4 mL泥浆置于含4.6 mL 0.5 mol/L HCl的聚乙烯管中,加样前后对聚乙烯管称量以确定所采集土壤泥浆的质量,获得干土质量。于30 ℃恒温下浸提24 h。测定时将样品在3 000 r/min下离心10 min,取0.5 mL上清液于50 mL容量瓶中,加入5 mL 1 mol/L NaAc和5 mL的1 g/L邻菲罗啉显色,定容后于510 nm下用分光光度法测定吸光值,依据标准曲线确定Fe(Ⅱ)质量分数。
pH测定采用玻璃电极电位法。
脱氢酶活性(DHA)测定采用TTC分光光度法[17]。将样品充分涡旋混匀,取1 mL样品置于含有2 mL Tris-HCl缓冲液(pH=8.4)、0.5 mL 3.6 mg/mL Na2SO3溶液和0.5 mL 1%TTC溶液的离心管中,于37 ℃恒温水浴反应15 min,加入0.4 mL甲醛终止反应,加4 mL无水乙醇作萃取剂,37 ℃恒温避光,以200 r/min振荡10 min。离心(3 500 r/min,5 min)取上清液,于480 nm下测定TTC接受H+后被还原为三苯基甲臜(TF)的吸光度。为消除生物炭的吸附作用对显色结果的影响,通过计算生物炭对TF的吸附率,进行脱氢酶活性测定值的校正。按照标准溶液的制备方法配置一定量TF溶液,分别称取0.001 75、0.003 5、0.007 0、0.014 0、0.028 0 g生物炭于离心管中,加入8 mL TF溶液,以不添加生物炭作为对照,震荡吸附30 min,取滤液于480 nm处测定吸光度。分别计算不同用添加量生物炭对TF的吸附率,以样品的测定值除以对应生物炭的吸附率进行校正。
1.4 数据处理
利用Logistic生长曲线方程对铁还原过程中Fe(Ⅱ)质量分数随时间的变化进行拟合。Logistic方程表达式为:Ct=a/(1+be-ct),其中,Ct表示培养时间为t时体系中Fe(Ⅱ)质量分数,a为体系中Fe(Ⅲ)还原的最大潜势,b为模型参数,c为反应速率常数。最大反应速率(Vmax),在数值上等于0.25ac;最大还原速率对应的时间(TVmax)以lnb/c计算。试验数据经Excel 2007整理后用Origin 8.0作图,并用CurveExpert 1.3对试验所得结果进行拟合;用SPSS 16.0进行方差分析,采用最小显著差数法(LSD)检验试验数据的差异显著性;采用CANOCO 4.5进行典范对应分析(CCA)[18]。
2 结果与分析
2.1 不同生物炭添加量对水稻土中游离碳酸盐、碳酸氢盐质量摩尔浓度的影响
在3种水稻土中添加不同量的生物炭后,培养过程中土壤泥浆中游离态碳酸盐、碳酸氢盐质量摩尔浓度变化如图1所示。
由于NX和TJ水稻土在培养后的pH在8.3(酚酞指示剂变色点)以下或附近,所以滴定过程中仅有碳酸氢盐被测出。在宁夏灌区的次生盐渍化土壤中碳酸氢盐的质量摩尔浓度随着淹水时间的增加呈现出不断增大的变化趋势,即碳酸盐的游离度不断增大,在培养25 d后增速变缓;TJ水稻土与JL水稻土中碳酸氢盐的变化表现出相似的趋势,培养前期碳酸氢盐质量摩尔浓度不断增大,在培养第11 天后基本趋于稳定,增幅约13.48~14.37μmol/g。碳酸盐的溶出量较CK分别增长0.894~3.592、0.725~2.278 μmol/g。整体表明淹水过程增加土壤中碳酸盐的游离度,加速土壤中碳酸盐的溶出。水稻土初始pH越高,碳酸盐溶出量越大;添加生物炭量越高,碳酸氢盐质量浓度越大。

图1 添加不同量生物炭的厌氧水稻土泥浆中碳酸盐、碳酸氢盐的变化Fig.1 Changes of carbonate and bicarbonate mass fractions with different amount of biochar addition in anaerobic paddy soil slurry
2.2 不同生物炭添加量对水稻土中pH的影响
水稻土在厌氧培养过程中pH变化如图2所示,3种不同水稻土均表现为随着培养时间的延长泥浆体系pH逐渐降低,pH的降低在培养初期(前10 d)十分明显,表明铁还原过程对降低盐渍化土壤的pH具有明显的作用。JL水稻土未添加生物炭处理的初始pH为10.27,添加8%生物炭的处理pH为10.34,即生物炭对苏打碱土的初始pH影响不显著。TJ水稻土未添加生物炭的处理的初始pH为8.28,而添加8%生物炭的处理pH为8.50;NX水稻土未添加生物炭的处理起始pH为7.57,而添加8%生物炭的处理初始pH为7.71,体现出生物炭中的矿质元素水解所呈现出的碱性特征。在培养过程中,JL水稻土添加8%生物炭处理的pH从10.34降到9.87,对于强碱性的苏打碱土来说,泥浆pH的降低幅度尽管有限,但也反映出微生物过程对土壤酸碱性具有影响,这对降低盐碱土的危害具有重要意义。NX水稻土添加8%生物炭处理的pH从7.71下降到7.12,宁夏水稻土属于黄土母质上发育的石灰性土壤,土壤中pH较高是由土壤中碳酸钙的溶解平衡引起,添加的生物炭为由枝条制备,其灰份中可能含有较高的钙,所以在钙相对较高的宁夏水稻土中生物炭对pH的影响更为明显。TJ水稻土添加8%生物炭处理的pH从8.50下降到7.46,该水稻土是在沉积物的基础上发育而来,一定量的盐分能够促进微生物活动,因而pH的变化最为显著。在培养过程中,添加生物炭处理的pH基本高于CK处理,添加量越大,pH越高,但添加不同用量生物炭处理之间无明显的差异。

图2 添加不同量生物炭的厌氧水稻土泥浆中pH的变化Fig.2 Changes of pH with different amount of biochar addition in anaerobic paddy soil slurry
2.3 不同生物炭添加量对水稻土中微生物铁还原过程的影响
添加不同量的生物炭后,水稻土厌氧培养体系中微生物Fe(Ⅲ)还原能力变化如图3所示。总体来看,随着培养时间的进行,Fe(Ⅱ)质量分数均呈现出先迅速增加之后稳定的趋势,且随着生物炭添加量的增加,土壤中氧化铁的还原能力增强。JL、NX和TJ水稻土的初始Fe(Ⅱ)质量分数分别为0.19、1.15和0.95 mg/g,而添加8%生物炭处理分别为0.83、1.50和1.99 mg/g。添加生物炭处理中的铁质量分数的初始值明显高于未添加生物炭的处理,表明添加的生物炭中可能会带入部分的Fe(Ⅱ)。JL水稻土不同处理在培养过程中Fe(Ⅱ)质量分数增加0.39~1.03 mg/g,且在培养前10 d迅速增加,达到约1.22 mg/g时保持稳定;NX水稻土不同处理在培养过程中Fe(Ⅱ)质量分数增加4.39~4.77 mg/g,在培养前10 d迅速增加,10~20 d增速变缓,达到5.9 mg/g左右时保持稳定;TJ水稻土不同处理在培养过程中Fe(Ⅱ)质量分数增加5.30~5.96 mg/g,且在培养前10 d迅速增加,达到7.15 mg/g左右时保持稳定。
采用Logistic模型对不同处理的Fe(Ⅲ)还原过程进行拟合(表1),各处理的相关系数达0.887~0.993,说明Logistic方程能很好的描述3种水稻土在添加不同量生物炭后微生物还原Fe(Ⅲ)的特征。由表1可知,JL水稻土中,添加4%和8%生物炭的处理,其铁还原潜势(a)较CK增长0.017~0.034 μg/mL,增幅约1.3%~2.6%,处理间差异不显著;添加4%和8%生物炭的处理Vmax较其他处理显著增加; TVmax随着生物炭添加量的增加而减少,添加生物炭的处理与CK存在显著差异。生物炭对NX水稻土Fe(Ⅲ)还原过程的影响与JL水稻土相似,添加4%和8%的生物炭对a和Vmax的影响最为显著,TVmax也表现为随着生物炭添加量的增加而缩短。NX水稻土铁还原潜势(a)较CK增长0.088~0.436 μg/mL,增幅约2.2%~7.6%,与JL水稻土相比,添加生物炭在NX水稻土中的作用则更为明显。TJ水稻土中,a较CK增长0.023~0.437 μg/mL,增幅约0.3%~6.5%,表现为随着生物炭添加量的增加而增加,其中添加8%生物炭的处理与CK和添加0.5%的处理差异显著,各处理的Vmax无显著差异; TVmax与前2种水稻土表现相似,即随着生物炭添加量的增加而缩短。

图3 添加不同量生物炭的厌氧水稻土泥浆中Fe(Ⅱ)质量分数的变化Fig.3 Changes of Fe(Ⅱ) mass fraction with different amount of biochar addition in anaerobic paddy soil slurry

土壤Soil处理TreatmentLogistic方程参数Logisticmodelparametersa/(μg/mL)bc/d-1rVmax/[μg/(L·d)]TVmax/dJLCK1.308±0.088a3.136±0.4220.382±0.1050.9840.125±0.033c3.061±0.455a0.5%1.258±0.035b2.345±0.0350.618±0.1880.9830.193±0.053c1.382±0.182b1%1.303±0.021a1.759±0.1960.535±0.0880.9880.174±0.028c1.043±0.053bc2%1.304±0.011a1.365±0.3020.568±0.1840.9190.185±0.059c0.509±0.458cd4%1.325±0.032a2.146±0.5441.479±0.8260.8870.486±0.266b0.573±0.195cd8%1.342±0.022a2.401±0.3212.249±0.2380.8990.754±0.070a0.387±0.042dNXCK5.728±0.095b2.642±0.3230.226±0.0160.9900.324±0.025b4.263±0.309a0.5%5.857±0.056b2.353±0.0560.229±0.0140.9890.335±0.018b3.745±0.110b1%5.816±0.041b2.549±0.2150.277±0.0230.9880.402±0.031b3.381±0.365b2%5.854±0.105b2.175±0.0760.285±0.0340.9870.417±0.043b2.739±0.237c4%6.093±0.109a2.250±0.0890.350±0.0360.9890.533±0.052a2.325±0.133cd8%6.164±0.166a2.178±0.3470.375±0.0700.9850.579±0.108a2.040±0.108dTJCK6.704±0.208b6.524±0.4640.521±0.0930.9930.870±0.131a3.669±0.630a0.5%6.727±0.276b6.967±0.2760.604±0.0730.9911.012±0.084a3.235±0.295ab1%6.855±0.228ab5.575±1.4860.558±0.1060.9890.953±0.162a3.069±0.337ab2%6.859±0.045ab4.566±0.9520.550±0.0880.9910.943±0.149a2.730±0.104bc4%6.904±0.138ab3.568±0.3490.534±0.0510.9930.922±0.080a2.380±0.109c8%7.141±0.052a2.960±0.3690.465±0.0470.9930.830±0.081a2.324±0.150c
注:不同小写字母表示多重比较差异显著(P<0.05)。
Note:Different lowercase letter means significant differences(P<0.05).
2.4 生物炭添加量对水稻土中脱氢酶活性的影响
3种水稻土中添加不同量生物炭处理的脱氢酶活性变化如图4所示。由图4看出,添加生物炭处理的脱氢酶活性较CK有明显升高,JL、NX和TJ水稻土中不同生物炭处理在培养过程中脱氢酶活性分别增加6.53~15.45、1.76~4.25及8.81~21.13 μg/(mL·g·min),各处理间差异显著。JL水稻土中不同生物炭添加量对脱氢酶活性的影响表现为:2%>4%>8%>1%>0.5%>CK,NX水稻土中表现为:4%>8%>2%>1%>0.5%>CK,TJ水稻土中随着生物炭添加量的增大脱氢酶活性不断升高,表明生物炭添加量对不同水稻土脱氢酶活性影响的差异与土壤性质有关。3种水稻土中脱氢酶活性在培养初期均迅速升高,JL、NX水稻土分别在培养第25天和第15天时脱氢酶活性趋于稳定,TJ水稻土在培养后期脱氢酶活性增长变缓。

图4 添加不同量生物炭的厌氧水稻土泥浆中脱氢酶活性的变化
Fig.4 Changes of dehydrogenase activity with different amount of biochar addition in anaerobic paddy soil slurry
培养过程中生物炭对微生物活性的促进作用是引起盐碱土pH降低、碳酸盐减少的重要因素之一。由图4可以看出,添加生物炭后培养体系脱氢酶活性较CK有明显升高,脱氢酶活性升高能够促进有机质进行脱氢反应[19]。脱氢反应导致体系中H+质量分数增加,pH自然会出现降低的趋势,而脱氢酶活性迅速增长的时间段与碳酸氢盐快速降低的时间段基本重合,说明游离态碳酸盐能够与H+结合形成碳酸氢盐,从而降低碳酸盐质量摩尔浓度。对比图1和图4可以发现,脱氢酶活性指标中各处理的差异较碳酸盐质量摩尔浓度中的显著,这是由于在淹水培养过程中,由脱氢酶作用产生的H+在氢化酶的作用下产生了H2。
2.5 不同生物炭添加量处理与土壤环境因子的典范对应分析
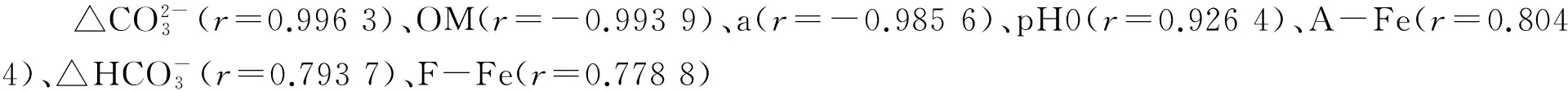

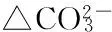
图5 3种水稻土中不同生物炭添加量处理与土壤环境因子的典范对应分析(解释量为97.9%)
Fig.5 CCA of three soil samples with different amount of biochar addition and soil environmental factors (The first two axes explained 97.9% of the variance)
3 讨论与结论
向供试的3种碱性水稻土中加入不同量生物炭后,体系中的Fe(Ⅱ)质量分数大约在0~10 d不断上升,随后逐渐趋于平衡,且随着生物炭添加量的增加,体系中的Fe(Ⅱ)质量分数逐渐增加。这是由于在满足微生物生存环境条件下,微生物很快适应厌氧环境,迅速开始Fe(Ⅲ)还原反应,而生物炭孔隙较多,比表面积大,这些都能够为水稻土中微生物提供更多更好的生存环境;此外,生物炭能够吸附聚集更多的营养物质,这有利于微生物异化Fe(Ⅲ)还原过程的发生,因而生物炭可促进微生物Fe(Ⅲ)还原过程。在培养后期Fe(Ⅱ)质量分数趋于平衡,这是由于体系中微生物可利用的铁氧化物被充分消耗还原,微生物Fe(Ⅲ)还原作用也逐渐减弱趋于平衡。添加生物炭后的初始Fe(Ⅱ)质量分数较CK有一定的增加,原因一方面在于生物炭自身带入的盐分中可能有部分的铁氧化物,另一方面微生物可以利用其中的其他物质增强其代谢活动。


表2 水稻土体系中碳酸盐质量摩尔浓度、碳酸氢盐质量摩尔浓度与pH的person相关性分析Table 2 Person’s correlation efficient between , molality and pH in paddy soil
注:**表示P<0.01。
Note:** Significant atP<0.01 level.
黎立群等[21]研究表明,“旱改水”过程对盐碱土盐分的降低主要由于静水压力的作用,土壤中的盐分随重力水下渗,并向旁侧移动,通过排水沟将盐分排出灌区。而在本试验模拟水稻土渍水层中,微生物发酵有机物的产氢产酸过程成为降低盐碱土pH、盐分质量分数的重要因素。通过试验结果可以看出,向供试土壤中添加生物炭后,土壤浸出液中游离态碳酸盐质量摩尔浓度下降,游离态碳酸氢盐质量摩尔浓度上升,且随着生物炭用量的增大,游离态碳酸盐、碳酸氢盐质量摩尔浓度越高。游离态碳酸盐在培养过程中降低,一方面由于生物炭对微生物活性的促进作用;另一方面与淹水过程中碳酸盐的水解有关,碳酸盐水解平衡方程式如下:

(1)

(2)

Reference:
[1] 周和平,张立新,禹 锋,等.我国盐碱地改良技术综述及展望[J].现代农业科技,2007,23(11):159-161,164.
ZHOU H P,ZHANG L X,YU F,etal.A review and prospect on improvement technology of saline-alkali soil in China[J].ModernAgriculturalSciencesandTechnology,2007,23(11):159-161,164(in Chinese).
[2] BARRETT-LENNARD E G.Restoration of saline land through revegetation[J].AgriculturalWaterManagement,2002,53(1):213-226.
[3] TERRY R E,NELSON S D.Effects of polyacrylamide and irrigation method on soil physical properties[J].SoilScience,1986,141(5):317.
[4] 张 朝,刘美英,陈学平.转TaW基因提高烟草的耐盐性[J].中国烟草学报,2011,17(3):78-81.
ZHANG CH,LIU M Y,CHEN X P.Improving salt resistance in TaW transgenic tobacco[J].ActaTabacariaSinica,2011,17(3):78-81(in Chinese with English abstract).
[5] 王 英.旱改水种稻治涝防止土壤次生盐渍化研究[J].中国农学通报,2005,21(3):215-217.
WANG Y.The prevention measure of soil secondary salinization for paddy rice replacing dry rice[J].ChineseAgriculturalScienceBulletin,2005,21(3):215-217(in Chinese with English abstract).
[6] 王 英.不同灌溉方式对土壤次生盐渍化的影响[J].中国农学通报,2005,21(2):178-180.
WANG Y.The effect of different douche ways on soil secondary salinization[J].ChineseAgriculturalScienceBulletin,2005,21(2):178-180(in Chinese with English abstract).
[7] VAN Z L,KIMBER S,MORRIS S,etal.Effects of biochar from slow pyrolysis of papermill waste on agronomic performance and soil fertility [J].PlantandSoil,2010,327 (1/2):235-246.
[8] 张芙蓉,赵丽娜,张 瑞,等.生物炭对盐渍化土壤改良及甜瓜生长的影响[J].上海农业学报,2015,31(1):54-58.
ZHANG F R,ZHAO L N,ZHANG R,etal.Effects of biochar on saline soil improvement and melon growth[J].ActaAgriculturaeShanghai,2015,31(1):54-58(in Chinese with English abstract).
[9] 王桂君,许振文,田晓露,等.生物炭对盐碱化土壤理化性质及小麦幼苗生长的影响[J].江苏农业科学,2013,41(12):390-393.
WANG G J,XU ZH W,TIAN X L,etal.Effects of biochar on saline soil physico-chemical properties and wheat seedling growth[J].JiangsuAgriculturalSciences,2013,41(12):390-393(in Chinese).
[10] 农明英,张乃明,史 静,等.外源有机物料对次生盐渍化大棚土壤的改良效果[J].中国土壤与肥料,2013(6):6-10.
NONG M Y,ZHANG N M,SHI J,etal.Effects of exogenous organic materials on the improvement of greenhouse soil salinization [J].SoilsandFertilizersSciencesinChina,2013(6):6-10(in Chinese with English abstract).
[11] 刘鸿骄,侯亚红,王 磊.秸秆生物炭还田对围垦盐碱土壤的低碳化改良[J].环境科学与技术,2014,37(1):75-80.
LIU H J,HOU Y H,WANG L.Alemioration effect of reed straw biochar returning to salty soil in the view of low carbon point[J].EnvironmentalScience&Technology,2014,37(1):75-80(in Chinese with English abstract).
[12] LOVLEY D R,HOLMES D E,NEVIN K P.Dissimilatory Fe(Ⅲ) and Mn(IV) reduction[J].AdvancedinMicrobialPhysiology,2004,49:219-286.
[13] 孙丽蓉,黄海霞,王旭刚,等.褐土中铁的氧化还原与碳素转化[J].土壤学报,2013,50(3):540-547.
SUN L R,HUANG H X,WANG X G,etal.Relationship between anaerobic redox of iron oxides and carbon transformation in cinnamon soil [J].ActaPedologicaSinica,2013,50(3):540-547(in Chinese with English abstract).
[14] 曲 东,张一平,Schneli S,等.水稻土中铁氧化物的厌氧还原及其对微生物过程的影响[J].土壤学报,2003,40(6):858-863.
QU D,ZHANG Y P,SCHNELL S,etal.Reduction of iron oxides and its effect on microbial processes in anaerobic paddy soil[J].ActaPedologicaSinica,2003,40(6):858-863(in Chinese with English abstract).
[15] 宋建潇,吴 超,曲 东.有机碳源对水稻土中微生物铁还原特征的影响[J].农业环境科学学报,2013,32(2):299-306.
SONG J X,WU CH,QU D.The effect of origin carbon on microbial iron reduction in paddy soil[J].JournalofAgro-EnvironmentScience,2013,32(2):299-306(in Chinese with English abstract).
[16] PHILLIPS E J P,LOVLEY D R.Determination of Fe(Ⅲ) and Fe(Ⅱ) in oxalate extracts of sediment[J].SoilScienceSocietyofAmerica,1987,51(4):938-941.
[17] TIAN Q,CHEN J H,ZHANG H,etal.Study on the modified triphenyl tetrazolium chloride-dehydrogenase activity(TTC-DHA)method in determination of bioactivity in the up-flow aerated bio-activated carbon filter[J].AfricanJournalofBiotechnology,2006,5(2):181-188.
[18] HOY C W,GREWAL P S,LAWRENCE J L,etal.Canonical correspondence analysis demonstrates unique soil conditions for entomopathogenic nematode species compared with other free-living nematode species[J].BiologicalControl,2008,46 (3):371-379.
[19] JIA R,LI L N,QU D.Ph shift-mediated dehydrogenation and hydrogen production are responsible for microbial iron(Ⅲ) reduction in submerged paddy soils[J].JournalofSoilsandSediments,2015,15(5):1178-1190.
[20] 何 群,陈家坊.中性水稻土中的铁解及其影响[J].土壤学报,1986,23(2):184-188.
HE Q,CHEN J F.Ferrolysis in neutral paddy soil and its influence[J].ActaPedologicaSinica,1986,23(2):184-188(in Chinese with English abstract).
[21] 黎立群,董汉章,王遵亲.南疆种稻改良盐土的问题[J].土壤学报,1980,17(4):365-373.
LI L Q,DONG H ZH,WANG Z Q.The reclamation of salinw soil by rice cultivation in southern Xinjiang[J].ActaPedologicaSinica,1980,17(4):365-373(in Chinese with English abstract).
[22] ASHRAF M, MCNEILLY T.Salinity tolerance in brassica oilseeds[J].CriticalReviewsinPlantSciences,2004,23(2):157-174.
[23] AMELOOT N,GRABER E R, VERHEIJEN F G A,etal.Interactions between biochar stability and soil organisms:review and research needs[J].EuropeanJournalofSoilScience,2013,64(4):379-390.
(责任编辑:史亚歌 Responsible editor:SHI Yage)
Review on Contribution and Mechanism of Biochar Bate Soil Salinization
TANG Junyao, ZHAO Yongjie, QU Dong and SUN Lin
(College of Natural Resources and Environment, Northwest A&F University, Yangling Shaanxi 712100, China)
This study chose three types of saline-alkali paddy soils as tested materials(JL, NX, TJ).With the method of soil slurry anaerobic incubation, the changing trends of carbonate ion content, pH, dehydrogenase activity (DHA) and Fe(Ⅱ) mass fraction were analyzed under the addition of biochar with different amounts, in order to verify the contributions of biochar to mitigate the soil salinization process and explore the mechanisms.The results showed that biochar accelerated the dissolving of carbonate.With the addition of biochar, the carbonate leaching in the three paddy soils increased by 0.405-1.590,0.894-3.592,0.725-2.278 μmol/g compared with CK, respectively.The carbonate leaching was accelerated with the increasing amount of the biochar addition.Biochar enhanced soil DHA significantly.DHA of JL, NX, TJ paddy soils increased by 6.53-15.45,1.76-4.25,8.81-21.13 μg/(mL·g·min) compared with CK, respectively.pH of soils decreased obviously during the incubation, but it showed no significant differences among treatments because of the strong soil buffer ability.Biochar also accelerated the process of microbial iron reduction.Maximum iron reduction potential of the JL, NX,TJ paddy soils increased by 0.017-0.034,0.088-0.436,0.023-0.437 μg/mL compared with CK respectively, and the Fe(Ⅱ) mass fractions were positive correlated with the amount of biochar addition.CCA showed a significant difference between initial pH and the change of bicarbonate, means that the effect of biochar on carbonate dissolution was different due to the variations of soil properties.Each treatment in JL and NX paddy soil showed a significant difference; while in TJ paddy soil, biochar accelerated the iron reduction process, but the effect of the amount of biochar addition is indistinctive.Speculated mechanisms are that biochar accelerated the transformation of carbonate to bicarbonate by promoting the process of dehydrogenation-hydrogen production in soils, and that biochar intensified carbonate fixation by enhancing the process of microbial iron reduction.
Biochar; Paddy soil; Microbial iron reduction; Saline soil improvement; Carbonate
TANG Junyao, female, master student.Research area:soil environmental chemistry.E-mail:tangjunyao92@nwafu.edu.cn
QU Dong, male,professor.Research area:soil environmental chemistry.E-mail:dongqu@nwafu.edu.cn
日期:2016-12-29
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20161229.1008.038.html
2016-03-14
2016-04-20
国家自然科学基金(41171204, 41571239);国家级大学生科创项目(201410712113)。
唐珺瑶,女,硕士研究生,从事土壤环境化学研究。E-mail:tangjunyao92@nwafu.edu.cn
曲 东,男,教授,主要从事土壤环境化学研究。E-mail:dongqu@nwafu.edu.cn
S156.4
A
1004-1389(2017)02-0294-10
Received 2016-03-14 Returned 2016-04-20
Foundation item The National Natural Science Foundation of China(No.41171204,No.41571239); National College Students Technology Innovation Project (No.201410712113).

