FimH黏附素对F18ac+大肠杆菌黏附能力和生物被膜形成能力的影响
段强德,许保疆,王录军,付宏岐,朱国强
(1.渭南职业技术学院,陕西 渭南714026; 2.河南省农业科学院,河南 郑州 450002; 3.扬州大学 兽医学院,江苏 扬州225009)
FimH黏附素对F18ac+大肠杆菌黏附能力和生物被膜形成能力的影响
段强德1,许保疆2,王录军1,付宏岐1,朱国强3
(1.渭南职业技术学院,陕西 渭南714026; 2.河南省农业科学院,河南 郑州 450002; 3.扬州大学 兽医学院,江苏 扬州225009)
为研究Ⅰ型菌毛FimH黏附素在F18ac+大肠杆菌(F18ac+E.coli)致病机制中的作用,采用λ-Red同源重组方法成功构建了F18ac+E.coli的fimH基因缺失株(F18ac△fimH)。并使用体外仔猪上皮细胞感染模型,探讨FimH黏附素缺失后对F18ac+E.coli黏附能力和体外生物被膜形成能力的影响。结果表明,与野生株相比,F18ac△fimH缺失株对易感仔猪上皮细胞系IPEC-1和IPEC-J2的黏附能力和体外生物被膜形成能力均显著下降,且其黏附能力可被8%的D-甘露糖所抑制。但是F18ac△fimH/pfimH回补株的黏附能力以及生物被膜形成能力均基本恢复至野生株水平。可见,FimH黏附素是介导F18ac+E.coli黏附的重要黏附因子。
F18ac+大肠杆菌; Ⅰ型菌毛; FimH黏附素; 黏附; 生物被膜
F18+大肠杆菌(F18+E.coli)根据其表达菌毛类型的不同,可以分为F18ab和F18ac变异种。F18ab+E.coli属于产志贺氏样毒素的E.coli(shiga-like toxicE.coli, SLTEC),主要引起仔猪水肿病(edema disease,ED);F18ac+E.coli属于产肠毒素性E.coli(enterotoxigenicE.coli,ETEC),是引起断奶仔猪腹泻(post-weaning diarrhea,PWD)的主要病原菌之一[1-2]。F18ac+E.coli在多种黏附因子介导下,首先粘附定植到仔猪小肠上皮细胞,然后通过分泌毒素引起机体水、电解质紊乱而最终导致腹泻。目前,已知参与介导F18ac+E.coli对仔猪小肠上皮细胞的黏附因子有F18ac菌毛和鞭毛[3-4]。另外,潜在的黏附因子包括与扩散粘附有关的黏附素(adhesin involved in diffuse adherence,AIDA-I)[5]和Ⅰ型菌毛,但它们在F18ac+E.coli黏附过程中的作用仍然不清楚。
Ⅰ型菌毛在病原性大肠杆菌中广泛表达,并作为主要的黏附因子发挥毒力作用。Ⅰ型菌毛的骨架由约3 000个重复的fimA亚基构成,但是其黏附性能则取决于位于菌毛顶部的具有凝集素特性的fimH亚基。FimH黏附素包括凝集素结构域和菌毛结构域,相互之间由1个短的四肽环连接。FimH黏附素介导多种致病菌与宿主细胞的黏附,包括尿道致病性大肠杆菌(uropathogenicE.coli,UPEC)、黏附侵袭性大肠杆菌(adherent-invasiveE.coli,AIEC)、肠炎沙门氏菌(Salmonellaenteritidis)等[6-8]。FimH黏附素通过与宿主细胞表面的D-甘露糖受体结合介导病原菌的黏附。尽管已知Ⅰ型菌毛在多方面参与了多种病原菌的致病过程,但其是否参与F18ac+E.coli的黏附过程还不清楚。为此,通过比较F18ac+E.coli野生株和F18ac△fimH缺失株对易感仔猪上皮细胞系IPEC-1和IPEC-J2黏附能力的变化,探讨FimH黏附素在F18ac+E.coli黏附过程中的作用,旨在为研究F18ac+E.coli致病机制提供参考。
1 材料和方法
1.1 菌株、质粒和细胞系
F18ac+E.coli标准株(O157:H19:F18ac,4P-,STa+,STb+)和pBR322表达载体均由渭南职业技术学院微生物实验室保存。λ-Red同源重组所需质粒pKD46、pKD3和Pcp20均系美国宾夕法尼亚大学兽医学院微生物实验室馈赠。仔猪小肠上皮细胞系IPEC-1和IPEC-J2由美国堪萨斯州立大学微生物实验室馈赠。
1.2 缺失突变株及互补株的构建
F18ac△fimH缺失株根据Datsenko等[9]的λ-Red同源重组技术进行构建。首先以质粒pKD3为模板,利用引物F18ac△fimH-F/F18ac△fimH-R (表1)扩增,将纯化好的带有fimH基因同源臂的氯霉素抗性基因PCR扩增产物电转化至携带有质粒 pKD46的F18ac+E.coli感受态细胞,在Red同源重组酶的作用下,借助两端与靶基因两翼同源的序列与染色体上对应区域发生同源重组,实现一步法构建F18ac△fimH::Cat。2次重组中利用温度敏感性,编码Flp重组酶的质粒pCP20,消除Cat抗性基因标志。通过PCR鉴定(PBR-fimH-F/PBR-fimH-R,表1)及DNA测序结果确定缺失株是否成功构建。

表1 PCR引物寡核苷酸序列和扩增片段长度
注:下划线为fimH基因序列。
以F18ac+E.coli野生株基因组DNA为模板,PBR-fimH-F和PBR-fimH-F为引物(表1)PCR扩增fimH全长基因,经测序验证正确后克隆至表达载体pBR322中,进一步将重组质粒pBR322-fimH转化到F18ac△fimH缺失株中,获得携带fimH基因的回补株,并命名为F18ac△fimH/pfimH。
1.3 生物学特性的测定
将F18ac+E.coli野生株、F18ac△fimH缺失株以及F18ac△fimH/pfimH回补株分别接种于LB液体培养基中过夜培养,第2天按1︰50比例转接于10 mL新鲜LB培养液中,于37 ℃振荡培养,每隔1 h取样测定1次OD600值,记录并重复上述试验4次,绘制生长曲线。
血凝试验 (hemagglutination,HA)和甘露糖敏感性血凝试验(mannose-sensitive hemagglutinin,MSHA)参照Allan等[10]的方法进行,酵母凝集试验和凝集抑制试验参照Sokurenko等[11]的方法进行。
1.4 黏附试验与黏附抑制试验
黏附试验按照 Duan等[3]的方法进行,将对数期生长的细菌按20︰1的比例加至在48孔板中已经生长好的IPEC-1或IPEC-J2单层细胞,并于CO2细胞培养箱中共孵育1 h,然后将未与细胞黏附的细菌用PBS洗涤去掉。与细胞表面黏附的细菌则用0.5%的Triton X-100裂解,然后按1︰10的比例进行梯度稀释涂布LB平板进行单菌落计数。
黏附抑制试验中,先用8%D-甘露糖重悬F18ac+E.coli野生菌株,再以20︰1的比例加入IPEC-1或IPEC-J2单层细胞共孵育1 h,细胞黏附细菌总数的计数方法同上。试验均重复4次,每次试验每个样品均设置3个平行孔。数据统计采用Student’st-test软件。
1.5 生物被膜定量检测
将在30 ℃用LB培养的过夜菌液按1︰100的比例接种BF诱导培养基,再加入96孔板中,每孔150 μL。将96孔板置于30 ℃恒温摇床(80 r/min)中培养24 h,弃菌液后,用蒸馏水将未附着的细菌充分洗涤干净,以2%的结晶紫于室温染色15 min,用蒸馏水冲洗干净后,每孔加入200 μL 95%乙醇溶解结晶紫,采用酶标仪读取其OD600值。试验重复3次,每个样品设置7个平行孔。数据统计采用Student’st-test软件。
2 结果与分析
2.1 △fimH缺失株的构建
分别以F18ac+E.coli野生株、1次重组株和2次重组株基因组为模板,用鉴定引物PBR-fimH-F和PBR-fimH-R(表1)PCR扩增fimH基因。对照野生株扩增片段的长度为 903 bp,1次重组体和2次重组体长度分别为1 353 bp和425 bp(图1),结果均与预期相同。2次重组株测序结果表明,fimH基因中霉素抗性基因Cat已丢失,在同源区内只留下1个FRT位点。

M: DNA Marker;1.F18ac+E.coli野生株;2.F18ac△fimH::Cat 1次重组体;3.F18ac△fimH 2次重组体;4.F18ac△fimH/pfimH回补株
2.2fimH基因缺失不影响F18ac+E.coli的生物学特性
从图 2可以看出,F18ac+E.coli野生株、F18ac△fimH缺失株和F18ac△fimH/pfimH回补株在各个生长时期的生长曲线基本一致,表明fimH基因缺失不影响F18ac+E.coli的生长。
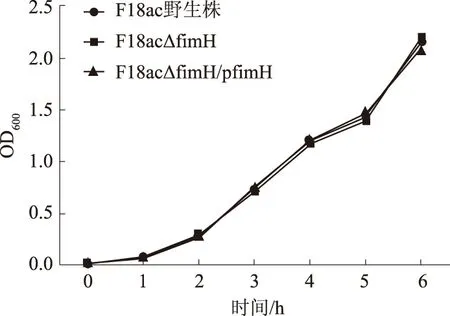
图2 F18ac+E.coli生长曲线
FimH凝集素能够与动物的红细胞和酵母细胞发生明显的凝集反应,并且该凝集现象能够被8%的D-甘露糖抑制。F18ac+E.coli野生株能够与2%猪血红细胞和酵母细胞凝集,呈细小的颗粒状或大块的片状,F18ac△fimH缺失株则对2%猪血红细胞和酵母细胞均无凝集现象,而回补株的凝集能力得到恢复。
2.3 FimH黏附素促进F18ac+E.coli的黏附
F18ac+E.coli对新生仔猪小肠上皮细胞系IPEC-1和IPEC-J2均具有很好的黏附能力。与野生株相比,F18ac△fimH缺失株对上述2个细胞系的黏附能力均显著下降。其中,F18ac△fimH缺失株对IPEC-1细胞的黏附能力仅为野生株黏附能力的57%(图3),对IPEC-J2细胞的黏附能力则仅为野生株黏附能力的36%(图4)。F18ac△fimH/pfimH回补株的黏附能力则恢复至野生株水平。在黏附抑制试验中,8% D-甘露糖能显著抑制F18ac+E.coli对IPEC-1和IPEC-J2细胞的黏附(图3、4)。上述结果表明,FimH黏附素是F18ac+E.coli重要的黏附因子。
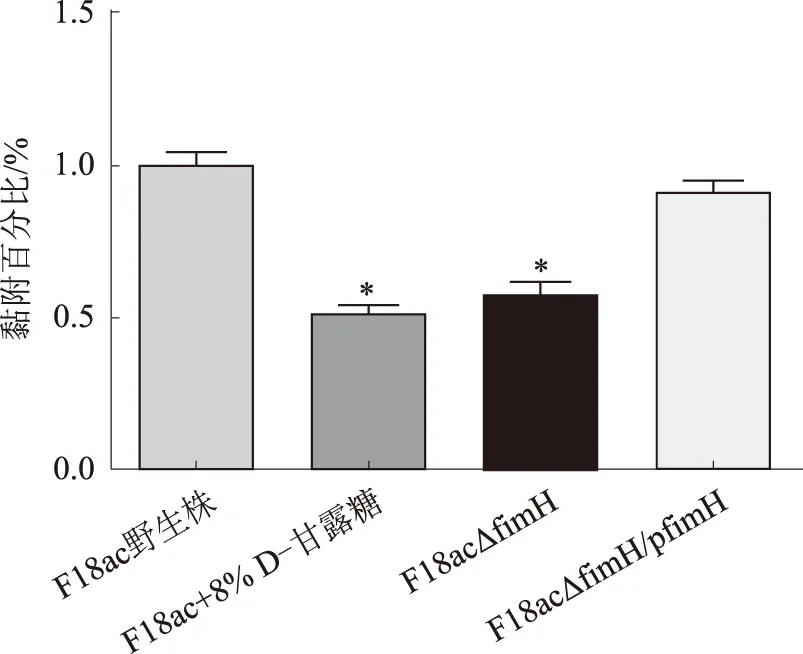
*代表与野生株相比差异显著(P≤0.05),下图同
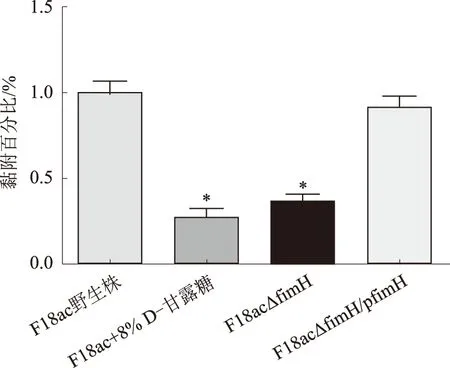
图4 IPEC-J2细胞黏附结果
2.4 FimH黏附素促进F18ac+E.coli体外生物被膜的形成
生物被膜定量检测结果表明,与野生株相比,△fimH缺失株形成生物被膜的能力显著下降,OD600分别为0.360和0.248,同样当生物被膜诱导培养基中加入8%的D-甘露糖后,能显著抑制F18ac+E.coli体外生物被膜的形成。在F18ac△fimH/pfimH回补株中,生物被膜形成能力恢复到了野生株约90%的水平(OD600为0.328)(图 5)。

图5 生物被膜定量检测结果
3 结论与讨论
FimH黏附素通过与宿主上皮细胞表面的甘露糖受体结合而介导细菌的黏附,因此,该黏附过程能被外源性的D-甘露糖所抑制。本研究发现,细胞培养基中添加8%的D-甘露糖时,F18ac+E.coli与IPEC-1和IPEC-J2细胞的黏附均被显著抑制。进一步研究发现,与野生菌株相比,F18ac△fimH基因缺失株对IPEC-1和IPEC-J2细胞的黏附能力均显著下降,而F18ac△fimH/pfimH回补株的黏附能力可恢复至野生株水平。F18ac菌毛和鞭毛是F18ac+E.coli重要的黏附因子[3-4],所以,FimH黏附素缺失后并没有完全废除其黏附能力。上述结果表明,FimH黏附素在F18ac+E.coli黏附过程中发挥了重要的作用,是其重要的黏附因子之一。
越来越多的证据表明,Ⅰ型菌毛在生物被膜形成过程中发挥着重要的作用[8,12]。与F18ac+E.coli野生株相比,F18ac△fimH基因缺失株形成生物被膜的能力明显减弱。此外,当生物被膜诱导培养基中添加8%的D-甘露糖时,野生株形成生物被膜的能力同样能被抑制,这表明,FimH黏附素是F18ac+E.coli体外生物被膜形成的重要影响因素。
综上,Ⅰ型菌毛的FimH黏附素在F18ac+E.coli的黏附和体外生物被膜形成过程中发挥着重要的作用,这有利于进一步加深对F18ac+E.coli引起PWD致病机制的认识,同时也为研制预防F18ac+E.coli感染的多价疫苗提供了新的策略。
[1] Bertschinger H U,Bachmann M,Mettler C,etal.Adhesive fimbriae producedinvivobyEscherichiacoliO139:K12 (B):H1 associated with enterotoxaemia in pigs [J].Vet Microbiol,1990,25(2/3):267-281.
[2] Nagy B,Whipp S C,Imberechts H,etal.Biological relationship between F18ab and F18ac fimbriae of enterotoxigenic and verotoxigenicEscherichiacolifrom weaned pigs with oedema disease or diarrhoea [J].Microb Pathog,1997,22:1-11.
[3] Duan Q D,Zhou M X,Zhu X F,etal.Flagella from F18+Escherichiacoliplay a role in adhesion to pig epithelial cell lines[J].Microb Pathog,2013,55:32-38.
[4] Frydendahl K.Prevalence of serogroups and virulence genes inEscherichiacoliassociated with post-weaning diarrhoea and edema disease in pigs and a comparison of diagnostic approaches [J].Vet Microbiol,2002,85:169-182.
[5] Ravi M,Ngeleka M,Kim S H,etal.Contribution of AIDA-I to the pathogenicity of a porcine diarrheagenicEscherichiacoliand to intestinal colonization through biofilm formation in pigs [J].Vet Microbiol,2007,120(3/4):308-319.
[6] Kaper J B,Nataro J P,Mobley H L.PathogenicEscherichiacoli[J].Nat Rev Microbiol,2004,2:123-140.
[7] Dreux N,Denizot J,Martinez-Medina M,etal.Point mutations in FimH adhesin of Crohn’s disease-associated adherent-invasiveEscherichiacolienhance intestinal inflammatory response[J].PLoS Pathog,2013,9(1):e1003141.
[8] Kuzminska-Bajor M,Grzymajio K,Ugorski M.Type 1 fimbriae are important factors limiting the dissemination and colonization of mice bySalmonellaEnteritidis and contribute to the induction of intestinal inflammation duringSalmonellainvasion[J].Front Microbiol,2015,6:276.
[9] Datsenko K A,Wanner B L.One-step inactivation of chromosomal genes inEscherichiacoliK-12 using PCR products[J].Proc Natl Acad Sci USA,2000,97(12):6640-6645.
[10] Allan B J,van den Hurk J V,Potter A A.Characterization ofEscherichiacoliisolated from cases of avian colibacillosis[J].Can J Vet Res,1993,57(3):146-151.
[11] Sokurenko E V,Courtney H S,Ohman D E,etal.FimH family of type 1 fimbrial adhesins:Functional heterogeneity due to minor sequence variations amongfimHgenes[J].J Bacteriol,1994,176(3):748-755.
[12] Grzymajlo K,Ugorski M,Kolenda R,etal.FimH adhesin from host unrestrictedSalmonellaEnteritidis binds to different glycoprotein ligands expressed by enterocytes from sheep,pig and cattle than FimH adhesins from host restrictedSalmonellaAbortus-ovis,SalmonellaCholeraesuis andSalmonellaDublin[J].Vet Microbiol,2013,166(3/4):550-557.
FimH Adhesins Contribute to F18ac+E.coliAdhesion and Biofilm FormationinVitro
DUAN Qiangde1,XU Baojiang2,WANG Lujun1,FU Hongqi1,ZHU Guoqiang3
(1.Weinan Vocational and Technical College,Weinan 714026,China; 2.Henan Academy of Agricultural Sciences,Zhengzhou 450002,China; 3.College of Veterinary Medicine,Yangzhou University,Yangzhou 225009,China)
In order to investigate the role of fimH adhesins in the pathogenesis of F18ac+E.coli,F18ac△fimH isogenic mutant was generated by λ Red-based homologous recombination system.The adhesion and biofilm(BF) formation ability of F18ac△fimH mutant and wild-type strains were compared using aninvitropiglet epithelial cell infection model.In theinvitrobacterial adherence assay,our results showed that the isogenic F18ac△fimH mutant correlated with the significantly decreased adhesion to both porcine epithelial IPEC-1 and IPEC-J2 cells when compared with the F18ac+E.coliwild-type strains.In addition,the adherence of F18ac+E.colito these cell lines was also blocked by 8% D-mannose in the cell culture medium.In consistent with less adherence ability,the F18ac△fimH mutant also reduced their ability to form biofilm.These results indicated that fimH adhesins of type Ⅰ fimbriae play an important in F18ac+E.coliadhesion.
F18ac+E.coli; type Ⅰ fimbriae; FimH adhesins; adherence; biofilm
2016-10-20
渭南市科技创新项目(2013KYJ-3);陕西省科技新星项目(2015KJXX-97)
段强德(1983-),男,湖南衡阳人,副教授,博士,主要从事动物基因疫苗的开发。E-mail:dqd8358@163.com
S852.61
A
1004-3268(2017)03-0134-04

