产肠毒素大肠杆菌K88ab/K88ad菌毛操纵子fae全基因的克隆、表达及生物学活性的初步研究
郁 磊,吴 娟,朱 军,朱国强*
(1.扬州大学兽医学院,江苏扬州225009;2.南京农业大学动物医学院,江苏南京210095;3.南京天邦生物科技有限公司,江苏南京211102)
产肠毒素大肠杆菌(Enterotoxigenic Escherichia coli,ETEC)是引起仔猪腹泻的主要病原之一,给养猪业造成严重的经济损失。ETEC首先通过特异性粘附素吸附到小肠粘膜上皮细胞表面的受体上,并定植于肠表面[1]。不同ETEC的菌毛粘附素类型不同,主要有K88、K99、987P及F41,其中以K88的流行最为普遍,因而也尤为重要[2-3]。从分子水平研究病原菌粘附素与宿主细胞表面大分子受体相互作用,才能最直接、最有效地阻止病原菌侵入机体细胞[4],这是当前病原菌预防和控制研究的热点领域,而粘附素的体外表达和功能性分析则是开展上述研究的前提和基础。
本实验室已于2008年克隆出K88ac菌毛操纵子中除faeA、faeB调节基因之外的操纵子结构基因,实现K88ac菌毛蛋白在非致病性且不含任何菌毛的E.coli中体外高效表达,并以其表达纯化产物制备了多抗血清[5]。本实验利用类似的方法克隆出K88菌毛的K88ab和K88ad菌毛操纵子fae全基因,使这两个血清型的菌毛蛋白在非致病性且不含任何菌毛的E.coli中体外高效表达,并比较表达3种不同血清型K88菌毛的野生菌以及重组菌与猪肠道上皮细胞系IPEC-J2的黏附性,为从分子水平上研究K88菌毛与宿主细胞表面大分子受体相互作用、进一步比较K88菌毛三种血清型的不同生物学特性、探索K88菌毛的功能以及在ETEC菌致病过程中的作用奠定了基础。
1 材料和方法
1.1 菌株、质粒和细胞系 K88ab、K88ac和K88ad 3种血清型E.coli参考株分别为C83901株、C83902株和C83903株,购自中国兽药监察所菌种保藏中心;表达载体pBR322购自NEB公司;E.coli DH5α和SE5000均由本实验室保存;K88ac重组菌SE5000(pBR322-K88ac)、鼠抗重组K88ac菌毛血清和鼠抗K88ac菌毛单克隆抗体(MAb)由本实验室制备;猪小肠上皮细胞系IPEC-J2由美国Kansas州立大学Dr.Schultz惠赠。
1.2 主要试剂 Expand Long Template PCR System购自Roche公司;限制性内切酶、T4DNA连接酶购自 NEB公司;DNA Marker DL2000、λHin dⅢ购自TaKaRa公司;琼脂糖凝胶DNA回收试剂盒(离心柱型)购自BBI(Bio basic inc)公司;低分子量蛋白Marker和羊抗鼠IgG-HRP购自博士德公司。
1.3 K88fae基因的克隆与重组表达
1.3.1引物的设计与合成根据GenBank中登录的fae操纵子各结构基因序列,用DNAStar软件分析设计扩增K88fae全长的一对引物,并在上下游引物的5'末端分别加上相应的限制性酶切位点,引物由上海基康生物工程公司合成。
1.3.2PCR扩增与检测按全菌裂解法制备ETEC K88ab参考株C83901和K88ad参考株C83903染色体DNA为模板[6],Expand Long Template PCR System扩增目的基因:94℃2min,94℃15s、56℃30s、68℃8m in,共25个循环;68℃8m in。PCR产物与载体pGEM-T连接,并转化E.coli DH5α,对重组质粒pGEM-fae进行测序鉴定。
1.3.3重组表达质粒的构建与鉴定凝胶回收双酶切处理后的pBR322和目的基因K88fae PCR扩增产物,分别构建重组质粒pBR-K88ab和pBR-K88ad。
1.3.4目的蛋白的表达将pBR-K88ab和pBR-K88ad分别转化SE5000菌。重组菌pBR-K88ab/SE5000、pBR-K88ad/SE5000接种于氨苄抗性TSB液体培养基中,同时将ETEC K88ab C83901和K88ad C83903参考株接种TSB液体培养基作为阳性对照,37℃振荡培养24h,用热抽提法结合饱和硫酸铵沉淀[7]分离重组菌和参考株菌体表面表达的菌毛。
1.4 表达产物的鉴定
1.4.1玻板凝集试验取重组菌SE5000(pBRK88ab)、SE5000(pBR-K88ad)和 ETEC K88ab 参考株C83901、K88ad参考株C83903TSB过夜培养物分别与鼠抗重组K88ac菌毛血清抗K88ac菌毛MAb进行玻板凝集试验。
1.4.2电镜观察K88重组菌静止培养24h后经PBS缓冲液洗涤两次,吸取少量菌液浮于铜网,磷钨酸负染5m in,Philips Tecnai12-tw in透射电镜下观察并拍照。同时设K88参考株和含pBR322空载体的SE5000菌为阳性和阴性对照。
1.5 表达产物的反应原性鉴定
1.5.1SDS-PAGE和western blot鉴定取纯化菌毛按文献方法[7]进行western blot试验,10%BSA 4℃封闭过夜。以1∶1000稀释的K88菌毛MAb为一抗,1∶50稀释的羊抗鼠IgG-HRP为二抗,DAB底物显色。同时设K88ab、K88ad参考株的纯化菌毛为阳性对照。
1.5.2小肠上皮细胞黏附和黏附抑制试验在96孔板中培养的IPEC-J2细胞单层中,每孔细胞数约8×104,用PBS洗涤3次后,以感染复数(MOI)1∶100加入细菌,共同孵育2h后,PBS洗涤3次,以0.5%Triton X-100作用20min,分散并收集细菌悬液并进行倍比稀释,涂布于LB平板,37℃过夜培养,CFU记数。含pBR322空载体的大肠杆菌SE5000为阴性对照,实验重复3次。黏附抑制试验将鼠抗重组K88菌毛多克隆抗体血清与待检细菌等量混和,37℃孵育30m in,与单层IPEC-J2细胞进行细胞黏附试验。
2 结 果
2.1 K 88fae基因的PCR扩增 利用设计的引物以ETEC K88ab参考株C83901和K88ad参考株C83903基因组DNA为模板均扩增出特异性目的条带,其片段大小与预期相符,为7.9kb左右(图1)。将该PCR片段克隆至pGEM-T质粒中,测序结果表明,筛选获得阳性重组质粒,其fae基因序列与已发表的fae操纵子各结构基因序列基本一致。
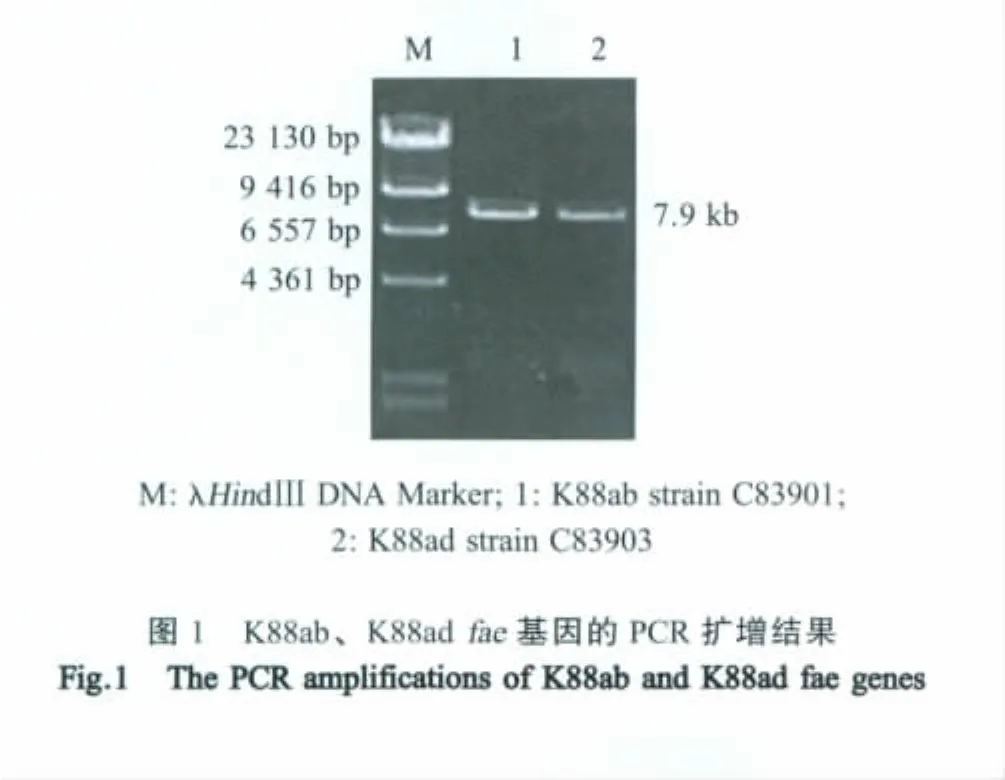
2.2 K88fae基因的表达 分别构建重组质粒pBR-K88ab、pBR-K88ad,并将其分别转化于E.coli SE5000菌中,重组菌接种于含氨苄的TSB中,37℃培养过夜后能与鼠抗重组K88ac菌毛血清、鼠抗K88ac菌毛MAb产生明显的玻板凝集反应。经负染的重组菌在透射电镜下可见细胞表面布满菌毛,对比K88+参考株C83901、C83903可见其菌毛致密,细长,确认重组菌中菌毛表达较好,而阴性对照未见菌毛。
2.3 重组表达菌毛SDS-PAGE和western blot分析 热抽提分离纯化的K88ab、K88ad菌毛经SDS-PAGE电泳结果显示,在26ku处有明显条带,与faeG主要结构蛋白亚单位26ku报道一致[8]。经western blot分析,1∶1000稀释的K88菌毛MAb能够特异性识别K88ab、K88ad重组菌的主要结构蛋白条带(图 2)。

2.4 仔猪小肠上皮细胞黏附试验和黏附抑制试验细胞黏附试验结果显示,表达K88菌毛3种血清型的重组菌和K88+参考株均能很好的黏附于IPEC-J2上皮细胞(图3)。当以1∶100MOI在 IPEC-J2单层细胞加入7×106cfu细菌,共同孵育2h后,同一血清型的重组菌株比参考株每孔黏附细菌数多20%~30%,其中K88ac血清型黏附数最多,K88ab次之,K88ad最少;而阴性对照菌每孔仅检测到2×103cfu,为K88ac重组菌的1/160。而上述K88+参考株和重组菌株与鼠抗重组K88菌毛血清作用30m in后,再与IPEC-J2上皮细胞共同孵育2h,仅能检测到2×103cfu。

3 讨论
K88菌毛有K88ab、K88ac、K88ad 3种血清型,本实验首次扩增编码K88ab和K88ad的菌毛完整操纵子fae基因,将其克隆于pBR322中。将pBRK88ab和pBR-K88ad分别转化入不表达任何菌毛的工程菌SE5000,使其在体外表达具有生物学活性的重组K88菌毛蛋白。
虽然不同血清型的K88菌毛在氨基酸组成上相差甚微,仅在菌毛主要结构蛋白FeaG上有个别氨基酸有差别[9],但只有K88ac是临床上从病猪分离到的优势血清型[10]。Choi和Chae对临床分离到的44株表达K88菌毛的ETEC进行血清分型,42株为K88ac血清型,2株为K88ab血清型[11]。类似的,Alexa等进行的K88血清分型实验结果表明,34株K88阳性ETEC里K88ac占了29株,而K88ab和K88ad仅分别占了2株和3株[12]。本实验以IPEC-J2为细胞模型,比较了K88菌毛3种血清型的黏附性能,可部分解释为什么K88ac为临床优势血清型。黏附试验结果表明,表达K88ac血清型菌毛的野生菌和重组菌与IPEC-J2黏附的数目最多,表达K88ab血清型菌毛的细菌黏附数次之,而表达K88ad血清型菌毛的细菌与IPEC-J2黏附的最少(ac∶ab∶ad≈6∶3.5∶1)。结果显示对小肠上皮细胞的黏附能力越强,该血清型越容易成为优势血清型。
但是,优势血清型的形成不仅仅取决于细菌的黏附素,动物宿主的不同受体分布也对其有很大影响。按表达K88受体的种类为依据,现有研究已将猪分为6种表型[13-14]:表型A,表达3种血清型菌毛的细菌都黏附;表型B,黏附K88ab和K88ac;表型 C,黏附 K88ab和 K88ad;表型 D,只黏附K88ad;表型E,3种血清型都不黏附;表型F,只黏附K88ab。因此,当地猪群为哪一种表型会很大程度地影响K88菌毛3种血清型哪种成为优势血清型。比如,如果当地猪群均为D表型,那么K88ad必定成为该地的优势血清型。然而目前为止,尚无关于K88受体表型分布研究的报道。
病原菌ETEC K88通过其粘附素和宿主细胞表面相应的大分子受体特异性结合感染易感仔猪,基于K88ab、K88ad粘附素fae基因的克隆、体外表达和IPEC-J2细胞体外感染模型,有望对病原菌ETEC K88黏附、侵入、增殖和宿主细胞应答等多方面开展深入研究。
[1]Nataro JP,Kaper JB.Diarrheagenic Escherichia coli[J].Clin-M icrobio Rev,1998,11(1):142-201.
[2]Choi C S,Chae C H.Genotypic prevalence of F4variants(ab,ac and ad)in Escherichia coli isolated from diarrheic piglets in Korea[J].Veterinary,1999,67(4):307-310.
[3]Hide E J,Connaughton ID,Driesen S J,et al.The prevalence of F107fimbriae and their association with shiga-like toxin pili Escherichia coli strains from weaned Australian pigs[J].Vet M icrobiol,1995,47(3/4):235-243.
[4]Fairbrother JM,Nadeau E,Gyles C L.Escherichia coli in postweaning diarrhea in pigs:an update on bacterial types,pathogenesis,and prevention strategies[J].Animal Health Res Rev,2005,6:17-39.
[5]朱春红,朱国强.大肠杆菌K88ac菌毛操纵子fae全基因的克隆、表达及生物学活性初步研究[J].生物技术通讯,2008,(2):236-239.
[6]Imberechts H,W ild P,Charlier G,et al.Characterization of F18fimbial genes fedE and fedF involved in adhesion and length of enterotoxem ic Escherichia coli strain 107/86[J].M icrob Pathog,1996,21(3):183-192.
[7]Smeds A,Hemmann K,Jakava-Viljanen M,et al.Characterization of the adhesion of Escherichia coli F18fimbriae[J].Infect Immun,2001,69(12):7941-7945.
[8]Mol O,Visschers R W,de Graaf F K,et al.Escherichia coli perplasmic chaperone FaeE is a homodimer and the chaper-one-K88subunit omplex is a heterotrimer[J].Mol M icrobiol,1994,11:391-402.
[9]Van den Broeck W,Cox E,Oudega B,et al.The F4fimbrial antigen of Escherichia coli and its receptors[J].Vet M icrobiol,2000,71(3-4):223-44.
[10]Westerman B,M ills W,Phillips M,et al.Predom inance of the ac variant in K88-positive Escherichia coli isolates from sw ine[J].Clin M icrobiol,1988,26:149-150.
[11]Choi C H,Chae C H.Genotypic Prevalence of F4variants(ab,ac and ad)in Escherichia coli isolated from diarrheic piglets in Korea[J].Vet M icrobiol,1999,67:307-310.
[12]Alexa P,Stouracova K,Ham rik J,Rychlik I.Gene typing of the colonisation factors K88(F4)in enterotoxigenic Escherichia coli strains isolated from diarrhoeic piglets[J].Vet Med Czech,2001,46(2):46-49.
[13]Bijlsma G,de Nijs C,et al.Different pig phenotypes affect adherence of Escherichia coli to jejunal brush borders by K88ab,K88ac,or K88ad antigen[J].Infect Immun,1982,37:891-894.
[14]Baker R,Billey O,Francis F.Distribution of K88Escherichia coli-adhesive and nonadhesive phenotypes among pigs of four breeds[J].Vet M icrobiol,1997,54:123-132.

