化学发光法检测抗髓过氧化物酶抗体和抗蛋白酶3抗体
马晋,张蜀澜,胡朝军,柳乐,李庆春,李梦涛,曾小峰
(中国医学科学院 北京协和医学院 北京协和医院风湿免疫科 风湿免疫病学教育部重点实验室, 北京 100730)
ChinJAllergyClinImmunol,2017,11(2):112- 118
抗中性粒细胞胞浆抗体(anti-neutrophil cytoplas-mic autoantibodies, ANCA)是最早由Davies及其同事在研究节段性坏死性肾小球肾炎患者抗核抗体时所发现的一种自身抗体[1]。现有研究结果表明ANCA是包括坏死性肉芽肿性血管炎、显微镜下多脉管炎和Churg-Strauss综合征等疾病在内的系统性小血管炎(systemic small vasculitis, SSV)临床诊断的重要血清学指标[2- 4]。大约85%~90%的坏死性肉芽肿性血管炎、显微镜下多脉管炎和Churg-Strauss综合征等疾病患者的体内都能够检测到ANCA。其中,抗蛋白酶3(proteinase 3, PR3)抗体和抗髓过氧化物酶(myeloperoxidase, MPO)抗体对SSV具有良好的诊断特异性,而且抗体的滴度与疾病的活动度具有相关性[5]。因此,在临床实践中作为重要的ANCA靶抗原确认实验而广泛开展。
目前临床实验室检测抗MPO抗体和抗PR3抗体多采用基于20世纪70年代的传统酶联免疫吸附检测(enzyme-linked immunosorbent assay,ELISA)技术[6- 8]。近年来,新的免疫学技术已经逐步应用到临床自身抗体检测实践中[9- 11]。具有全自动、定量、随机上样以及检测线性范围更宽等优势的全自动化学发光(chemiluminescent immunoassay, CLIA)检测技术广泛应用于临床样本检测。本研究采用CLIA方法对临床常规样本开展抗MPO和抗PR3抗体检测,探讨其在抗MPO抗体和抗PR3抗体检测中的临床应用价值。
对象与方法
对象
收集北京协和医院门诊和住院申请ANCA检测项目的常规临床样本242例,其中住院患者29例,门诊患者213例;男性97例,年龄7~87岁,平均(52.0±18.5)岁,女性145例,年龄10~87岁,平均(48.1±17.1)岁。所有入组样本中,119例具有明确疾病诊断信息(表1),其中包括47例SSV患者和72例非SSV患者(含29例风湿炎症疾病和43例非自身免疫疾病)。待检测患者清晨空腹静脉采血,离心分离血清后,应用免疫荧光法(immunofluorescent assay,
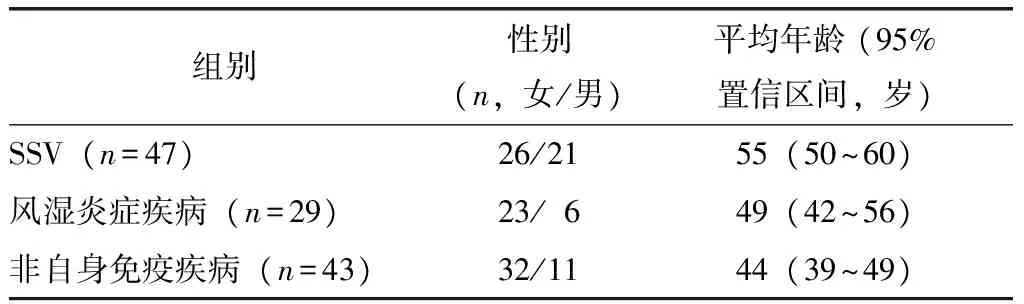
表1 具有明确疾病诊断信息的入组样本临床特点Table 1 Demographic and clinical characteristics of subjects with disease diagnosis
SSV:系统性小血管炎; 风湿炎症疾病组包括6例系统性红斑狼疮、9例结缔组织病、12例类风湿关节炎及2例系统性硬化症
IFA)开展ANCA筛查检测的同时,平行采用CLIA和ELISA开展抗MPO抗体和抗PR3抗体检测。
试剂和仪器
CLIA自身抗体检测系统,包括全自动化学发光分析仪(LumiRay 1260)及抗MPO抗体和抗PR3抗体检测试剂(苏州浩欧博生物医药有限公司)。IFA检测试剂盒:同时包被HEp- 2细胞、灵长类肝组织片、甲醛固定中性粒细胞和乙醇固定中性粒细胞等基质的粒细胞马赛克检测试剂盒(德国欧蒙医学诊断股份公司)。对比ELISA试剂盒:抗MPO抗体和抗PR3抗体ELISA检测试剂盒(德国欧蒙医学诊断股份公司)。第三方ELISA验证试剂盒:由于抗MPO抗体和抗PR3抗体缺乏公认的标准参考方法,本研究针对CLIA与ELISA检测结果不一致样本选择第三方验证ELISA检测试剂盒(德国AESKU Diagnostic公司)开展复测。SUNRISE酶标仪(瑞士TECAN公司);荧光显微镜(日本Olympus)。
方法
CLIA检测抗MPO抗体和抗PR3抗体:检测流程严格按照说明书开展检测,所有检测均在配套的全自动化学发光分析仪(LumiRay 1260)上全自动开展检测。抗PR3抗体和抗MPO抗体的检测临界值均为20 RU/ml。
IFA开展ANCA筛查检测:采用包括乙醇固定粒细胞、甲醛固定粒细胞、灵长类肝组织片和HEp- 2细胞抗原片等四个基质组合检测。血清1∶10稀释后与抗原基质片反应30 min(同时设立阳性和阴性对照),在PBS缓冲液中浸泡5 min,加入荧光素标记的抗人IgG抗体避光温育30 min,再次在PBS缓冲液中浸泡5 min,加甘油基质封片并在荧光显微镜下观察和判读结果。以抗体滴度≥1∶10为阳性。
ELISA检测抗MPO和PR3抗体:血清样本1∶100稀释,加入包被MPO和PR3抗原的微孔板中,室温反应30 min,用清洗缓冲液清洗3次,每孔加入100 μl酶标记的抗人IgG抗体,室温反应30 min,用清洗缓冲液清洗3次,每孔加入100 μl TMB底物液,室温反应15 min,最后加入100 μl终止液,在酶标仪中按照450 nm和620 nm的双波长进行光密度测量。根据光密度值计算抗体浓度并判读阴阳性结果。其中对比ELISA试剂盒和第三方验证ELISA试剂盒的检测临界值分别为20 RU/ml和18 U/ml。
统计学处理
采用SPSS 21.0软件进行统计学分析。不同方法检测结果差异的比较,采用四格表的χ2检验,两种方法检测结果一致性的分析采用Kappa检验,一致性强度的判断:当Kappa<0.4,一致性强度较差;0.4≤Kappa<0.75,两者一致性一般;Kappa≥0.75两者一致性较好。同时以ELISA作为对比方法绘制受试者工作特征曲线(receiver operating characteristic curve,ROC曲线),借助曲线以下面积(area under the curve, AUC)分析CLIA与ELISA比较的准确性,判断标准:当0.5
结 果
CLIA与ELISA检测抗MPO抗体的符合率
应用CLIA和ELISA同时对入组样本开展抗MPO抗体平行检测,分别对两种方法学检测结果进行符合率分析。结果显示,CLIA和ELISA在检测抗MPO抗体时表现出良好的一致性,其中阳性符合率、阴性符合率及总符合率分别为81.9%、98.8%和93.8%(表2)。以ELISA作为对比方法绘制ROC曲线,结果显示与ELISA比较,CLIA检测抗MPO抗体时具有良好的准确性,AUC为0.966 (95%置信区间为0.946~0.986)(图1)。两种方法检测结果差异样本仅为15例,针对差异样本采用第三方试剂开展复测的结果见表3。

表2 CLIA与ELISA检测抗MPO抗体符合率分析Table 2 Qualitative agreement between CLIA and ELISA for the detection of anti-MPO
MPO:髓过氧化物酶;CLIA:化学发光法;ELISA:酶联免疫吸附法
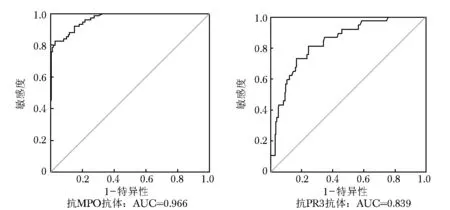
图1两种方法检测抗MPO和PR3抗体ROC曲线图
Fig1Receiver operating characteristic (ROC) curves of anti-MPO and anti-PR3 for the comparison between CLIA and ELISA
MPO:髓过氧化物酶;PR3:蛋白酶3;ROC:受试者工作特征;AUC:曲线下面积
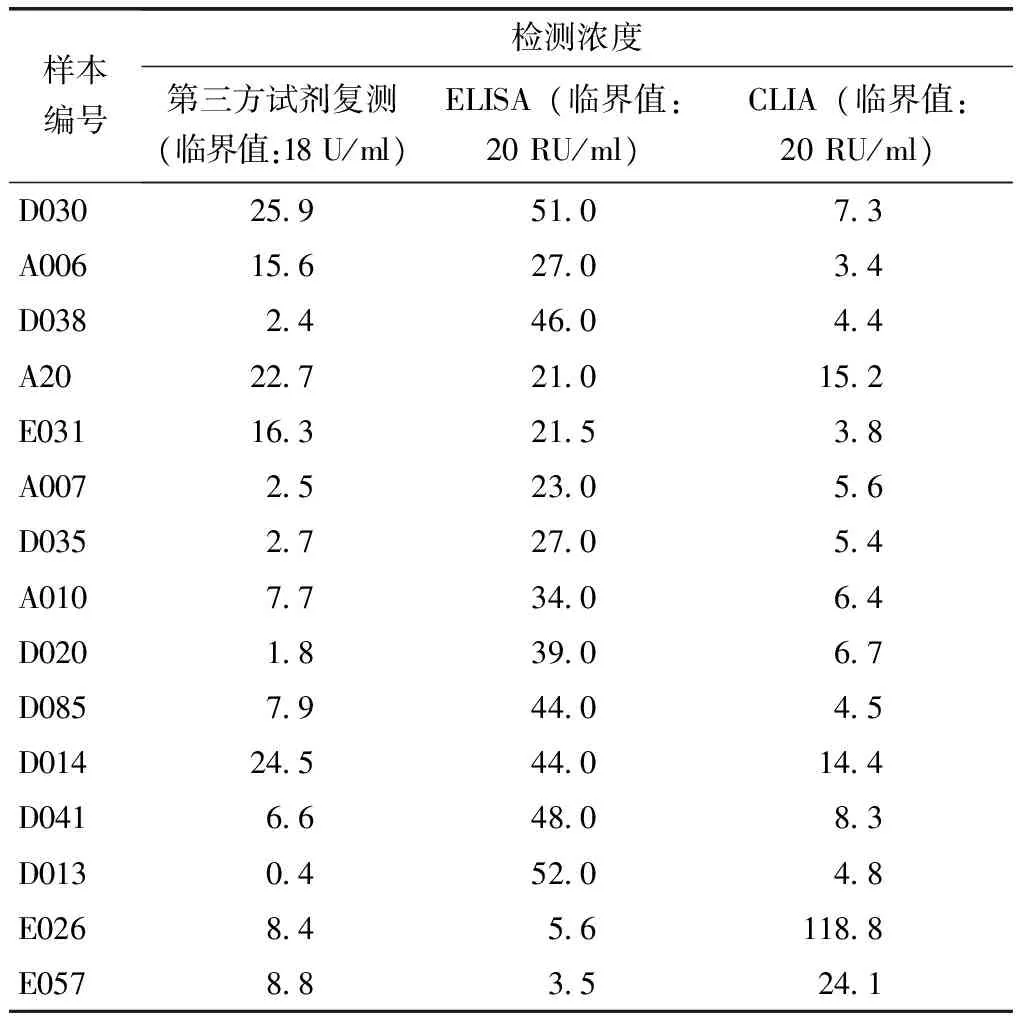
表3 CLIA与ELISA检测抗MPO抗体差异样本的第三方试剂复测结果Table 3 Retest of discrepant samples between CLIA and ELISA with the validation reagent for anti-MPO
MPO:髓过氧化物酶;CLIA:化学发光法;ELISA:酶联免疫吸附法
CLIA与ELISA检测抗PR3抗体的符合率
应用CLIA和ELISA同时对入组样本开展抗PR3抗体平行检测,对两种方法学检测结果进行符合率分析。结果显示,CLIA与ELISA在检测抗PR3抗体时符合率和一致性较低,其中阳性符合率、阴性符合率和总符合率分别为35.1%、96.1%和86.8%(表4)。两种方法检测结果差异样本合计为32例,针对差异样本采用第三方试剂开展复测,结果显示,CLIA结果与第三方试剂复测结果差异无统计学意义(P>0.05),而ELISA结果与第三方试剂复测结果差异存在统计学意义(P<0.01)(表5)。以ELISA作为对照方法绘制ROC曲线,结果显示与ELISA比较时,CLIA在检测抗PR3抗体时具有一定的准确性, AUC为0.839 (95%置信区间为0.773~0.905)(图1)。
CLIA和ELISA分别与IFA筛查ANCA检测结果的符合率
临床实践中,首先以包括乙醇和甲醛固定的中性粒细胞为基质的IFA开展ANCA初筛试验,然后进一步采用免疫印迹法或ELISA方法开展抗PR3抗体和抗MPO抗体的确认试验。本研究中242例样本以抗

表4 CLIA与ELISA检测抗PR3抗体符合率分析Table 4 Qualitative agreement between CLIA and ELISA for the detection of anti-PR3
PR3:蛋白酶3;CLIA:化学发光法;ELISA:酶联免疫吸附法
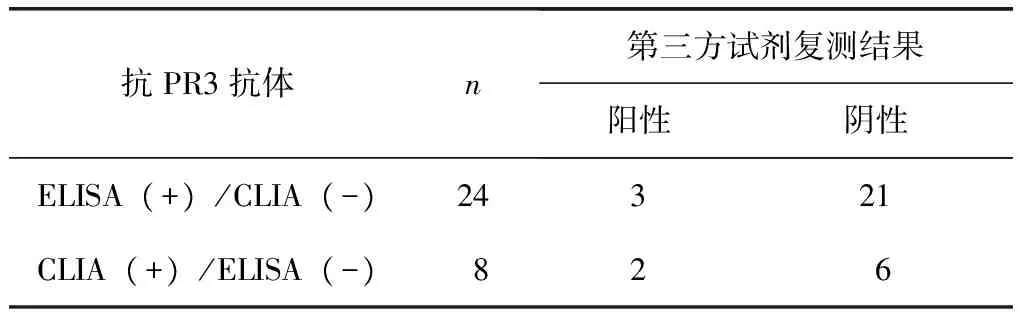
表5 CLIA与ELISA检测抗PR3抗体差异样本的第三方试剂复测结果分析Table 5 Analysis of discrepant samples between CLIA and ELISA retested with the validation reagent for anti-PR3 (n)
PR3:蛋白酶3;CLIA:化学发光法;ELISA:酶联免疫吸附法。CLIA与第三方验证结果差异无统计学意义(P>0.05),ELISA与第三方验证结果差异存在统计学意义(P<0.05)
MPO和(或)抗PR3抗体阳性作阳性样本,分别开展两种方法与IFA检测结果的符合率比较。结果显示,CLIA与IFA的阴性符合率(94.8%)明显优于ELISA与IFA的阴性符合率(77.2%)(表6)。
CLIA和ELISA抗MPO抗体和抗PR3抗体检测性能对比分析
本研究中,共有119例入组样本具有明确的疾病诊断,其中包括47例SSV以及72例非SSV。应用上述两组样本的检测结果,分别比较CLIA和ELISA抗PR3抗体和抗MPO抗体的检测性能。结果显示在抗PR3抗体检测时,CLIA敏感度(21.3%)略低于ELISA(29.8%),但CLIA特异度(92.3%)优于ELISA(87.5%)。而在检测抗MPO抗体时,两种方法学的敏感度基本相当,但CLIA特异度(68.1%)高于ELISA(58.3%)(表7)。

表6 CLIA及ELISA确认试验与IFA筛查检测结果符合率比较Table 6 The qualitative agreement between IFA screening test and confirmatory test with CLIA and ELISA
MPO:髓过氧化物酶;PR3:蛋白酶3;CLIA:化学发光法;ELISA:酶联免疫吸附法;IFA:免疫荧光法

表7 CLIA和ELISA抗MPO和PR3抗体检测性能对比分析Table 7 The comparison of clinical performance between CLIA and ELISA for the detection of anti-MPO and anti-PR3
SSV:系统性小血管炎;MPO:髓过氧化物酶;PR3:蛋白酶3;CLIA:化学发光法;ELISA:酶联免疫吸附法
讨 论
ANCA是SSV临床诊断的重要血清学指标。大约85%~90%的坏死性肉芽肿性血管炎、显微镜下多脉管炎和Churg-Strauss综合征等疾病患者的体内都能够检测到ANCA。应用IFA方法检测ANCA时,在乙醇固定的中性粒细胞基质中可以观察到cANCA和pANCA等荧光表现。前者表现为细胞胞质颗粒阳性且在核小叶部位明显增强,而后者则表现为细胞核周边连续线性的荧光。ANCA常规检测中除了开展IFA筛查实验之外,由于抗PR3抗体和抗MPO抗体对系统性血管炎具有良好的诊断特异性,而且抗体的滴度与疾病的活动度具有明确相关性[12]。因此,在临床实践中作为重要的ANCA靶抗原确认实验而广泛开展定量检测。
自1990年,Falk和Jennette等发现PR3和MPO等靶抗原后,ELISA方法一直以来都被作为抗MPO抗体和抗PR3抗体检测的主要方法。ELISA作为20世纪70年代的传统免疫学检测技术,存在明显的方法学局限性,包括特异性较低、检测线性范围有限和仅能实现半定量检测等。近年来,新的免疫学技术已经逐步应用到临床自身抗体检测实践中。CLIA检测技术作为目前临床免疫检测的主流技术,由于具有全自动、全定量、随机上样、灵活组合和质控更严等显著优势和特点,已经在包括肿瘤标记物、传染病、性激素和甲状腺功能等免疫学检测领域发挥重要的临床价值。
本研究采用CLIA检测技术对临床申请ANCA检测的常规样本开展抗MPO抗体和抗PR3抗体检测,同时将检测结果与IFA及ELISA检测结果进行对比分析。在所有入组242例样本中,无论是CLIA还是ELISA与IFA方法学相比较,阳性符合率均低于75%(CLIA为60.7%,ELISA为73.6%)。IFA作为筛查实验由于所包含的抗原谱更广泛,因此与CLIA和ELISA等靶抗原确认实验相比较具有更好的检测敏感性。在临床实践中,针对ANCA相关抗体检测时,IFA方法应始终作为首选筛查实验开展。但基于IFA而检测出的cANCA和pANCA,在临床应用方面由于均不具备明确的疾病特异性,因此需要应用CLIA或ELISA等方法进行抗MPO抗体和抗PR3抗体的定量或半定量的确认,从而提高ANCA在临床中的疾病特异性。与此同时,采用CLIA及ELISA等定量及半定量的检测方法,还可以获得抗体浓度的数值,为临床针对系统性血管炎患者的疾病诊断、病情监测、预后及复发判断提供更加重要的实验室依据。
应用CLIA与ELISA对抗MPO抗体和抗PR3抗体检测时,两种方法在抗MPO抗体的检测结果上均保持良好的一致性(阳性符合率81.9%,阴性符合率98.8%,总符合率93.8%)和相同的检测敏感度(62.2%)。但在抗PR3抗体的检测结果显示两种方法学的阳性符合率偏低(仅为35.1%),而且CLIA的检测敏感度(21.3%)略低于ELISA(29.8%)。上述差异可能是由于下列几个原因导致:(1)不同反应体系和不同反应原理所引起的结果差异。与ELISA相比较,CLIA以纳米级的磁微粒作为抗原和抗体反应的液相载体,因此具备更良好的反应效率、更完整的抗原抗体结合及更彻底的清洗步骤,从而确保整体反应体系的特异性。由于抗PR3抗体和抗MPO抗体的检测为ANCA中最常见的靶抗原确认实验,因此在方法学选择上应该更加注重特异性的考量。(2)不同方法学中所使用的检测抗原不同而导致结果差异。本研究中ELISA检测法为了提高检测的敏感度采用的是重组PR3及天然PR3抗原混合包被的方式。而CLIA所采用的抗原为天然的PR3抗原[13]。抗原之间的差异可能是导致检测结果之间差异的原因之一。从本研究的结果来看,尽管ELISA在检测抗PR3抗体的敏感度略优于CLIA,但特异性却显著下降。(3)在CLIA反应体系中,借助生物素和亲和素作为载体实现PR3抗原在纳米磁性微球的间接包被,因此能够更好地确保抗原结构不会由于ELISA在微孔板中的直接包被而导致的抗原构想改变。上述两种方法学在检测抗PR3抗体时的检测差异样本应用第三方验证试剂进行验证,结果表明第三方验证试剂的检测结果与CLIA检测更加符合。
综上所述,由于抗MPO抗体和抗PR3抗体缺乏公认的标准参考方法,因此不同检测方法之间的结果可能存在差异。考虑到抗MPO抗体和抗PR3抗体对于SSV患者疾病诊断、病情进展及预后判断等具有至关重要的作用和价值,因此建议在实验室针对上述两种抗体的检测方法学选择之前,应同时结合IFA抗体筛查实验结果、样本的临床诊断信息以及方法学的具体特点(包括自动化、线性范围、随机上样等)因素进行严格的判断和评价。
[1]Davies DJ,Moran JE,Niall JF,et al. Segmental necrotising glomerulonephritis with antineutrophil anti-body: possible arbovirus aetiology?[J]. Br Med J (Clin Res Ed), 1982, 285: 606.
[2]Jenne DE,Tschopp J,Ludemann J,et al. Wegener’s autoantigen decoded[J]. Nature, 1990, 346: 520.
[3]Jennette JC,Hoidal JR,Falk RJ. Specificity of anti-neutrophil cytoplasmic autoantibodies for proteinase 3[J]. Blood, 1990, 75: 2263- 2264.
[4]Hagen EC,Daha MR,Hermans J,et al. Diagnostic value of standardized assays for anti-neutrophil cytoplasmic antibodies in idiopathic systemic vasculitis. EC/BCR Project for ANCA Assay Standardization[J]. Kidney Int, 1998, 53: 743- 753.
[5]McLaren JS,Stimson RH,McRorie ER,et al. The diagnostic value of anti-neutrophil cytoplasmic antibody testing in a routine clinical setting[J]. QJM, 2001, 94: 615- 621.
[6]Vassilopoulos D,Niles JL,Villa-Forte A,et al. Prevalence of antineutrophil cytoplasmic antibodies in patients with various pulmonary diseases or multiorgan dysfunction[J]. Arthritis Rheum, 2003, 49: 151- 155.
[7]Savige J,Dimech W,Fritzler M,et al. Addendum to the International Consensus Statement on testing and reporting of antineutrophil cytoplasmic antibodies. Quality control guidelines, comments, and recommendations for testing in other autoimmune diseases[J]. Am J Clin Pathol, 2003, 120: 312- 318.
[8]Savige J,Gillis D,Benson E,et al. International Consensus Statement on Testing and Reporting of Antineutrophil Cytoplasmic Antibodies (ANCA)[J]. Am J Clin Pathol, 1999, 111: 507- 513.
[9]Zafrir Y,Gilburd B,Carrasco MG,et al. Evaluation of an automated chemiluminescent immunoassay kit for antinuclear antibodies in autoimmune diseases[J]. Immunol Res, 2013, 56: 451- 456.
[10] Bentow C,Lakos G,Rosenblum R,et al. Clinical performance evaluation of a novel, automated chemiluminescent immunoassay, QUANTA Flash CTD Screen Plus[J]. Immunol Res, 2015, 61: 110- 116.
[11] Webb T,Lakos G,Swart A,et al. Clinical evaluation of a novel chemiluminescent immunoassay for the detection of anti-citrullinated peptide antibodies[J]. Clin Chim Acta, 2014, 437: 161- 167.
[12] Bosch X,Guilabert A,Font J. Antineutrophil cytoplasmic antibodies[J]. Lancet, 2006, 368: 404- 418.
[13] Damoiseaux J,Dahnrich C,Rosemann A,et al. A novel enzyme-linked immunosorbent assay using a mixture of human native and recombinant proteinase- 3 significantly improves the diagnostic potential for antineutrophil cytoplasmic antibody-associated vasculitis[J]. Ann Rheum Dis, 2009, 68: 228- 233.

