国内猪源卡他莫拉菌的首次分离与鉴定
余桃樱,石於友,李国华,沙丽东,刘 宁,李美荃,宋 聪,杨荣丽,李华春,姚 俊
(1. 云南省贡山县农业和科学技术局,贡山 673500;2. 云南省巍山县动物疫病预防与控制中心,巍山672400;3.云南省墨江县动物疫病预防与控制中心,墨江654800;4. 云南省富民县动物疫病预防与控制中心,富民650400;5.云南农业大学动物科学技术学院,昆明 650201;6.云南省畜牧兽医科学院 云南省热带亚热带动物病毒病重点实验室,昆明 650224)
·研究论文·
国内猪源卡他莫拉菌的首次分离与鉴定
余桃樱1,石於友2,李国华3,沙丽东4,刘 宁5,李美荃5,宋 聪5,杨荣丽6,李华春6,姚 俊6
(1. 云南省贡山县农业和科学技术局,贡山 673500;2. 云南省巍山县动物疫病预防与控制中心,巍山672400;3.云南省墨江县动物疫病预防与控制中心,墨江654800;4. 云南省富民县动物疫病预防与控制中心,富民650400;5.云南农业大学动物科学技术学院,昆明 650201;6.云南省畜牧兽医科学院 云南省热带亚热带动物病毒病重点实验室,昆明 650224)
2015年1月昆明市郊区某规模化种猪场饲养的后备种猪发生一种以高热,呼吸急促、窘迫,皮肤发绀及猝死为特征的疫情。分离细菌培养后获得1株形态呈双肾形的革兰氏阴性双球菌。经昆明小白鼠致病性实验、本动物回归实验、细菌生化鉴定及16S rRNA和UspA1基因序列分析显示,该分离菌株为毒力极强的卡他莫拉菌。与卡他莫拉菌参考菌株BBH18株(GenBank登录号:NC_014147.1)的16S rRNA和UspA1基因序列同源性达100%。药敏实验结果显示,该菌株对头孢噻肟高度敏感,对妥布霉素、庆大霉素、头孢曲松、头孢呋辛、头孢他啶、呋喃妥因及四环素中度敏感。猪场选用敏感药物进行紧急预防和治疗,及时有效地控制了本病的扩散及蔓延。
卡他莫拉菌;分离;鉴定;猪
卡他莫拉菌最初被命名为卡他微球菌(Micrococcus catarrhalis),20世纪60年代被命名为卡他奈瑟菌(Neisseria catarrhalis),70年代根据DNA同源性被分为独立的一属,即布兰汉菌属(Branhamella)。1979年后国际微生物学届部分学者建议将本菌划归于莫拉菌属,称为卡他莫拉菌(Moraxella catarrhalis,MC)。目前莫拉菌属包含22个种。卡他莫拉菌为革兰氏阴性双球菌,多呈双肾形,无鞭毛,无芽孢,属专性需氧菌,对营养要求不高,在普通琼脂上即可生长。菌落不透明、凸起、光滑或呈亚光,颜色乳白、粉红或褐色,有些菌株的菌落较坚硬,但易碎。卡他莫拉菌是人类上呼吸道的常居菌种,为条件致病菌[1],可引起人类的多种感染,甚至会累及全身,如急性中耳炎、上颌窦炎和下呼吸道感染,也可引起脑膜炎、心内膜炎、尿道炎,婴儿和儿童眼结膜炎、角膜炎和败血症等。国外资料显示,卡他莫拉菌在成人下呼吸道感染及儿童肺炎、中耳炎等标本中的分离率,仅次于流感嗜血杆菌和肺炎链球菌,列第3位。卡他莫拉菌产生β-内酰胺酶的菌株渐多,为临床治疗带来一定困难。卡他莫拉菌在人医学上的感染报道较多,但截至目前该菌在动物上引起感染发病死亡的病例暂未见到相关报道[2-14]。
2015年1月,昆明市郊区某规模化种猪场饲养的后备种猪突然发病,精神沉郁,躺睡不愿站立,强迫驱使行走时可见后驱摇摆,站立不稳,体温升高至41℃~41.5℃,食欲下降并伴随呕吐,发病后1~2 d内死亡,濒死前全身颤抖,口鼻有泡沫流出,死亡后肢体末梢及腹部皮肤发绀。对病死猪尸体进行解剖可见肺脏肿大、出血,膀胱粘膜面弥漫性出血,肾脏肿大,布满弥漫性出血点,胃肠道浆膜面可见充血,粘膜面弥漫性出血,肠系膜淋巴结肿大、出血(图1)。无菌采集腹股沟淋巴结、颌下淋巴结、肠系膜淋巴结、肺门淋巴结、脾脏、肾脏、肝脏组织,划线于血琼脂、营养琼脂、巧克力琼脂及麦康凯琼脂平板后,置于37℃普通培养箱及厌氧罐培养24~48 h。在厌氧环境培养的平板无任何菌落生长,而在普通培养箱培养的血琼脂、营养琼脂、巧克力琼脂上均生长出圆形、光滑、边缘整齐、湿润、透明或乳白色菌落。经染色镜检、生化鉴定、动物致病性实验、本动物回归实验以细菌16S rRNA基因序列分析,确诊该分离菌株为卡他莫拉菌,是引起本次猪群发病急性死亡的病原。选用敏感药物对猪群进行预防及治疗,效果显著,及时有效地控制了本病的扩散及蔓延。

图1 病死猪内脏器官病理变化Fig. 1 Pathological changes of visceral organs of dead pigsA∶ 膀胱粘膜弥漫性出血; B∶ 肺脏肿大、出血; C∶ 肠系膜淋巴结肿大、出血; D∶ 肾脏肿大、布满弥漫性出血点A∶ Diffuse hemorrhage of the bladder mucosa; B∶ The lung was swelling and bleeding; C∶ The mesenteric lymph node were swelling and bleeding; D∶ The kidney was swelling and full of diffuse point
1 材料与方法
1.1 材料
1.1.1 样品 昆明市郊区某规模化养猪场送检的流产胎儿大脑。
1.1.2 主要试剂、菌种、培养基及仪器 营养琼脂培养基、麦康凯培养基、显色指示剂、DNA琼脂、四甲基对苯二胺(Tetra-methy-p-phenylene diamine dihydrochlo-ride)、吲哚乙酰酯购自杭州滨和微生物试剂有限公司;Gibic新生犊牛血清购自美国生命技术有限公司(Life Technologies);革兰氏染液、非发酵细菌生化编码鉴定管、常用新药敏纸片及细菌培养基购自杭州天和微生物试剂有限公司;卡他莫拉菌ATCC 25238标准菌株由云南省热带亚热带动物病毒病重点实验室保存;病毒DNA提取试剂盒(Viral DNA Kit)、病毒RNA提取试剂盒(Viral RNA Kit)购自美国OMEGA生物技术有限公司;细菌基因组DNA抽提试剂盒、荧光定量qPCR及qRTPCR试剂盒、2×PlusTaq酶、DNA Marker2000购自天根生物技术(北京)有限公司;AgPath-IDTMonestep RT-PCR Kit(AM1005)购自美国 ABI(Applied Biosystems Inc.)公司;一步法RT-PCR试剂盒(One Step RT-PCR Kit)购自大连宝生物(TaKaRa)生物技术有限公司;普通光学显微镜为OLYMPUS CX31显微镜;CO2培养箱为THERMO SCIENTIFIC;生物安全柜为ESCO CLASS II TYPE A2;PCR 仪Gene Amp PCR System 9700、实时荧光 PCR 仪7500 Fast Real-time PCR System 、梯度PCR仪购自 ABI(Applied Biosystems Inc.)公司。
1.1.3 实验动物 昆明成年小白鼠25只,购自昆明医科大学实验动物中心。70日龄DLY三元杂仔猪5头,购自云南省畜牧兽医科学院实验猪场。
1.2 方法
1.2.1 引物设计 根据卡他莫拉菌美国标准菌株ATCC 25238参考菌株(GenBank登录号:U10876.1)的16S rRNA及UspA1基因的保守序列设计、卡塔莫拉菌分离株引物。卡他莫拉菌、猪瘟病毒、猪圆环病毒II型、伪狂犬病毒、乙型脑炎病毒及猪细小病毒检测引物及探针,由云南省热带亚热带动物病毒病重点实验室设计。检测猪繁殖与呼吸综合征病毒欧洲型毒株及美洲型高致病性毒株、经典毒株及通用型引物和探针,以及布氏杆菌、刚地弓形虫、巴氏杆菌种特异的检测引物及探针参考文献[15-20]。以上引物及探针均分别由上海Invitrogen生物科技有限公司、上海GENEray生物科技有限公司及昆明硕擎生物科技有限公司合成。引物、探针见表1。
1.2.2 病毒核酸的抽提 取流产胎儿大脑匀浆,反复冻融3次后,4500×g离心10 min,取上清液按美国OMEGA生化试剂公司的病毒基因组DNA、RNA提取试剂盒说明书操作,提取的病毒核酸放置于-80℃保存备用。
1.2.3 细菌基因组DNA的抽提 刮取分离培养出的细菌菌落,按照细菌基因组DNA抽提试剂盒说明书进行操作,抽提出的细菌基因组DNA放置于-80℃保存备用。
1.2.4 猪繁殖与呼吸综合征病毒欧洲型及美洲型高致病性及经典毒株、猪瘟病毒、猪圆环病毒II型、猪细小病毒、弓形虫、巴氏杆菌PCR及real-time PCR检测 运用云南省热带亚热带动物病毒病重点实验室建立的猪瘟病毒、猪圆环病毒II型real-time PCR和猪细小病毒、伪狂犬病毒PCR检测方法,以及参考相关文献发表的猪繁殖与呼吸综合征病毒欧洲型及美洲型高致病性毒株、经典毒株,刚地弓形虫、巴氏杆菌PCR及实时荧光定量PCR检测方法对送检样品进行检测[15-20]。猪瘟病毒real-time PCR反应体系(25μL):2×AgPath-ID one-step RT-PCR buffer 12.5μL、CSFV-F(10μmol/mL) 1μL、CSFV-R(10μmol/L) 1μL、CSFV-P(10μmol/mL)1μL、50× Detection Enhancer 0.5μL、25× Enzyme Mix 1μL、模板DNA 4μL、补足灭菌ddH2O 4μL。反应条件:45℃温育10 min;95℃预变性10 min,95℃变性3 s、60℃退火30 s,运行45个循环。猪细小病毒PCR反应体系(25μL):2×Taq Plus PCR Master mix 12.5μL、PPV-VP2-F(10μmol/mL)1μL、PPV-VP2-R(10μmol/mL) 1μL、模板DNA 4μL、补充灭菌ddH2O 6.5μL;反应条件: 94℃预变性5 min;95℃变性30 s,57℃退火30 s,72℃延伸40 s,运行35个循环;72℃延伸7min。伪狂犬病毒 PCR扩增反应体系(25μL):2×Taq Plus PCR Master mix 12.5μL、PRV-gE-F(10μmol/ mL) 1μL、PRV-gE-R(10μmol/mL) 1μL、模板DNA 3μL、补充灭菌ddH2O 7.5μL;反应条件:95℃预变性5 min,95℃变性40 s、58℃退火40 s、72℃延伸90 s运行35个循环,72℃延伸5 min。猪圆环病毒II型real-time PCR(25μL):2×qPCR MasterMix 12.5μL、PCV-2-F(10μmol/mL)1μL、PCV-2-R(10μmol/mL) 1μL、PCV-2-P(10μmol/mL) 1μL、模板DNA 4μL、补充灭菌ddH2O 5.5μL;反应条件:95℃预变性10 min,95℃变性5 s、55℃退火10 s、72℃延伸30 s,运行40个循环。

表1 引物、探针信息表Table 1 Primers and probes in this study
1.2.5 细菌分离鉴定 将样品划线接种于血清琼脂、营养琼脂及麦康凯琼脂平板后,置于37℃温箱培养24~48 h,取少许菌落染色镜检观察形态。将细菌纯化后穿刺接种于TSI试管斜面及精氨酸、鸟氨酸、赖氨酸、氨基酸对照、枸橼酸盐、硝酸盐、尿素、七叶苷、靛基质、ONPG、蔗糖、麦芽糖、木糖、葡萄糖、硫化氢微量鉴定管后(其中氨基酸及氨基酸对照管接种后滴加液体石蜡覆盖),置于37℃培养24~48 h后加显色剂判读结果;DNA酶试验:将被检细菌点种于0.2%DNA琼脂平板上,同时点种金黄色葡萄球菌及埃希氏大肠杆菌作为阳性、阴性对照,置于37℃温箱培养24 h,然后加入1 mol/L的盐酸覆盖平板,作用10 min后观察结果,在菌落周围出现透明环的细菌为阳性,无透明环为阴性;氧化酶试验:试验方法加2~3滴1%四甲基对苯二胺(Tetramethy-p-phenylene diamine dihydrochlo-ride)于滤纸上,用牙签挑取1个菌落到纸上涂布,观察菌落的反应,阳性反应在5~10 s内由粉红到黑色,15 min后可出现假阳性反应。吲哚乙酰酯水解试验:称取60 mg吲哚乙酸酯溶解于2 mL分析纯丙酮中备用,制备厚度为1 mm、长5 cm和宽1 cm的新华滤纸片高压灭菌干燥后备用,将纸片浸入吲哚乙酸酯溶液后取出晾干,固定于一平皿中,滴加1滴生理盐水,用接种环取培养板上待鉴定的菌落涂抹于灭菌干燥的新华滤纸片上,记录时间,同时观察菌落颜色变化,如在室温下3min内变为蓝绿色为阳性,不变色为阴性;
β-内酰胺酶试验(纸片酸度定量法):将一小片灭菌干燥的新华滤纸片放置于平皿中,让滤纸吸足青霉素溶液(0.005 mol/L磷酸缓冲液,pH 8.0的0.2%溴甲酚紫+5%无缓冲剂的结晶青霉素),用接种环把10~20个菌落涂抹到滤纸上,盖好平皿后,将滤纸片置于37℃温箱孵育30 min,观察结果,产β-内酰胺酶的菌株使滤纸颜色由紫色变黄色,一般在10 min内即能看到。
1.2.6 卡他莫拉菌16S rRNA和VspA1基因的分子鉴定应用细菌基因组DNA抽提试剂盒抽提分离菌株的基因组DNA进行PCR扩增,并切胶回收测序及序列分析。卡他莫拉菌16S rRNA基因的PCR扩增反应体系(25μL):2×Taq Plus PCR Master mix 12.5μL、M.catarr-ATCC-868-F(10μmol/mL) 1μL、M.catarr-ATCC-868-R(10μmol/mL) 1μL、模板DNA 3μL、补充灭菌ddH2O 7.5μL。反应条件: 95℃预变性10 min,95℃变性45 s、55℃退火45 s、72℃延伸60 s运行35个循环,72℃延伸10 min。卡他莫拉菌UspA1基因的PCR扩增反应体系(25μL): 2×Taq Plus PCR Master mix 12.5μL、M.catarr-UspA1-F(10μmol/mL) 1μL、M.catarr-UspA1-R(10μmol/mL) 1μL、模板DNA 3μL、补充灭菌ddH2O 7.5μL。反应条件:95℃预变性10 min,95℃变性30 s、55℃退火30 s、72℃延伸30 s运行35个循环,72℃延伸 5 min。
1.2.7 小白鼠致病性实验 将纯化后的细菌混悬于无菌生理盐水中,经菌数测定后稀释为1.5×108个细菌/mL,每只小白鼠腹腔接种0.1 mL,共接种20只作为实验组,同时设立5只阴性对照,腹腔接种同等剂量无菌生理盐水。接种后观察、记录发病及死亡情况,解剖死亡小白鼠观察病理变化,无菌采集及回收分离病原菌。
1.2.8 本动物回归实验 将纯化后的细菌混悬于无菌生理盐水中,经菌数测定后稀释为1.5×108个细菌/ mL,每只仔猪颈部肌肉接种1 mL,共接种4只作为实验组,同时设立1只阴性对照,颈部肌肉接种同等剂量无菌生理盐水。接种后观察、记录发病及死亡情况,解剖病死仔猪观察病理变化并无菌采集心血及肝脏回收分离病原菌。
1.2.9 药敏实验 将纯化后的细菌均匀涂布于营养琼脂平板上,贴上药敏试纸于37℃培养24 h后取出观察结果并测定抑菌圈直径。
2 结果
2.1 病原体检测结果 送检样品中没有猪繁殖呼吸综合征病毒欧洲株及美洲株、猪瘟病毒、猪圆环病毒II型、伪狂犬野毒株、猪细小病毒和刚地弓形虫感染。
2.2 细菌分离鉴定结果 送检组织样品经接种环无菌采集样品后,划线接种于血清琼脂、普通营养琼脂及麦康凯琼脂平板,37℃培养过夜。在普通营养琼脂上形成圆形、凸起、光滑、边缘整齐、无色透明、无特殊气味的菌落,在巧克力琼脂平板上形成圆形、凸起、光滑、边缘整齐的乳白色菌落,在麦康凯琼脂平板不生长(图2)。经革兰氏染色镜检呈革兰氏阴性双球菌(图3),多呈肾形,成对排列(短轴相对),无鞭毛,无芽孢。生化实验结果为氧化酶和触酶阳性(图4),不能利用糖类产酸,DNA水解实验阳性(菌斑周围及菌斑下出现无色透明区),乙酰酯酶试验阳性(呈蓝绿色),β内酰胺酶试验阳性(呈现黄色)。TSI穿刺接种不产酸产气产H2S,不分解葡萄糖、麦芽糖、乳糖、蔗糖、果糖产酸,硝酸盐还原试验阳性,利用蔗糖合成多糖阴性(图5)。根据细菌革兰氏染色镜检及生化鉴定结果,初步判定分离菌株为卡他莫拉菌。
2.3 小白鼠致病性实验 接种细菌的20只昆明小白鼠精神萎顿,饮食欲废绝,打堆,接种后24~53 h内全部死亡。解剖可见肺脏、肝脏、脾脏、肾脏肿大、淤血或出血。从死亡小白鼠肝脏里分离到卡他莫拉菌。5只阴性对照昆明小白鼠无任何临床症状。

图2 不同培养基上细菌的生长情况Fig.2 The growth of bacteria on diffenrent culture mediaA∶ 细菌在普通营养琼脂平板上形成菌落; B∶ 在麦康凯平板上无菌落生长A∶ Bacterial colonies on the surface of general nutrition agar; B∶No bacterial colonies in Maconkey agar plate

图3 革兰氏染色镜检结果Fig.3 The results of Gram staining

图4 生化实验结果Fig.4 The results of biochemical testsA∶ DNA酶水解试验; B∶ β内酰胺酶试验; C∶ 氧化酶试验; D∶乙酰酯酶试验(呈蓝绿色)A∶ DNA enzyme hydrolysis test; B∶ Beta-lactamases test; C∶ Oxidase test; D∶ Acetyl esterase test

图5 微量细菌生化鉴定结果Fig.5 The micro biochemical vesults of the isolate
2.4 本动物回归实验 实验猪接种分离菌株后,3~5 d内全部死亡。接种后猪精神萎顿,打堆,发热,体温最高达42.5℃,呼吸困难、窘迫,少量采食,并伴随呕吐,猪死亡前一晚体温降至39.5℃以下(图6)。病理解剖检查发现猪全身皮肤出血(发绀),皮下脂肪及肌肉出血;下颌淋巴结、肠系膜淋巴结、肺门及中隔淋巴结肿大出血;肺脏局部出血;肾脏质脆淤血有极细点状出血点;小肠鼓气并充血、出血,小肠粘膜面出血;胃粘膜广泛性弥漫性脱落且局部出血;肾上腺肿大出血;肝脏局部呈现暗黑色;脾脏呈现暗黑色;膀胱粘膜出血,大脑未见明显异常(图7)。结果表明,接种猪与发病猪的临床症状及病理变化完全一致。

图6 接种病死猪臀部、下腹部及耳朵皮肤可见明显的发绀Fig.6 Skin cyanosis observed in skin of the piglets for animal regression experiment
2.5 分子鉴定结果 PCR扩增出16S rRNA基因大约868 bp大小的目的片段以及UspA1基因大约406 bp大小的目的片段(见图8),所得序列经过校正、拼接后在NCBI GenBank中进行Blast,测定序列与中卡他莫拉菌参考菌株BBH18株(GenBank登录号:NC_014147.1)的16S rRNA和UspA1基因序列同源性达100%。
2.6 药敏实验结果 药敏实验结果显示(图9),分离细菌对氧氟沙星、庆大霉素、诺氟沙星、头孢噻肟高度敏感,对呋喃唑酮、头孢曲松钠、四环素中度敏感,对氨苄青霉素低度敏感,对青霉素耐药。

图7 接种分离菌株后病死猪内脏器官病理变化Fig.7 Pathological changes of internal organs of the piglets for animal regression experimentA∶ 颌下淋巴结肿大、出血; B∶ 肠系膜淋巴结肿大、出血; C∶ 肠道及胃鼓气, 浆膜面可见充血、出血; D∶ 胃粘膜糜烂、溃疡及出血; E∶ 肠粘膜糜烂、溃疡及出血; F∶ 肺脏肿大、出血; G∶ 肾上腺肿大、出血; H∶ 肾脏肿大, 表面布满针尖大小出血点; I∶ 膀胱粘膜可见有出血点A∶ Mandibular lymph node was swelling and bleeding; B∶ Mesenteric lymph nodes were swelling and bleeding; C∶ Gastrointestinal tract was full of gas and its serosal surface showed congestion and hemorrhage; D∶ Gastric mucosa was anabrotic, ulcerous and bleeding; E∶Intestinal mucosa was anabrotic, ulcerous and bleeding; F∶ The lung was swelling and bleeding; G∶ Adrenal glands were swelling and bleeding; H∶ Kidneys were swelling and bleeding; I∶ Mucous membrane of bladder was bleeding
3 讨论
随着我国生猪养殖业的规模化、集约化快速发展,养殖水平不断提高,猪的重大疫病科学、规范化免疫预防成效显著,在临床上引起暴发、流行及批量死亡的趋势有所下降。但是由于饲料中长期添加各类型抗菌药物,以及保健过程中的过度用药、过度治疗、违法违规用药等抗菌药物的滥用形势日趋严峻,导致了养殖环境中的病原菌耐药性及致病力越来越强,饲养猪频发细菌感染从而导致急性发病死亡的案例越来越多。本文从送检的急性发病死亡猪的组织病料中分离获得1株致病力极强的革兰氏阴性双球菌,经细菌生化鉴定及16S rRNA和UspA1基因序列分析,鉴定为卡他莫拉菌。动物回归实验也成功复制出了与发病死亡猪完全相同的临床症状及病理变化的病例,并且成功分离到了攻毒菌株。为了证实该分离菌株是否是引起此次疫情的主要病原体,还对送检样品进行了猪繁殖与呼吸道综合征病毒欧洲株及美洲株、猪瘟病毒、猪圆环病毒II型、伪狂犬野毒、猪细小病毒、刚地弓形虫及巴氏杆菌感染等可能的病原检测,结果显示上述病原均被排除。选用药敏实验敏感药物对发病猪的治疗效果也很显著,从而最终确诊了卡他莫拉菌是引起此次猪发病、死亡的主要病原体。卡他莫拉菌引起人类感染发病的报道很多,但在动物上的相关研究报道并不多见,本次猪源卡他莫拉菌的成功分离、鉴定在国内尚属首次报道。
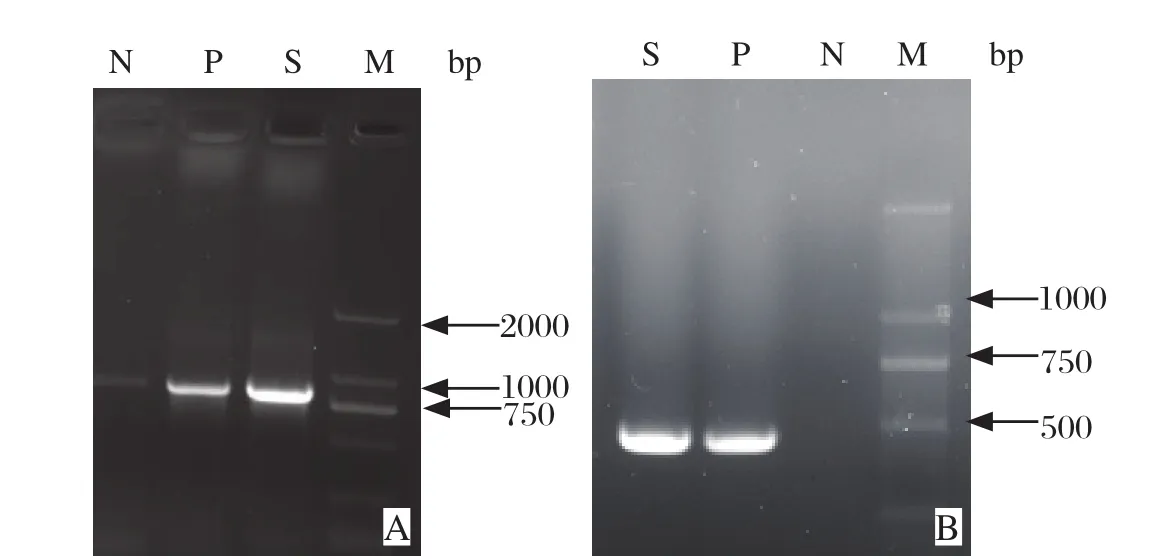
图8 16S rRNA基因PCR扩增结果Fig.8 The results of PCR of 16S rRNA geneA∶ 16S rRNA基因; B∶ UspA1基因. M∶ DNA分子量标准(DL2000); S∶ 样品; P∶阳性对照; N∶阴性对照A∶ 16S rRNA gene; B∶ UspA1 gene. M∶ DNA Marker(DL2000); S∶The isolated bacteria; P∶ Positive control; N∶ Negative control
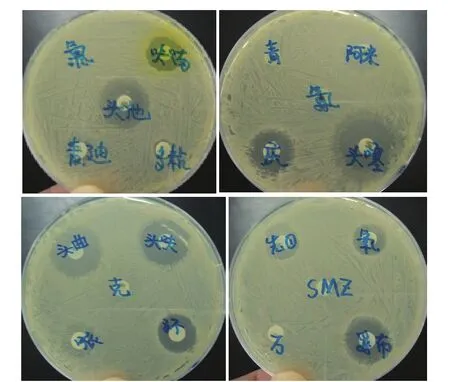
图9 药敏试验结果Fig.9 The results of drug sensitive test
[1] 陈东科, 孙长贵. 实用临床微生物学检验与图谱[M]. 2版.北京∶ 人民卫生出版社, 2011, 356-364.
[2] 庄新国, 马晓波, 张加勤, 等. 流感嗜血菌及卡他布兰汉菌感染的临床特征与药敏分析[J]. 中华医院感染学杂志, 2014, 24(19)∶ 4705-4707.
[3] 王俊涛, 白雪帆, 任红侠, 等. 院内获得性卡他布兰汉菌支气管-肺感染28例分析[J]. 中华传染病杂志, 2000,18(1)∶ 56.
[4] 罗蓉, 黄英, 刘岚, 等. 小儿下呼吸道感染中卡他莫拉菌的分离特点与耐药性分析[J]. 第三军医大学学报, 2007, 29(18)∶ 1818-1820.
[5] 刘军, 乐朝阳, 王炫德, 等. 中医院患者下呼吸道感染卡他莫拉菌耐药性分析[J]. 中华医院感染学杂志, 2014, 24(22)∶ 5506-5507, 5510.
[6] 严辉. 引起呼吸道感染的卡他莫拉氏菌的检出及药敏试验[J]. 实用预防医学, 2007, 14(4)∶ 1235-1236.
[7] 秦晓华, 王明贵. 人呼吸道病原菌-卡他莫拉菌[J]. 中国感染与化疗杂志, 2011,11(2)∶ 136.
[8] 张莉萍, 李贺扬, 袁达康, 等. 东莞市12月~18月龄健康婴幼儿_省略_嗜血杆菌及卡他莫拉菌携带状况调查[J].中国卫生检验杂志, 2011, 21(2)∶ 496-498.
[9] 王频佳, 谢成彬, 吴雨露, 等. 儿童呼吸道卡他莫拉菌分离株耐药性与BRO基因分型研究[J]. 临床儿科杂志, 2013, 31(8)∶ 719-722.
[10] 袁少伟, 李慧儿. 童呼吸道卡他莫拉菌感染分布及耐药分析[J]. 宁夏医学杂志, 2014, 36(5)∶ 451-453.
[11] 姚连昌. 儿童卡他布兰汉菌肺部感染16例[J]. 临沂医学专报, 1994, 1(16)∶ 71-72.
[12] 尚士尧. 呼吸系统卡他布兰汉菌感染[J]. 辽宁医学杂志1989, 3(4)∶ 201-202.
[13] 刘占芹, 肖洋. 卡他布兰汉菌致婴幼儿脑膜炎1例[J]. 中国煤炭工业医学杂志, 2001, 4(4)∶ 317.
[14] 潘韶霞, 徐洪玉, 潘韶华, 等. 卡他莫拉菌的致病性及耐药性的临床研究[J]. 中华医院感染学杂志, 2003, 13(6)∶583-585.
[15] Xiao S, Chen Y, Wang L, et al. Simultaneous detection and differentiation of highly virulent and classical Chinese-type isolation of PRRSV by real-time RTPCR[J]. J Imm Res, 2014∶ 809656.
[16] Kleiboeker S B, Schommer S K, Lee S M, et al. Simultaneous detection of North American and European porcine reproductive and respiratory syndrome virus using real-time quantitative reverse transcriptase-PCR[J]. J Vet Diagn Invest, 2005, 17∶165-170.
[17] Hinić V, Brodard I, Thomann A. et al. Novel identification and differentiation of Brucella melitensis, B. abortus, B. suis,B. ovis, B. canis, and B. neotomae suitable for both conventional and real-time PCR systems[J]. J Mic Met, 2008,75∶ 375-378.
[18] 孔得翔, 王素华, 曲道峰, 等. 弓形虫半巢式PCR检测方法的建立[J].中国兽医学报, 2009, 29(1)∶ 52-54.
[19] 邵国青, 杨莉莉, 王继春, 等. 弓形虫ITS-1序列PCR诊断方法的建立[J].中国人兽共患病学报, 2008, 24(5)∶ 446-450.
[20] Townsend K M, Boyce J D, Chung J Y, et al. Genetic organization of Pasteurella multocida cap loci and Develepment of a multiplex capsular PCR typing system[J]. J Clin Microbiol, 2001, 39(3)∶ 924-929.
FIRST REPORT OF MORAXELLA CATARRHALIS CASES IN SWINE IN CHINA
YU Tao-ying1, SHI Yu-you2, LI Guo-hua3, SHA Li-dong4, LIU Ning5, LI Mei-quan5, SONG Cong5, YANG Rong-li6, LI Hua-chun6, YAO Jun6
(1. Gongshan Bureau of Agriculture and Science and Technology, Gongshan 673500, China; 2. Weishan Center for Prevention and Control of Animal Disease, Weishan 672400, China; 3. Mojiang Center for Prevention and Control of Animal Disease, Mojiang 654800, China; 4. Fuming Center for Prevention and Control of Animal Disease, Fuming 650400, China; 5. College of Animal Science and Technology, Yunnan Agricultural University, Kunming 650201, China; 6. Yunnan Tropical and Subtropical Animal Virus Diseases laboratory, Yunnan Animal Science and Veterinary Institute, Kunming 650224, China )
A disease characterized by high fever, shortness of breath, distress, skin cyanosis and sudden death occurred in January 2015 in reserve pigs of a large scale farm, which located in Kunming suburb. As a result, one strain of gram-negative bacteria with double kidney shape was isolated from lymph nodes and internal organs of a dead pig. The results of pathogenicity, animal regression experiment, bacterial biochemical identification and 16S rRNA gene sequence analysis showed that the isolate was highly pathogenic Moraxellacatarrhailis. The identity of the 16S rRNA and UspA1 gene sequences of the isolate was 100% with the reference strain Moraxella catarrhalis BBH18(GenBank Reference Sequence∶ NC_014147.1). The isolate was highly susceptible to cefotaxime sodium and medium susceptible to tobramycin, gentamicin, ceftriaxone sodium, cefuroxime, ceftazidime, furadantin and tetracycline. Emergency prevention and treatment of the disease was carried out for other pigs using susceptible drugs.
Moraxella catarrhalis; isolation; identifi cation; swine
S852.611
A
1674-6422(2017)01-0036-09
2016-05-26
云南省科技厅重大科技专项(2012ZA017)
余桃樱,女,兽医师,主要从事实验室诊断检测技术工作;石於友,男,兽医师,主要从事兽医临床及实验室诊断检测技术工作
姚俊,E-mail:810535839@qq.com

