日本血吸虫TOR真核表达载体的构建及其在293T细胞中的表达
宰金丽,马 帅,王 涛,贾秉光,柴淑梅,张 倩,林矫矫,傅志强
(中国农业科学院上海兽医研究所,上海200241)
·研究论文·
日本血吸虫TOR真核表达载体的构建及其在293T细胞中的表达
宰金丽,马 帅,王 涛,贾秉光,柴淑梅,张 倩,林矫矫,傅志强
(中国农业科学院上海兽医研究所,上海200241)
本研究扩增到日本血吸虫SjTOR完整的蛋白编码区并将其克隆到pXJ40-FLAG载体的Hind Ⅲ、XhoⅠ 酶切位点,构建真核表达质粒pXJ40-FLAG-TOR。将测序正确的质粒转染到293T细胞中进行表达,然后应用间接免疫荧光、实时荧光定量PCR、Western blot检测其在293T细胞中的表达情况。测序结果表明SjTOR蛋白编码区为1245 bp,真核表达质粒pXJ40-FLAG-TOR构建成功。转染293T细胞48 h后,应用间接免疫荧光染色可观察到转染重组质粒的细胞有特异性绿色荧光,空质粒对照则未见。实时荧光定量PCR结果显示,在转染质粒 pXJ40-FLAG-TOR 6 h后SjTOR蛋白的基因已有转录,至转染24 h时转录水平最高,随后开始降低。Western blot结果显示SjTOR蛋白分子量约53 kDa,可被FLAG单抗和抗SjTOR-ED1抗血清识别。结果表明SjTOR蛋白可以在293 T细胞中表达,为进一步研究SjTOR蛋白的生物学功能和DNA疫苗打下了基础。
日本血吸虫;TOR蛋白;基因克隆;真核表达
日本血吸虫病是我国南方地区严重危害人民身体健康和社会经济发展的人畜共患寄生虫病,其病原体是日本血吸虫。血吸虫尾蚴钻过终末宿主的皮肤,经历复杂的移行过程发育为成虫后,在哺乳动物的下腔静脉系中长期寄生。血吸虫是一种古老的寄生生物,在长期进化过程中形成了对宿主的适应性,特别是其通过各种途径(分子)逃避宿主免疫损伤,避免被宿主的免疫应答所清除,这一现象称免疫逃避,它是吸血虫得以在宿主体内长期存活并完成生活史的关键[1]。补体反应是反应非常迅速、级联放大的免疫防御机制,是机体免疫应答的重要组成部分。研究表明血吸虫尾蚴突破皮肤屏障后就受到宿主免疫应答的攻击,补体反应是宿主最早开始杀伤虫体的免疫应答[2,3]。已有研究表明在成虫阶段,血吸虫可通过和补体C1q结合最终抑制膜攻击复合物形成来抑制和调节宿主补体反应[4,5]。已发现多个血吸虫分子可能和补体免疫调节相关,并且作用于补体反应的多个节点[2]。
TOR(trispanning orphan receptor)蛋白是一种位于血吸虫体被表面抗原受体,可以结合补体C2a分子[3],推测其在血吸虫免疫逃避过程中起重要作用。本实验室马帅等[6]克隆了日本血吸虫TOR基因,利用原核系统表达了SjTOR基因N端第一个膜外区的重组蛋白,该重组蛋白具有较好的抗原性并能诱导显著的减虫率。日本血吸虫TOR全长蛋白的研究尚未见报道。分析SjTOR基因的翻译修饰位点时发现其具有较多的糖基化位点和磷酸化位点,这些可能对其生物学功能有重要作用。在大肠杆菌中获得的重组蛋白由于缺少修饰和糖基化、磷酸化等翻译后加工,常形成包涵体而影响表达蛋白的生物学活性及构象。因此本研究利用分子生物学技术构建了真核表达质粒pXJ40-FLAG-TOR并在真核细胞293T细胞中表达SjTOR蛋白,为进一步在体内研究SjTOR全长蛋白的生物学功能奠定基础。
1 材料和方法
1.1 材料 Trizol、SuperscriptTMⅢ反转录酶购自Invitrogen 公司;Ex Taq DNA 聚合酶、T4 DNA连接酶、pMD19-T 载体、HindⅢ、XhoⅠ限制性内切酶、TaKaRa PrimeScriptTMRT reagent Kit with gDNA Eraser、SYBR Premix Ex TaqTM(Tli RNaseH Plus)均购自 TaKaRa 生物工程(大连)有限公司;DNA纯化回收试剂盒、小型质粒回收试剂盒购自 Axygen公司;大型质粒纯化回收试剂盒购自 QIAGEN 公司;FuGene®HD 转染试剂购自Progema 公司;Anti-FLAG mouse monoclonal antibody购自 CMCTAG 公司;HRP标记的山羊抗小鼠IgG二抗购自北京碧云天生物技术研究所;pXJ40-FLAG 质粒由中国农业科学院上海兽医研究所禽病实验室保存;Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor® 488 conjugate购自Invitrogen; DAPI 染料购自上海前尘生物科技有限公司;抗荧光淬灭封片液购自sigma公司;293T细胞为本实验室保存;大肠杆菌感受态DH5α购自北京全式金生物技术有限公司;DMEM培养基、胎牛血清(fetal bovine serum,FBS)、PBS购自Gibco公司;日本血吸虫虫体由中国农业科学院上海兽医研究所血吸虫实验室保存;6 周龄雄性 BALB/c 购自上海斯莱克实验动物有限公司;中国大陆株日本血吸虫阳性钉螺由中国农业科学院上海兽医研究所钉螺室提供。
1.2 方法
1.2.1 利用在线软件预测SjTOR磷酸化和糖基化位点 分别利用DISPHOS预测蛋白磷酸修饰位点,YinOYang 1.2 和NetNGlyc 1.0 Server分别预测氨基酸O型糖基化修饰位点和 N型糖基化修饰位点。
1.2.2 载体构建与引物设计 设计引物分别在SjTOR基因ORF的上、下游引入Hind Ⅲ、XhoⅠ酶切位点,PCR反应体系与条件参考2×Taq Master Mix(康为世纪)说明书。PCR反应条件:94℃预变性 2 min;94℃变性 30 s,60℃退火30 s,72℃延伸 90 s,共34个循环;72℃终延伸2min,4℃终止反应。PCR产物经小量DNA片段快速纯化回收试剂盒纯化回收后,与pXJ40-FLAG载体进行双酶切连接,转化至DH5α中,挑取单克隆进行菌液PCR鉴定并进行测序验证。将构建成功重组质粒pXJ40-FLAG-TOR利用QIAGEN 质粒抽提试剂盒大量提取质粒保存备用。
1.2.3 转染293T细胞 将生长状态良好的细胞用完全培养基稀释到一定的细胞浓度,分别加入孔板,待细胞汇合度达90%左右,按照FuGENE® HD Transfection Reagent试剂盒操作说明书进行转染。
1.2.4 实时荧光定量分析293T细胞转染pXJ40-FLAG-TOR基因后的转录水平 分别于转染细胞前和转染细胞后6、12、18、24、30、36、42、48 h收集293 T细胞,弃去培养基后用 PBS 洗2次,DEPC水洗1次,然后加入Trizol反复吹打细胞,提取细胞的总RNA并反转录成cDNA。以SjTOR的荧光定量 PCR引物和人 GAPDH 基因为内参,以各转染时期的细胞cDNA 为模板,按照SYBR Premix Ex TaqTM(Tli RNaseH Plus)试剂说明书进行荧光定量 PCR 分析,每个实验重复3次。GAPDH内参基因的引物信息见表1。
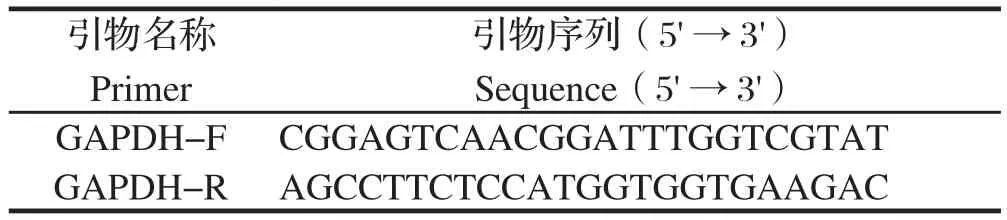
表1 GAPDH内参基因的引物Table 1 Primers for reference gene GAPDH
1.2.5 免疫荧光检测(immunofluorescence assay,IFA)鉴定蛋白表达 293T细胞转染48 h后,移去培养基,用1×PBS清洗细胞2次,动作要轻柔。固定、透化细胞后,用3%BSA室温封闭2 h,加入1∶100稀释的ED1血清,4℃孵育过夜,吸去一抗,用1×PBST清洗细胞3次。避光加入1∶2000稀释的Goat anti-Mouse IgG (H+L) 二抗, Alexa Fluor® 488 conjugate,室温避光孵育1h;吸去二抗,用1×PBST清洗细胞3次,动作要轻柔,加入细胞核染色液DAPI避光作用5 min;用1×PBST清洗细胞3次后用Sigma抗荧光淬灭封片液封片。用倒置荧光显微镜观察荧光情况,拍照保存。
1.2.6 Western blot检测目的蛋白在不同时间的表达情况 分别收取未转染细胞,以及转染后9、12、15 h的细胞,加入强裂解液4℃裂解,离心取细胞裂解液上清进行Western blot,分析SjTOR在293T细胞中的表达。
2 结果
2.1 在线软件预测氨基酸磷酸化和糖基化修饰位点
利用DISPHOS预测SjTOR蛋白中氨基酸的磷酸化修饰位点,结果可能存在8个丝氨酸修饰位点分别是126、127、132、138、140、142、146、155位丝氨酸,4个苏氨酸修饰位点分别是148、318、326、405位苏氨酸,3个酪氨酸修饰位点分别是129、327、336位酪氨酸。其中10个修饰位点位于SjTOR的第一个膜外区和C末端。应用YinOYang预测氨基酸O型糖基化修饰位点,结果在138S、376T、379S、405T、407T等5个氨基酸可能存在O型糖基化修饰,分别位于SjTOR的第一个膜外区和C末端。应用NetNGlyc 1.0 Server预测N型糖基化修饰位点,结果在305NLTG、314NESN、362NLTQ、372NTTS、377NVST、389NTTT、 393NVTS等7个基序区可能存在N型糖基化修饰。分析结果如图1。

图1 SjTOR氨基酸磷酸化和糖基化位点分析Fig. 1 Analysis of amino acid phosphorylation and glycosylation sites of SjTOR
2.2 成功构建pXJ40-FLAG-TOR 以构建的真核表达质粒pXJ40-FLAG-TOR为模板进行双酶切鉴定,酶切片段大小与插入片段大小一致(图2),序列分析结果表明插入片段位点方向正确,pXJ40-FLAGTOR真核表达质粒构建成功。
2.3 293T细胞转染后的SjTOR基因转录水平 pXJ40-FLAG-TOR质粒转染293T细胞后,分别于转染细胞前和转染细胞后6、12、18、24、30、36、42、48 h收集293T,应用实时荧光定量PCR 分析SjTOR基因在细胞中的转录水平。结果显示,在转染后6 h该基因已有转录,24 h转录水平达最高,随后开始降低,符合瞬时转染基因转录的特征(图3)。

图2 重组质粒PXJ40-FLAG-TOR酶切鉴定Fig.2 Identifi cation of the recombinant plasmid pXJ40-FLAG-TOR digested by Hind Ⅲ and Xho ⅠM∶ DNA分子量标准(DL5000); 1∶ pXJ40-FLAG-TORM∶ DNA Marker(DL5000); 1∶ pXJ40-FLAG-TOR

图3 SjTOR在293T细胞中不同时间的转录水平Fig. 3 Transcription level of SjTOR in 293T cells at different times
2.4 IFA检测293T细胞的表达 在转染48 h后细胞经免疫荧光染色后在倒置荧光显微镜下观察,转染pXJ40-FLAG-TOR质粒的293T细胞内可见绿色荧光,主要分布于胞质和细胞膜部分,阳性细胞占比大约为27%,而转染空质粒pXJ40-FLAG的293T细胞未见绿色荧光(图4)。

图4 TOR在293T细胞中表达的免疫荧光检测结果Fig.4 IFA result of TOR expressed in 293T cells A∶ pXJ40-FLAG-TOR转染293T细胞48 h; B∶ pXJ40-FLAG转染293T细胞48 h
2.5 Western blot检测TOR蛋白在293T细胞中的表达 分别收取未转染质粒的细胞和转染质粒后9、12、15 h的293T细胞,制备细胞蛋白裂解液,分别应用FLAG单抗、抗SjTOR-ED1血清、小鼠正常血清和抗GAPDH单抗进行进行 Western blot 检测,结果FLAG单抗和抗SjTOR-ED1血清均能识别特异性条带,分子量大约在53 kDa,小鼠正常血清未识别任何条带,GAPDH单抗识别的蛋白条带大约在36 kDa,和GAPDH的理论分子量一致。结果表明,在转染9 h时可见有微量SjTOR蛋白表达,在转染15 h时表达量较高(图5)。

图5 Western blot检测TOR蛋白的表达情况Fig.5 Western blot analysis of TOR protein expression in 293T cellsA∶一抗为小鼠FLAG单抗; B∶一抗为小鼠SjTOR-ED1三免血清; C∶ 一抗为小鼠阴性血清; D∶ 一抗为GAPDH单抗. M∶ 蛋白分子量标准A∶ Anti-FLAG mouse monoclonal antibody ; B∶ Probed by positive mouse serum; C∶ Probed by normal mouse serum; D∶ Anti-GAPDH mouse monoclonal antibody. M∶ Protein molecular weight Marker
3 讨论
血吸虫病严重危害着人畜健康,被认为是仅次于疟疾的全球第二大寄生虫疾病[7]。吡喹酮药物在我国血吸虫病的防控中起到重要作用,但是实践表明,由于血吸虫中间宿主钉螺难以消灭,家畜传染源未能得到有效控制,单独以大规模吡喹酮治疗为主的防治措施难以阻断血吸虫病的传播,且难以解决预防和重复感染的难题。因此,加强血吸虫病疫苗的研制与开发,将药物治疗的短效作用与疫苗的长效预防作用相结合,是血吸虫病防治的重要发展方向[8]。
Inal等[9]首先在埃及血吸虫、曼氏血吸虫中鉴定到TOR。随后研究人员发现TOR广泛存在于包括早期的硬骨鳕鱼以及大鼠和人类等多种生物中[10]。埃及血吸虫和曼氏血吸虫TOR的研究结果表明该分子是一个有潜力的血吸虫疫苗候选抗原分子[9]。研究表明TOR可能通过结合补体C2分子从而干扰补体经典途径的激活[11-15]或者通过阻断D因子介导的B因子的裂解从而干扰补体替代途径的激活[16]。
马帅等[6]研究结果表明日本血吸虫TOR蛋白没有信号肽,有4个跨膜区,SjTOR的ed1是其功能的主要载体。以日本血吸虫TOR分子的第一个膜外区段制备的重组蛋白在小鼠中诱导了较高的免疫保护效果。本研究分析表明TOR具有多个潜在的磷酸化和糖基化位点,且多数位于第一个膜外区。重组蛋白在大肠杆菌中以包涵体的形式表达,在纯化过程中复性,由于重组蛋白中的凝血酶因素和重折叠过程中的不确定性有可能使其生物学功能受影响, 如能成功应用真核系统表达则可以收获经过正确的体内折叠的活性蛋白,对其生物学功能研究有较大的促进[17]。本研究成功构建了SjTOR的真核表达质粒pXJ40-FLAG-TOR,转染293T细胞后经检测显示该质粒可以在293T细胞中表达,该研究结果为TOR功能研究奠定了坚实基础。进而可以制备吸血虫DNA疫苗,在动物体内评价SjTOR作为候选疫苗分子的潜力。
[1] 朱荫昌, 吴观陵, 管晓虹. 血吸虫感染免疫学[M]. 上海∶上海科学技术文献出版社, 2008
[2] Skelly P J. Intravascular schistosomes and complement [J]. Trends Parasitol, 2004, 20(8)∶ 370-374.
[3] 吴观陵. 人体寄生虫学[M]. 北京∶ 人民卫生出版社, 2005∶ 39-54.
[4] McIntosh R S, Jones F M, Dunne D W, et al. Characterization of immunoglobulin binding by schistosomes[J]. Parasite Immunol, 2006, 28(9)∶ 407-419.
[5] Jiz M, Friedman J F, Leenstra T, et al. Immunoglobulin E (IgE) responses to paramyosin predict resistance to reinfection with Schistosoma japonicum and are attenuated by IgG4[J]. Infect Immun, 2009,77(5)∶ 2051-2058.
[6] 马帅, 韩艳辉, 洪炀, 等. 日本血吸虫四跨膜孤儿受体(TOR)克隆及其第一个膜外区基因的表达[J]. 中国动物传染病学报, 2014, 22(6)∶ 46-52.
[7] McManus D P, Loukas A. Current status of vaccines for schistosomiasis[J]. Clin Microbiol Rev, 2008, 21(1)∶ 225-242.
[8] Engels D, Chitsulo L, Montresor A, et al. The global epidemiological situation of schistosomiasis and new approaches to control and research[J]. Acta Trop, 2002, 82(2)∶ 139-146.
[9] Inal J M. Schistosoma TOR (trispanning orphan receptor), a novel, antigenic surface receptor of the blood-dwelling, Schistosoma parasite[J]. Biochim Biophys Acta, 1999, 1445(3)∶ 283-298.
[10] Inal J M. Complement C2 receptor inhibitor trispanning∶from man to schistosome[J]. Semin Immunopathol, 2005, 27(3)∶ 320-331.
[11] Lochmatter C, Schifferli J A, Martin P J. Schistosoma mansoni TOR is a tetraspanning orphan receptor on the parasite surface[J]. Parasitology, 2009, 136(5)∶ 487-498.
[12] Inal J M, Hui K M, Miot S, et al. Complement C2 receptor inhibitor trispanning∶ a novel human complement inhibitory receptor[J]. J Immunol, 2005, 174(1)∶ 356-366.
[13] Inal J M, Sim R B. A Schistosoma protein, Sh-TOR, is a novel inhibitor of complement which binds human C2[J].FEBS Lett, 2000, 470(2)∶131-134.
[14] Inal J M, Schifferli J A. Complement C2 receptor inhibitor trispanning and the beta-chain of C4 share a binding site for complement C2[J]. J Immunol, 2002, 168(10)∶ 5213-5221.
[15] Inal J M, Schneider B, Armanini M, et al. A peptide derived from the parasite receptor, complement C2 receptor inhibitortrispanning, suppresses immune complex-mediated inflammation in mice[J]. J Immunol, 2003, 170(8)∶ 4310-4317.
[16] Hui K M, Magnadóttir B, Schifferli J A, et al. CRIT peptide interacts with factor B and interferes with alternative pathway activation[J]. Biochem Biophys Res Commun, 2006, 344(1)∶ 308-314.
[17] 刘志刚, 朱健琦, 黄海珍, 等. 真核表达与原核表达的德国小蠊变应原Blag2蛋白结构的光谱学研究[J]. 光谱学与光谱分析, 2006 (5)∶ 879-883.
CONSTRUCTION OF EUKARYOTIC EXPRESSION VECTOR OF
SCHISTOSOMA JAPONICUM TOR AND ITS EXPRESSION IN 293T CELLS
ZAI Jin-li, MA Shuai, WANG Tao, JIA Bing-guang, CHAI Shu-mei, ZHANG Qian, LIN Jiao-jiao, FU Zhi-qiang
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
The DNA fragment encoding Schistosoma japonicum TOR protein were amplifi ed from cDNA templates by PCR and cloned into pXJ40-FLAG through HindⅢ、XhoⅠto construct the eukaryotic expression plasmid pXJ40-FLAG-TOR. The recombinant plasmid was verifi ed by sequencing and transfected into 293T cells. The expression of the target protein in 293T cell was detected by indirect immunofl uorescence, Western blot and quantitative Real-time PCR. Successful expression of SjTOR protein was confi rmed by the specifi c green fl uorescence in 293T cells after transfection for 48 h and no green fl uorescence in the cell transfected with the control plasmid. Quantitative Real-time PCR results showed that the transcription of SjTOR gene in 293T cells could be detected at 6 h and came to a head at 24 h after trandfection, since then began to decline. Western blot results demonstrated that SjTOR with the molecular weight of 53 kDa was recognized by Anti-FLAG mouse monoclonal antibody and SjTOR-ED1 antiserum. Results showed that the SjTOR proteins could be expressed in 293 T cells, and laid a foundation for further research on SjTOR biological function and its DNA vaccine.
Schistosoma japonicum; TOR protein; gene clone; eukaryotic expression
S852.735
A
1674-6422(2017)01-0066-06
2016-08-16
国家自然科学基金(31472188);国家科技支撑计划(2015BAI09B04);上海市领军人才后备队计划(201442)
宰金丽,女,硕士研究生,兽医学专业
傅志强,E-mail:fuzhiqiang@shvri.ac.cn

