丙戊酸和氢气对缺氧小胶质细胞表型的影响
吴曦子,曾仁庆,赵洋子,常盼盼,范晨玲,王红,崇巍
(中国医科大学附属第一医院1.急诊科;2.神经外科;3.内分泌科,沈阳110001)
丙戊酸和氢气对缺氧小胶质细胞表型的影响
吴曦子1,曾仁庆1,赵洋子1,常盼盼2,范晨玲3,王红3,崇巍1
(中国医科大学附属第一医院1.急诊科;2.神经外科;3.内分泌科,沈阳110001)
目的研究丙戊酸(VPA)和氢气(H2)对缺氧小胶质细胞表型的影响。方法对缺氧BV2小胶质细胞分别给予VPA和H2处理后,收集上清和细胞团,应用ELISA、流式细胞术和实时PCR技术检测表型标志物。结果与对照组相比,缺氧增加BV2细胞M1型表型标志物mRNA(iNOS)的表达,降低M2型表型标志物mRNA(CD206、TGF⁃β)的表达,使M1型和M2型表型标志物mRNA的比值(CD16∶CD206、iNOS∶CD206、iNOS∶TGF⁃β)升高(P<0.05)。与缺氧组相比,VPA降低缺氧BV2的M1型表型标志物蛋白(CD16/32)和mRNA(iNOS)的表达,使M1型和M2型表型标志物mRNA的比值(CD16∶CD206、CD32∶CD206、iNOS∶CD206、iNOS∶TGF⁃β)降低(P<0.05)。与缺氧组相比,H2降低缺氧BV2的M1型表型标志物蛋白(TNF⁃α、CD16/32、iNOS)和mRNA(iNOS)的表达,升高M2型表型标志物蛋白(IL⁃10)和mRNA(CD206、TGF⁃β)的表达,使M1型和M2型表型标志物mRNA的比值(CD16∶CD206、iNOS∶CD206、iNOS∶TGF⁃β)降低(P<0.05)。结论缺氧使小胶质细胞向促炎表型转化;VPA和H2均可抑制缺氧对小胶质细胞的促炎作用。
缺氧;小胶质细胞;氢气;丙戊酸;巨噬细胞表型
创伤性脑损伤(traumatic brain injury,TBI)的关键在于缺血(或)缺氧引起的炎症反应,进而诱发脑细胞水肿,加重脑组织缺氧。因而抑制炎症反应是治疗严重TBI的主要策略[1⁃2]。研究[3⁃5]发现,丙戊酸(valproic acid,VPA)和氢气(hydrogen,H2)对TBI有治疗作用,但二者抑制TBI致炎症反应的机制尚未阐明。
近年研究发现,巨噬细胞作为炎症反应的主要调控者,当机体受到外界刺激时,可分化出M1型和M2型2种功能表型,二者的相对关系控制着炎症反应的进程,且表达出特异性的表型标志物。这种功能表型转化与细胞内外一系列信号转导通路、转录因子和转录后修饰等有关[6]。在中枢神经系统炎症反应中,小胶质细胞也具有上述特点。严重的颅脑损伤可引起过度的炎症反应,出现M1型小胶质细胞占主导,造成神经组织不可逆损伤[7]。因而本研究以体外缺氧刺激小胶质细胞为研究对象,给予VPA或H2干预,进行表型标志物的检测,旨在研究VPA和H2对缺氧小胶质细胞表型转化的作用,为探索二者对TBI炎症反应的干预机制提供理论基础。
1 材料与方法
1.1 细胞培养和传代
小鼠小胶质细胞BV2(协和细胞资源中心,北京)在含有10%胎牛血清(Invitrogen公司)细胞培养液中及恒温培养箱中传代培养。
1.2 H2和VPA处理缺氧小胶质细胞
将BV2细胞分成4组:对照(sham)组、缺氧(O2-)组、缺氧+VPA(O2-/VPA+)组、缺氧+H2(O2-/H2+)组。向O2-/VPA+组加入VPA(Sigma⁃Aldrich公司),使培养基内终浓度达到0.3 mmol/L,迅速和O2-组一起放入密闭小室(外部水浴,使内部恒温37℃)A中,将O2-/H2+组放入密闭小室B中,两小室同时接入湿润的缺氧气体(0.5%O2、10%CO2、89.5%N2),流速:10 L/min,10 min后改为2 L/min,2 h后,取出O2-组和O2-/VPA+组,进行表型标志物检测;同时切断小室B缺氧气体连接,同时通入H2混合气(2% H2、0.5%O2、10%CO2、87.5%N2),1 h后取出培养瓶,进行如下操作。
1.3 ELISA测定
留取各组细胞上清,使用R&D、DaKeWe公司ELISA试剂盒检测M1型表型标志物肿瘤坏死因子(tu⁃mor necrosis factor,TNF)α和M2型表型标志物白细胞介素(interleukin,IL)10,方法遵试剂盒说明书。使用TECAN F200PRO酶标仪检测。
1.4 流式荧光抗体标记
收集细胞团,应用BD FACSCalibur型流式细胞仪(BD Biosciences公司)进行流式荧光蛋白检测。检测抗体:M1型为CD16/32(eBioscience公司),诱导型一氧化氮合酶(inducible nitric oxide synthase,iN⁃OS)(eBioscience公司);M2型为CD206(AbD serotec公司)。
1.5 实时荧光定量PCR检测
将上述得到的收集细胞团,分别用RNeasy Mini试剂盒(Qiagen公司)和High⁃Capacity cDNA Reverse Transcription试剂盒(Applied Biosystems公司)提取总RNA和反转录得到的cDNA(具体用法遵各试剂盒说明),加入荧光定量PCR试剂SYBR Green Master Mix(Roche公司)、上下游引物,引物序列:CD16Forward:5’⁃CATCAGCTCCTGTCTGGTT T⁃3’,Reverse:5’⁃CTCTCTGCAGCCTGTGTATTT⁃3’;CD32Forward:5’⁃AATCCTGCCGTTCCTACTC⁃3’,Reverse:5’⁃GTGTCACCGTGTCTTCCTTGAG⁃3’;CD206Forward:5’⁃GTGGTCCTCCTGATTGTGATA G⁃3’,Reverse:5’⁃CACTTGTTCCTGGACTCAGATT A⁃3’;iNOSForward:5’⁃GAACGGAGAACGTTGGA TTTG⁃3’,Reverse:5’⁃TCAGGTCACTTTGGTAGGA TTT⁃3’;TGF⁃βForward:5’⁃GGGAAATTGAGGGCT TTCG⁃3’,Reverse:5’⁃GAACCCGTTGATGTCCACTT G⁃3’;以GAPDHForward:5’⁃CCTGGAGAAACCTGC CAAGTAT⁃3’,Reverse:5’⁃CTCGGCCGCCTGCTT⁃3’作为内参基因(Realtimeprimer公司)。应用Roche Light Cycler480进行实时PCR检测。运用2-ΔΔCt法得出相对mRNA含量。
1.6 统计学分析
应用Microsoft EXCEL 2007软件录入数据,两两比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 缺氧对BV2细胞表型转化的作用
与sham组相比,缺氧增加BV2细胞M1型表型标志物iNOSmRNA的表达(P<0.001),降低M2型表型标志物CD206mRNA(P<0.05)和TGF⁃β mRNA的表达(P<0.01),使CD16和CD206mRNA的比值(P<0.05)、iNOS和CD206mRNA的比值(P<0.01)、iNOS和TGF⁃βmRNA的比值(P<0.001)均增加,见表1、2、3。
2.2 VPA对缺氧BV2表型的作用
与O2-组相比,VPA降低M1型表型标志物CD16/32蛋白(P<0.05)和iNOSmRNA的表达(P<0.05),使CD16和CD206mRNA的比值(P<0.05)、CD32和CD206mRNA的比值(P<0.05)、iNOS和CD206mRNA的比值(P<0.05)、iNOS和TGF⁃β mRNA的比值(P<0.001)均下降,见表1、3。
2.3 H2对缺氧BV2表型的作用
与O2-组相比,H2降低M1型表型标志物TNF⁃α的分泌(P<0.05)、CD16/32蛋白(P<0.01)、iNOS蛋白(P<0.01)和iNOSmRNA的表达(P<0.01),升高M2型表型标志物IL⁃10的分泌(P<0.01)、CD206mRNA(P<0.05)和TGF⁃βmRNA的表达(P<0.01),使CD16和CD206mRNA的比值(P<0.05)、iNOS和CD206mRNA的比值(P<0.01)、iNOS和TGF⁃β mRNA的比值(P<0.001)均下降,见表1、2、3。
表1 VPA和H2对缺氧小胶质细胞BV2 M1型表型标志物的影响Tab.1The effect of VPA and H2on M1 markers of hypoxia⁃treated BV2

表1 VPA和H2对缺氧小胶质细胞BV2 M1型表型标志物的影响Tab.1The effect of VPA and H2on M1 markers of hypoxia⁃treated BV2
1)P<0.05 vs sham group;2)P<0.05 vs O2-group.
ItemTNF⁃α(pg/mL)CD16/32(%)iNOS(%)iNOSmRNA Sham517.10±44.3049.60±0.2681.50±3.11-O2-499.45±47.0344.62±0.8674.30±1.051.52±0.141)O2-/VPA+297.99±115.6842.20±1.362)76.90±17.451.04±0.092)O2-/H2+338.99±16.0038.18±0.292)46.20±2.722)1.18±0.042)
表2 VPA和H2对缺氧小胶质细胞BV2 M2型表型标志物的影响Tab.2The effect of VPA and H2on M2 markers of hypoxia⁃treated BV2
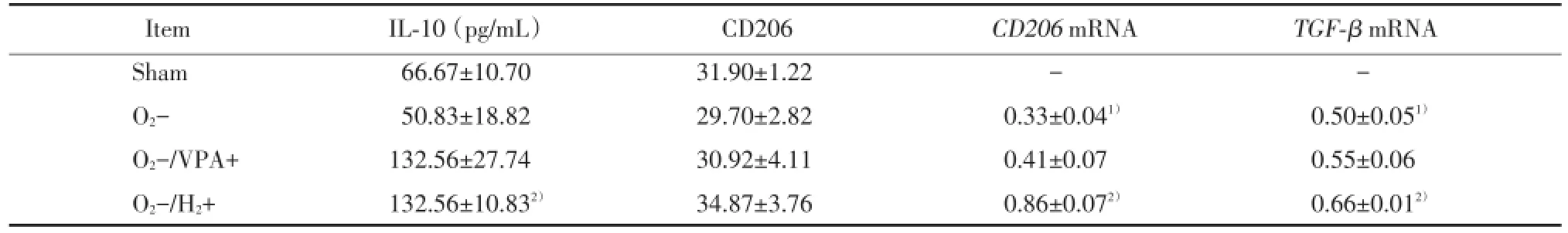
表2 VPA和H2对缺氧小胶质细胞BV2 M2型表型标志物的影响Tab.2The effect of VPA and H2on M2 markers of hypoxia⁃treated BV2
1)P<0.05 vs sham group;2)P<0.05 vs O2-group.
ItemIL⁃10(pg/mL)CD206CD206mRNATGF⁃βmRNA Sham66.67±10.7031.90±1.22--O2-50.83±18.8229.70±2.820.33±0.041)0.50±0.051)O2-/VPA+132.56±27.7430.92±4.110.41±0.070.55±0.06 O2-/H2+132.56±10.832)34.87±3.760.86±0.072)0.66±0.012)
表3 VPA和H2对缺氧小胶质细胞BV2表型标志物M1型和M2型表型标志物mRNA比值的影响Tab.3The effect of VPA and H2on the ratio of relative mRNA level between M1 markers and M2 markers in hypoxia⁃treated BV2n=3)

表3 VPA和H2对缺氧小胶质细胞BV2表型标志物M1型和M2型表型标志物mRNA比值的影响Tab.3The effect of VPA and H2on the ratio of relative mRNA level between M1 markers and M2 markers in hypoxia⁃treated BV2n=3)
1)P<0.05 vs sham group;2)P<0.05 vs O2-group.
ItemCD16∶CD206CD32∶CD206iNOS∶CD206iNOS∶TGF⁃β Sham1 275.12±252.913 007.36±825.51431.85±90.430.63±0.02 O2-1 853.15±209.491)3 100.50±355.071 997.84±228.611)1.92±0.031)O2-/VPA+1 143.43±152.632)2 184.14±187.572)1 092.42±81.182)1.18±0.022)O2-/H2+998.28±262.082)2 408.51±688.31598.77±156.482)1.13±0.062)
3 讨论
本研究发现,缺氧增加小胶质细胞M1型表型标志物的表达,降低M2型表型标记物的表达,增加M1型和M2型表型标志物的比值,表明缺氧使小胶质细胞向促炎表型转化。有研究[8⁃10]也证实,给予小胶质细胞缺氧刺激可升高其促炎型细胞因子(TNF⁃α、IL⁃1β、IL⁃6、iNOS)的表达。然而,本研究未发现BV2细胞缺氧2 h M1型标志物TNF⁃α、IL⁃6和CD16/ 32蛋白增加以及M2型标志物IL⁃10的下降,类似现象在其他研究[9]中也有发现。原因可能是小胶质细胞的各种表型标志物的表达有其特有的时相性[11],而本研究选择的时间点可能无法显示出所有M1、M2表型标志物的变化规律。
缺氧刺激小胶质细胞时,一方面使缺氧诱导因子(hypoxia inducible factor,HIF)1α活化,间接通过NF⁃κB信号通路调节炎性细胞因子的转录;另一方面,缺氧可通过直接促进NF⁃κB向细胞核转导,诱导小胶质细胞炎性细胞因子TNF⁃α、IL⁃1β、iNOS表达;此外,NOTCH信号的活化也可能参与其中[9,12⁃14]。综上,缺氧可能通过上述信号通路诱导小胶质细胞向促炎表型转化。
本研究发现,VPA降低小胶质细胞M1型表型标记物的表达,降低M1型和M2型表型标志物的比值,表明VPA能够抑制缺氧小胶质细胞向促炎表型转化。在真核细胞中,组蛋白乙酰化是调控基因转录和表达的重要方式,由组蛋白乙酰转移酶(his⁃tone acetyltransferase,HAT)和组蛋白去乙酰化酶(histone deacetylase,HDAC)调控,二者在生理状态下维持机体的“乙酰化稳态”[15]。HAT可乙酰化组蛋白赖氨酸残基,使缠绕在组蛋白上的DNA松解,暴露基因序列,使得临近的转录因子更容易接近转录起始位点,促进基因的转录和蛋白的表达,反之HDAC抑制基因转录。而组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACI)可以阻止组蛋白去乙酰化,恢复“乙酰化稳态”,促进目的基因转录,影响包括免疫反应在内的众多细胞信号通路,有助于改善器官功能和动物的生存[15]。在TBI发生时,脑细胞核内的组蛋白(尤其是组蛋白H3)乙酰化水平降低,乙酰化稳态被打破,引发小胶质细胞的炎症反应[16⁃17]。VPA作为一种HDACI,既可上调组蛋白乙酰化水平,还可使细胞内某些非组蛋白乙酰化[18]。研究[19]显示,VPA可诱导NF⁃κB活化,减少缺氧诱导神经元凋亡;此外,VPA能够降低烧伤大鼠小肠黏膜的HIF⁃1α水平[20]。VPA一方面可能是通过促进组蛋白H3乙酰化,上调热休克蛋白70表达,增加Akt磷酸化,从而抑制小胶质细胞向促炎型分化[21],另一方面可能上调非组蛋白乙酰化水平,调节如NF⁃κB、JNK、HIF⁃1α等转录因子的活化,进而调控基因转录,降低炎性细胞因子表达。本研究中VPA可能是通过上述表观遗传学机制抑制缺氧小胶质细胞促炎表型的转化。
本研究发现,H2降低小胶质细胞M1型表型标志物的表达,升高M2型标志物的表达,降低M1型和M2型表型标志物的比值,表明H2可以抑制缺氧小胶质细胞向促炎表型转化。前期研究[22]表明H2能够降低百草枯刺激巨噬细胞TNF⁃α和IL⁃6蛋白水平。其他研究者发现H2可降低小肠移植后巨噬细胞M1型表型标志物TNF⁃α、IL⁃1β、IL⁃6的表达,并且可抑制LPS诱导的急性炎症和酵母聚糖引起的全身炎症反应综合征;在氧化应激或炎症反应条件下,iNOS高表达使一氧化氮生成增加,进一步形成过氧亚硝酸根阴离子(ONOO-),使脂质和DNA硝化,破坏细胞膜和DNA[23⁃24]。H2作为还原剂既可通过直接特异性清除缺血缺氧和炎症等产生的羟自由基和ONOO-,也可能通过间接降低ONOO-诱导产生的转录因子⁃O⁃NO2和⁃S⁃NO2,以及促进Nrf2向细胞核内转导等方式,促进抗氧化酶表达[25],从而通过抗氧化作用发挥抗炎作用,抑制缺氧小胶质细胞向促炎型转化。此外,吸入H2在缺血部位具有良好的组织弥散能力,且不影响生理氧化还原反应和脑缺血患者的各项生理指标水平[26],应用前景可观。本研究也为进一步探索H2抑制炎症反应的作用机制提供理论基础。
尽管本研究发现缺氧使小胶质细胞向促炎型转化,但并非所有的表型标志物均呈现该变化特点,需要设计更多的时间点检测表型标志物动态变化;既然VPA和H2分别具有抑制炎症表型的作用,应进一步将VPA和H2联合使用,研究二者是否具有协同作用。该研究结果需要体内实验进一步验证。有文献[19]表明,作为非选择性HDACI的VPA和选择性的HDACI对缺氧小胶质细胞可能均有作用,二者的比较研究可能进一步揭示HDACI对缺氧小胶质细胞的作用机制。
[1]MAAS AIR,STOCCHETTI N,BULLOCK R.Moderate and severe traumatic brain injury in adults[J].Lancet Neurol,2008,7(8): 728-741.DOI:10.1016/S1474⁃4422(08)70164⁃9.
[2]Brain Trauma Foundation,American Association of NeurologicalSur⁃geons(AANS),Congress of Neurological Surgeons(CNS),AANS/ CNS joint section on neurotrauma and critical care.Guidelines for the management of severe traumatic brain injury,3rd edition[J].J Neurotrauma,2007,25(3):276-278.DOI:10.1089/neu.2007. 9995.
[3]HWABEJIRE JO,JIN G,IMAM AM,et al.Pharmacologic modula⁃tion of cerebral metabolic derangement and excitotoxicity in a por⁃cine model of traumatic brain injury and hemorrhagic shock[J]. Surgery,2013,154(2):234-243.DOI:10.1016/j.surg.2013.04.008.
[4]ECKERMANN JM,CHEN WQ,JADHAV V,et al.Hydrogen is neu⁃roprotective against surgically induced brain injury[J].Medical Gas Research,2011,1(1):7.DOI:10.1186/2045⁃9912⁃1⁃7.
[5]LIU WW,CHEN OM,WU BH,et al.Protective effects of hydrogen on fetal brain injury during maternal hypoxia[J].Acta Neurochir Suppl,2011,111:307-311.DOI:10.1007/978⁃3⁃7091⁃0693⁃8_51.
[6]SICA A,MANTOVANI A.Macrophage plasticity and polarization: in vivo veritas[J].J Clin Invest,2012,122(3):787-795.DOI:10.1172/JCI59643.
[7]JUNG S,SCHWARTZ M.Non⁃identical twins⁃microglia and mono⁃cyte⁃derived macrophages in acute injury and autoimmune inflam⁃mation[J].Front Immunol,2012,3(89):1-4.DOI:10.3389/fim⁃mu.2012.00089.
[8]CHONG W,LI YQ,LIU BL,et al.Anti⁃inflammatory properties of histone deacetylase inhibitors:a mechanistic study[J].J Trauma,2011,72(2):347-354.DOI:10.1097/TA.0b013e318243d8b2.
[9]YAO LL,KAN EM,KAUR C,et al.Notch⁃1 signaling regulates mi⁃croglia activation via NF⁃κB pathway after hypoxic exposure in vivo and in vitro[J].PLoS One,2013,8(11):e78439.DOI:10.1371/jour⁃nal.pone.0078439.
[10]QIN X,SUN ZQ,ZHANG XW,et al.TLR4 signaling is involved in the protective effect of propofol in BV2 microglia against OGD/re⁃oxygenation[J].J Physiol Biochem,2013,69(4):707-718.DOI: 10.1007/s13105⁃013⁃0247⁃6.
[11]LOANE DJ,KUMAR A.Microglia in the TBI brain:the good,the bad,and the dysregulated[J].Exp Neurol,2016,275(Pt 3):316-327.DOI:10.1016/j.expneurol.2015.08.018.
[12]RIUS J,GUMA M,SCHACHTRUP C,et al.NF⁃κB links innate im⁃munity to the hypoxic response through transcriptional regulation of HIF⁃1α[J].Nature,2008,453(7196):807-811.DOI:10.1038/ nature06905.
[13]YANG Z,ZHAO TZ,ZOU TJ,et al.Hypoxia induces autophagic cell death through hypoxia⁃inducible factor 1a in microglia[J]. PLoS One,2014,9(5):e96509.DOI:10.1371/journal.pone.0096 509.
[14]CHESNUT RM,MARSHALL LF,KLAUBER MR,et al.The role of secondary brain injury in determining outcome from severe head injury[J].J Trauma,1993,34(2):216-222.
[15]HALAWEISH I,NIKOLIAN V,GEORGOFF P,et al.Creating a "pro⁃survival phenotype"through histone deacetylase inhibition: past,present,and future[J].Shock,2015,44(Suppl 1):6-16. DOI:10.1097/SHK.0000000000000319.
[16]WANG GH,JIANG XY,PU HJ,et al.Scriptaid,a novel histone deacetylase inhibitor,protects against traumatic brain injury via modulationof PTEN and AKT pathway[J].Neurotherapeutics,2013,10(1):124-142.DOI:10.1007/s13311⁃012⁃0157⁃2.
[17]ZHANG B,WEST EJ,VAN KC,et al.HDAC inhibitor increases histone H3 acetylation and reduces microglia inflammatory re⁃sponse following traumatic brain injury in rats[J].Brain Res,2008,1226(7):181191.DOI:10.1016/j.brainres.2008.05.085.
[18]KIM HJ,ROWE M,REN M,et al.Histone deacetylase inhibitors exhibit anti⁃Inflammatory and neuroprotective effects in a rat per⁃manent ischemic model of stroke:multiple mechanisms of action[J].J Pharmacol Exp Ther,2007,321(3):892-901.DOI:10.1124/ jpet.107.120188.
[19]LI Y,YUAN Z,LIU B,et al.Prevention of hypoxia⁃induced neuro⁃nal apoptosis through histone deacetylase inhibition[J].J Trauma,2008,64(4):863-870.DOI:10.1097/TA.0b013e318166b822.
[20]LUO HM,DU MH,LIN ZL,et al.Valproic acid treatment inhibits hypoxia⁃inducible factor 1alpha accumulation and protects against burn⁃induced gut barrier dysfunction in a rodent model[J].PLoS One,2013,8(10):e77523.DOI:10.1371/journal.pone.0077523.
[21]WANG GH,SHI YJ,JIANG XY,et al.HDAC inhibition prevents white matter injury by modulating microglia/macrophage polariza⁃tion through the GSK3β/PTEN/Akt axis[J].PNAS,2015,112(9): 2853-2858.DOI:10.1073/pnas.1501441112.
[22]LI J,WU X,CHEN Y,et al.The effects of molecular hydrogen and suberoylanilide hydroxamic acid on paraquat⁃induced production of reactive oxygen species and TNF⁃α in macrophages[J].Inflam⁃mation,2016,39(6):1990-1996.DOI:10.1007/s10753⁃016⁃0434⁃z.
[23]OHTA S.Molecular hydrogen as a preventive and therapeutic medi⁃cal gas:initiation,development and potential of hydrogen medicine[J].Pharmacol Ther,2014,144(1):1-11.DOI:10.1016/j.phar⁃mthera.2014.04.006.
[24]RADI R.Peroxynitrite,a stealthy biological oxidant[J].J Biol Chem,2013,288(37):26464-26472.DOI:10.1074/jbc.R113.472 936.
[25]OHSAWA I,ISHIKAWA M,TAKAHASHI K,et al.Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxy⁃gen radicals[J].Nat Med,2007,13(6):688-694.DOI:10.1038/ nm1577.
[26]ONO H,NISHIJIMA Y,ADACHI N,et al.A basic study on molec⁃ular hydrogen(H2)inhalation in acute cerebral ischemia patients for safety check with physiological parameters and measurement of blood H2level[J].Med Gas Res,2012,2(1):21.DOI:10.1186/ 2045⁃9912⁃2⁃21.
(编辑于溪)
Effects of Valproic Acid and Molecular Hydrogen on Phenotypes of Microglia Treated with Hypoxia
WU Xizi1,ZENG Renqing1,ZHAO Yangzi1,CHANG Panpan2,FAN Chenling3,WANG Hong3,CHONG Wei1
(1.Department of Emergency Medicine,The First Hospital,China Medical University,Shenyang 110001,China;2.Departmen of Neurosurgery,The First Hospital,China Medical University,Shenyang 110001,China;3.Departmen of Endocrinology and Metabolism,The First Hospital,China Medical University,Shenyang 110001,China)
ObjectiveTo investigate the effect of VPA and molecular hydrogen(H2)on phenotypes of microglia treated with hypoxia.Methods Mouse hypoxic BV2 microglia were treated with VPA or H2.The levels of phenotypic markers of supernatant and cells were detected by ELISA,flow cytometry and real⁃time PCR,respectively.ResultsHypoxia significantly increased mRNA level of M1 marker(iNOS)and reduced mRNA levels of M2 markers(CD206andTGF⁃β)in BV2(P<0.05).Besides,the ratio between the mRNA levels of M1 increased(P<0.05).VPA significantly reduced protein level(CD16/32)and mRNA production(iNOS)of M1 markers in hypoxia⁃treated BV2(P<0.05).The ratio be⁃tween the mRNA levels of M1 markers and M2 markers(CD16∶CD206,CD32∶CD206,iNOS∶CD206andiNOS∶TGF⁃β)were also significantly decreased(P<0.05).H2significantly reduced both protein levels(TNF⁃α,CD16/32 and iNOS)and mRNA production(iNOS)of M1 markers and increased secretion of M2 marker(IL⁃10)in hypoxia⁃treated BV2(P<0.05).The ratio between the mRNA levels of M1 markers and M2 markers(CD16∶CD206,iNOS∶CD206andiNOS∶TGF⁃β)were also highly declined(P<0.05).ConclusionHypoxia can induce microglial cells toward pro⁃inflammatory phenotype.Both VPA and H2can inhibit hypoxia⁃induced inflammatory effect on microglia.
hypoxia;microglia;hydrogen;valproic acid;macrophagic phenotypes
R641
A
0258-4646(2017)01-0036-05
10.12007/j.issn.0258⁃4646.2017.01.008
沈阳市科技计划(F15⁃139⁃9⁃24)
吴曦子(1991-),女,硕士研究生.
崇巍,E-mail:chongweixiena@126.com
2016-04-22
网络出版时间:

