甘草对高脂血症大鼠模型洛伐他汀药代动力学的影响
张瑛瑛,李季泓
(辽宁中医药大学附属医院药学部,沈阳110032)
甘草对高脂血症大鼠模型洛伐他汀药代动力学的影响
张瑛瑛,李季泓
(辽宁中医药大学附属医院药学部,沈阳110032)
目的研究高脂血症大鼠模型中甘草对洛伐他汀药代动力学过程的影响。方法将18只SD大鼠随机分为对照组(n=6)和实验组(n=12)。实验组采用高脂饲料喂养大鼠,构建高脂血症大鼠模型,随机分为洛伐他汀单独给药组(n=6)和洛伐他汀与甘草联合给药组(n=6)。联合给药组给予甘草颗粒,单独给药组给予相应体积的生理盐水,连续7 d后,2组大鼠单剂量灌胃给予洛伐他汀胶囊(20 mg/kg,0.5%CMC⁃Na溶液)。分别于给药前和给药后不同时间点采集血浆样品,采用液相色谱-质谱联用方法测定血药浓度,计算药代动力学参数,并进行组间比较。结果长期给予甘草导致洛伐他汀代谢产物洛伐他汀酸在高脂血症大鼠中血浆暴露水平显著升高,联合给药组平均Cmax较单独给药组升高约80%(P<0.05),而AUC0⁃t和AUC0⁃∞分别升高115%和109%(P=0.005和P=0.027)。联合给药组与单独给药组比较,洛伐他汀的Cmax和AUC增加,但无统计学差异(P> 0.05)。结论甘草可抑制洛伐他汀在高脂血症大鼠体内的代谢,增加其体内暴露水平。
洛伐他汀;洛伐他汀酸;甘草;药代动力学;高脂血症大鼠;药物相互作用
高脂血症是由于脂质代谢紊乱或转运异常使血清或血浆中一种或多种脂质的水平高于正常的疾病,它是动脉粥样硬化、冠心病、胰腺炎等疾病的重要发病因素[1]。他汀类药物是临床最常用的降脂药物,通过抑制羟甲基戊二酰辅酶A还原酶抑制肝细胞内的胆固醇合成及刺激干细胞合成低密度脂蛋白受体等途径来降低血脂[2⁃3]。他汀类药物的调脂疗效与药物剂量密切相关,其不良反应发生率也随着药物体内暴露水平的增加而呈几何倍数增加,可累及全身各个系统[4⁃5]。他汀类药物的代谢主要由肝脏药物代谢酶CYP3A介导,如辛伐他汀、洛伐他汀和阿托伐他汀主要通过CYP3A4/5代谢[6],容易发生由CYP450酶抑制或诱导而介导的药物相互作用,从而导致严重的药物不良反应。
甘草是一味常用的中药材,具有抗炎、解痉、抗氧化、抗病毒、保肝及抗癌等作用[7]。甘草在发挥治疗作用的同时,可能改变联合使用药物的体内代谢行为,导致疗效降低或引起严重的不良反应。MU等[8]的研究证实,甘草提取物可通过激活孕烷受体诱导CYP3A和CYP2C的表达,增加华法林的体内清除;BUDZINSKI等[9]报道甘草中黄酮类成分能够抑制CYP3A4活性;还有研究[10⁃11]报道甘草酸二铵可抑制包括CYP2C19、CYP2C9、CYP3A4等在内的肝脏药物代谢酶的活性,上调雷公藤甲素诱导的肝细胞毒性。本课题组的早期研究证实,甘草成分甘草酸二铵在大鼠体内可抑制辛伐他汀的代谢,增加其体内暴露水平,有加重不良反应的风险[12]。本研究在高脂血症大鼠模型中研究甘草对洛伐他汀药代动力学过程的影响,为他汀类药物的临床合理应用提供理论指导。
1 材料与方法
1.1 材料
1.1.1 药品与试剂:洛伐他汀、洛伐他汀酸和辛伐他汀(内标)(中国药品生物制品检定所);洛伐他汀胶囊(哈药集团制药总厂);甘草配方颗粒(江阴天江药业有限公司);色谱纯甲醇(美国Fisher公司);其他试剂均为市售分析纯。实验用水为Milli⁃Q超纯水;大鼠高脂饲料购自辽宁长生生物技术有限公司。
1.1.2 仪器:API 4000型三重四极杆串联质谱仪,配有电喷雾离子源及Analysis 1.4.2数据处理系统(加拿大Applied Biosystem公司);LC⁃20A液相色谱仪,包括二元输液泵及自动进样器(日本岛津公司);TurboVap LV全自动浓缩仪(美国Zymark公司);Milli⁃Q Gradient A10超纯水器(美国Millipore公司);LX全自动血液生化分析仪(美国Beckman公司);XS⁃225A电子分析天平(德国PRECISA公司)。
1.1.3 实验动物:清洁级健康SD大鼠,雄性,体质量(220±10.0)g,18只,购于辽宁长生生物技术有限公司,许可证号为SCXK(辽)2015⁃0001。
1.2 方法
1.2.1 动物模型的建立和分组:大鼠在标准温度(25±2)℃和湿度(50±10)%环境中适应1周后,随机分为对照组和实验组。对照组大鼠(n=6)给予普通饲料。实验组(n=12)大鼠给予高脂饲料(0.2%胆酸钠、1%胆固醇、10%猪油、10%蔗糖、10%蛋黄粉、68.8%基础饲料),并根据胆固醇和甘油三酯值随机分为洛伐他汀单独给药组(n=6)和洛伐他汀与甘草联合给药组(n=6)。联合给药组大鼠每天给予甘草颗粒(用生理盐水溶解,0.5 g/kg,每日1次),单独给药组大鼠每天给予相应体积的生理盐水,连续6 d。第6日晚大鼠禁食12 h后,于第7日早晨,联合给药组和单独给药组大鼠分别灌胃给予甘草颗粒和生理盐水后,单剂量灌胃给予洛伐他汀胶囊(20 mg/kg,0.5%CMC⁃Na溶液)。
1.2.2 血清生化指标测定:喂养4周后,大鼠眼眶静脉采血,测定甘油三酯、胆固醇、低密度脂蛋白和高密度脂蛋白水平。血清生化指标采用全血自动生化分析仪测得。
1.2.3 血浆样品采集:于洛伐他汀给药前和给药后0.5、1.0、1.5、2、3、4、5、6、8、10、12、24和36 h于眼眶静脉采血,4 000 r/min离心10 min分离血浆,-70℃保存待测。
1.2.4 血浆浓度测定:采用液相色谱—质谱联用方法测定大鼠血浆中洛伐他汀及其代谢产物洛伐他汀酸的浓度。使用Zorbax Elipse XDB C18色谱柱(4.6 mm×150 mm,5 μm,美国Agilent公司);流动相由甲醇和水(含10 mmol/L乙酸铵B)组成;流速为1.0 mL/min,梯度洗脱;柱温30℃;进样量为10 μL。采用电喷雾离子源,选择性反应监测,正离子方式检测;洛伐他汀、洛伐他汀酸和内标的定量分析离子对分别为m/z427.1m/z325.3,m/z421.4m/z319.2和m/z441.3m/z325.1。向100 μL大鼠血浆样品中加入10 μL内标溶液,涡旋混匀后加入环己烷—二氯甲烷(3∶1)1 mL,涡旋混匀,振荡10 min后,5 000 r/min离心5 min,取上清液,置另一干净玻璃试管中,50℃水浴空气流吹干,残渣用100 μL甲醇复溶后,12 000 r/min离心2 min,取上清10 μL进样分析。
1.3 统计学分析
2 结果
2.1 血清生化指标
造模4周后,与对照组大鼠相比,实验组大鼠血清胆固醇、甘油三酯和低密度脂蛋白含量均显著升高(P<0.01),而高密度脂蛋白水平降低(P<0.05),证明高脂血症大鼠模型造模成功。见表1。
2.2 实验组药代动力学比较

表1 血清生化测定结果(mmol/L)Tab.1 Serum biochemical results(mmol/L)
对实验组中单独给药组和联合给药组大鼠的药代动力学参数进行统计分析,结果显示,长期给予甘草颗粒导致洛伐他汀代谢产物洛伐他汀酸在高脂血症大鼠中血浆暴露水平显著升高,联合给药组平均Cmax较单独给药组升高约80%(P<0.05),而AUC0⁃t和AUC0⁃∞分别升高115%和109%(P=0.005和P=0.027)。联合给药组与单独给药组比较,洛伐他汀的Cmax和AUC也均有增加,但差异无统计学意义(P>0.05)。联合给药后甘草对洛伐他汀和洛伐他汀酸的消除半衰期和清除率均无显著影响。见表2。
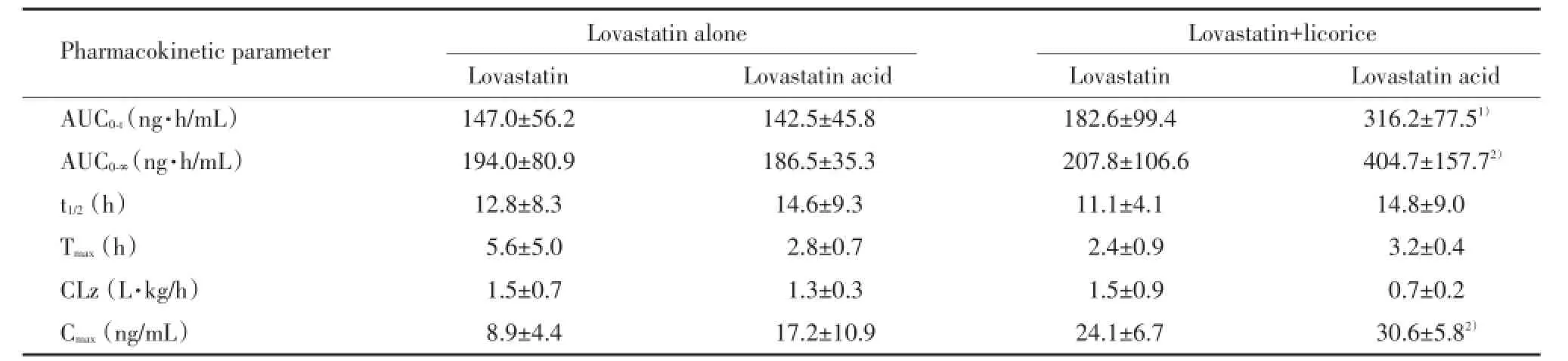
表2 高脂血症大鼠模型中洛伐他汀及其代谢产物洛伐他汀酸的药代动力学参数Tab.2 Pharmacokinetic parameters of lovastatin and its metabolite lovastatin acid in hyperlipidemia rats
3 讨论
近年来高脂血症的发生率呈逐年上升趋势,基于高脂血症所引发的一系列疾病的复杂性,在降脂治疗的同时多合并使用其他药物。随着中药使用量大大增加,寻找有效的治疗高脂血症的中西医结合疗法已成为当今研究心脑血管疾病的重要课题。现代研究证实甘草具有降脂、保肝等作用,其有效成分甘草酸二铵与他汀类药物联合对脂肪肝、高脂血症有很好的疗效[13]。
他汀类药物是高脂血症治疗的基础药物,肌肉毒性和肝毒性是该类药物的常见不良反应,而横纹肌溶解可能危及生命。他汀类药物引起的不良反应与剂量、药物相互作用、患者耐受性、基因多态性密切相关。其中药物相互作用是一项重要因素,一半以上的他汀类药物不良反应与药物相互作用有关。甘草含黄酮类、皂苷类、香豆素类等多种化学成分,其在发挥药效的同时,对肝脏药物代谢酶系统有一定作用,且不同成分对药物代谢酶的作用可能截然相反。由于甘草多作为饮片使用,因此本研究选择甘草颗粒,在高脂血症模型中研究其对洛伐他汀体内过程的影响。洛伐他汀是一种前体药物,在体内主要转化生成活性代谢产物洛伐他汀酸而发挥作用。本研究结果显示,甘草降低了洛伐他汀在高脂血症大鼠模型中的体内代谢,导致洛伐他汀酸的血浆暴露水平显著增加,而对洛伐他汀本身的体内暴露水平没有显著影响。大量研究[14]显示,CYP3A4/5以及转运体,尤其是有机阴离子转运多肽1B1和外排转运体乳腺癌抗性蛋白,在洛伐他汀及其活性代谢物的代谢过程中发挥重要作用。甘草降低洛伐他汀酸代谢水平的机制可能与其对大鼠CYP3A4酶活性的抑制有关。
综上所述,本研究显示甘草抑制了洛伐他汀在高脂血症大鼠模型体内的代谢过程,导致其主要活性代谢产物洛伐他汀酸的体内暴露水平显著增加。本研究结果提示,在临床上应避免洛伐他汀与甘草联合应用,若二者联合则应监测肌酸激酶、谷草转氨酶及谷丙转氨酶水平,根据监测结果及临床情况调整剂量,以减少或避免相互作用所带来的不良反应。
[1]WADHERA RK,STEEN DL,KHAN I,et al.A review of low⁃densi⁃ty lipoprotein cholesterol,treatment strategies,and its impact on car⁃diovascular disease morbidity and mortality[J].J Clin Lipidol,2016,10(3):472-489.DOI:10.1016/j.jacl.2015.11.010.
[2]IZQUIERDO⁃PALOMARES JM,FERNANDEZ⁃TABERA JM,PLA⁃NA MN,et al.Chronotherapy versus conventional statins therapy for the treatment of hyperlipidaemia[J].Cochrane Database Syst Rev,2016,26(11):9462.DOI:10.1002/14651858.CD009462.pub2.
[3]RAMKUMAR S,RAGHUNATH A,RAGHUNATH S.Statin thera⁃py:review of safety and potential side effects[J].Acta Cardiol Sin,2016,32(6):631-639.
[4]HEDENMALM K,GRANBERG AG,DAHL ML.Statin⁃induced muscle toxicity and susceptibility to malignant hyperthermia and other muscle diseases:a population⁃based case⁃control study includ⁃ing 1st and 2nd degree relatives[J].Eur J Clin Pharmacol,2015,71(1):117-124.DOI:10.1007/s00228⁃014⁃1776⁃9.
[5]BLAND CM,BOOKSTAVER PB,LU ZK,et al.Musculoskeletal safety outcomes of patients receiving daptomycin with HMG⁃CoA re⁃ductase inhibitors[J].Antimicrob Agents Chemother,2014,58(10):5726-5731.DOI:10.1128/AAC.02910⁃14.
[6]NEUVONEN PJ,BACKMAN JT,NIEMI M.Pharmacokinetic com⁃parison of the potential over⁃the⁃counter statins simvastatin,lovas⁃tatin,fluvastatin and pravastatin[J].Clin Pharmacokinet,2008,47(7):463-474.DOI:10.2165/00003088⁃200847070⁃00003.
[7]郝飞.甘草酸国外研究进展[J].中国药房,2001,12(8):500-501.
[8]MU Y,ZHANG JN,ZHANG SM,et al.Traditional Chinese medi⁃cines Wu Wei Zi(Schisandra chinensis Baill)and Gan Cao(Glyc⁃yrrhiza uralensis Fisch)activate pregnane X receptor and increase warfarin clearance in rats[J].J Pharmacol Exp Ther,2006,316(3):1369-1377.DOI:10.1124/jpet.105.094342.
[9]BUDZINSKI JW.An in vivo evaluation of human cytochrome P450 3A4 inhibition by selected commercial herbal extracts and tinctures[J].Phytomedicine,2000,7(4):273-282.DOI:10.1016/S0944⁃7113(00)80044⁃6.
[10]淡墨,闻镍,刘丽,等.甘草酸二铵通过上调CYP3A4拮抗雷公藤甲素诱导肝细胞毒性[J].中国新药杂志,2015,24(12):1349-1357.
[11]杨静,彭仁琇,孔锐,等.18α⁃甘草酸二铵对大鼠肝脏细胞色素P450和II相酶的影响[J].药学学报,2001,36(5):321-324. DOI:10.16438/j.0513⁃4870.2001.05.001.
[12]张瑛瑛,吴秀君.草酸二铵对辛伐他汀的药代动力学研究[J].中国临床药理学杂志,2015(24):2427-2429.
[13]李达斌.辛伐他汀联合甘草酸二铵治疗非酒精性脂肪肝55例[J].临床医药,2014,23(15):102-104.
[14]ZHAO G,LIU M,WU X,et al.Effect of polymorphisms in CYP3A4,PPARA,NR1I2,NFKB1,ABCG2 and SLCO1B1 on the pharmacokinetics of lovastatin in healthy Chinese volunteers[J]. Pharmacogenomics,2017,18(1):65-75.DOI:10.2217/pgs.16. 31.
(编辑 陈姜)
Effects of Licorice on Pharmacokinetics of Lovastatin in Hyperlipidemic Rats
ZHANG Yingying,LI Jihong
(Department of Pharmacy,Affiliated Hospital of Liaoning University of Traditional Chinese Medicine,Shenyang 110032,China)
ObjectiveTo study the effect of licorice on the pharmacokinetics of lovastatin in hyperlipidemic rat model.MethodsEighteen rats were randomly divided into control group(n=6)and test group(n=12).Rats in the test group were administered high fat diet to construct hy⁃perlipidemic rat model.The 12 hyperlipidemic rats were then randomly divided into two groups:lovastatin group(n=6)and lovastatin combined with licorice group(n=6).The rats in both groups were administered lovastatin capsule(20 mg/kg,0.5%CMC⁃Na solution)after receiving lico⁃rice(for lovastatin combined with licorice group)or saline(for lovastatin group)for 7 days.Blood samples were collected at different time points before and after the administration of lovastatin capsule.The plasma concentrations of lovastatin and lovastatin acid(an active metabolite of lovas⁃tatin)were determined by LC⁃MS/MS method.Pharmacokinetics parameters were calculated using DAS 2.0 software,and the two groups were com⁃pared using SPSS 18.0 software.ResultsLong⁃term administration of licorice resulted in a significant increase in the plasma level of lovastatin ac⁃id in the hyperlipidemic rat,and the corresponding mean Cmaxwas approximately 80%higher than that of the lovastatin group(P<0.05),while AUC0⁃tand AUC0⁃∞increased by 115%and 109%,respectively(P=0.005 andP=0.027).Cmaxand AUC of lovastatin also increased,but there was no statistical significance(P>0.05).ConclusionLicorice can inhibit the metabolism of lovastatin in hyperlipidemic rats and increase its expo⁃sure in vivo.
lovastatin;lovastatin acid;licorice;pharmacokinetics;hyperlipidemic rat;drug interaction
R977
A
0258-4646(2017)04-0342-04
10.12007/j.issn.0258⁃4646.2017.04.014
辽宁省自然科学基金(2014020051)
张瑛瑛(1970-),女,主管药师,本科. E-mail:2032059127@qq.com
2016-12-21
网络出版时间:

