少腹逐瘀汤对子宫内膜异位症模型大鼠在位内膜增殖、凋亡及血管生成的影响
陈雨诗,朱广辉,董建新,白素芬,杜晨光,曹颖
(1.华北理工大学,河北 唐山 063000; 2.华北理工大学 附属医院,河北 唐山 063000)
·论 著·
少腹逐瘀汤对子宫内膜异位症模型大鼠在位内膜增殖、凋亡及血管生成的影响
陈雨诗1,朱广辉1,董建新2,白素芬1,杜晨光1,曹颖1
(1.华北理工大学,河北 唐山 063000; 2.华北理工大学 附属医院,河北 唐山 063000)
目的:观察少腹逐瘀汤对子宫内膜异位症模型大鼠在位内膜增殖、凋亡及血管生成的影响,探讨少腹逐瘀汤治疗子宫内膜异位症的机制。方法:58只SD雌性大鼠中随机选择10只作为对照组,剩余大鼠采用自体移植法建立子宫内膜异位症大鼠模型,造模成功的38只大鼠随机分为模型组及治疗组,治疗组给予少腹逐瘀汤灌胃,给药4周。HE染色观察在位内膜组织形态及内膜厚度,免疫组化法检测PCNA表达,TUNEL法检测细胞凋亡,免疫荧光双标法检测CD34、SMA- α表达以评估微血管密度(MVD)及血管成熟指数(VMI)。结果:模型组在位内膜较对照组、治疗组明显增厚(P<0.05),在位内膜凋亡指数明显低于对照组及治疗组(P<0.01),MVD值明显高于对照组及治疗组(P<0.05),VMI值明显低于对照组及治疗组(P<0.01)。结论:少腹逐瘀汤可以通过诱导子宫内膜异位症模型大鼠在位内膜间质细胞凋亡来抑制在位内膜增殖,并能够抑制在位内膜血管生成,促进微血管成熟。
少腹逐瘀汤; 子宫内膜异位症; 细胞增殖; 细胞凋亡; 血管生成; 大鼠
子宫内膜异位症(endometriosis, EMT)是一种子宫内膜腺体和间质种植于子宫腔以外的雌激素依赖性疾病,在育龄期女性中的发病率为10%,在不孕症患者中的发病率高达25%~50%[1]。越来越多的证据表明,EMT患者的在位内膜与非EMT患者的子宫内膜在组织学及分子生物学特征上存在明显不同。这些功能异常的子宫内膜具有更强的腹腔种植潜能。也就是说,在位内膜的病变在EMT发病中起着至关重要的作用[2]。在对狒狒及啮齿类动物EMT模型的研究中发现,造模导致在位内膜在细胞侵袭、血管生成、细胞生长、免疫调节、性激素代谢等方面的蛋白表达异常,说明异位病灶影响了在位内膜的生物学特征。这可能与炎症反应干扰了性激素受体表达或子宫内膜细胞的表观遗传学特征有关[3]。另有研究证据表明,异位病灶细胞可以迁移至在位内膜[4]。以上研究表明,在位内膜功能异常与异位病灶形成之间互为因果,相互影响。
如果针对EMT的治疗药物可以纠正在位内膜的病理状态,将可能有助于EMT治疗。在EMT治疗中被广泛使用的促性腺激素释放激素激动剂(gonadotropin releasing hormone agonist, GnRHa )即被证实能够抑制在位内膜中的血管新生及细胞增殖,诱导在位内膜发生细胞凋亡[5- 6]。然而,GnRHa以降低人体雌激素水平为代价,随之而来的各种副作用限制了药物的长期应用。中医药疗法因治疗效果与达那唑或孕三烯酮类似,但不抑制排卵[7],副作用更少,能更好地改善全身症状[8],在EMT的治疗中被广泛使用。以活血化瘀、温经止痛立法的经典名方少腹逐瘀汤是治疗寒凝血瘀型EMT的常用方剂。少腹逐瘀汤对EMT的治疗是否与纠正在位内膜病理状态有关呢?本研究从在位内膜的细胞增殖、凋亡及血管生成入手,初步揭示少腹逐瘀汤对EMT的治疗作用及其机制,旨在为其在EMT治疗中的应用提供新证据、新思路。
1 材料与方法
1.1 动物
SPF级SD大鼠60只,雌性,体质量(200±20) g,购自军事医学科学院实验动物中心,动物合格证号:SCXK- (军)2014- 0001。
1.2 药物
少腹逐瘀汤:根据王清任《医林改错》原方所载的药味及配方比例,处方:当归9 g,生蒲黄9 g,五灵脂6 g,赤芍6 g,小茴香3 g,醋延胡索3 g,没药3 g,川芎3 g,肉桂3 g,炮姜0.6 g。以上药物均购于北京同仁堂唐山连锁药店有限公司。药物制备采用传统煎煮方法,除肉桂外其他药物加水300 ml 先浸泡1 h,煮沸,文火煎煮60 min,肉桂后下,煎煮20 min;滤出药液,浓缩至1 g·ml-1。
1.3 主要试剂及仪器
一抗PCNA小鼠单克隆抗体(批号610664,美国BD公司),一抗CD34兔单克隆抗体(ab81289,美国Abcam公司),一抗SMA- α小鼠单克隆抗体(ab7817,美国Abcam公司),二步法免疫组化检测系统(PV- 900,北京中杉金桥生物技术有限公司),荧光二抗Alexa Fluor 488标记的山羊抗兔IgG(ab150077,美国Abcam公司),荧光二抗Alexa Fluor 594标记的山羊抗小鼠IgG(ab150116,美国Abcam公司),Apop Tag过氧化物酶标记的原位细胞凋亡检测系统(S7100,美国Chemicon公司),DAB(0031,福州迈新生物技术开发有限公司),显微镜(奥林巴斯BX53)。
1.4 方法
1.4.1 动物造模
60只大鼠常规适应性喂养1周后每日定时作阴道涂片检查,选择动情周期4~5 d,并连续有两个正常动情周期的大鼠共计58只。随机选取10只作为对照组,正常饲养。剩余48只大鼠在动情期造模[9- 10],造模前24 h给予戊酸雌二醇0.2 mg·只-1灌胃,造模时以2%戊巴比妥钠按40 mg·kg-1对大鼠进行麻醉。在无菌条件下选取尿道口上端约1 cm处为切入点,沿腹中线切开1.5~2.0 cm的纵形切口,进入腹腔后分离并结扎右侧子宫,取中间段约1.5 cm,纵形剪开宫腔,切取5 mm×5 mm大小的子宫组织,生理盐水冲洗后将子宫组织以内膜面贴向左侧腹膜血管丰富处,用5- 0非吸收性缝合线缝合子宫组织四角,关腹。术后连续3 d给予腹腔注射青霉素钠,术后第10天起灌胃戊酸雌二醇0.02 mg·只-1,连续5 d。造模后第4周陆续选择动情期大鼠剖腹检查,见移植的子宫内膜体积增大,呈透明的结节状或囊状,内有液体积聚,表面有结缔组织覆盖及血管形成,为造模成功。
1.4.2 动物分组及干预
经剖腹检查证实造模成功的大鼠共计38只,随机分为模型组及治疗组,每组19只。治疗组给药量按人体正常给药量46.6 g·d-1,根据大鼠体表面积换算为大鼠给药量,模型组及对照组灌胃等体积生理盐水,每周根据大鼠体质量变化调整灌胃量,连续灌胃4周。药物干预期间模型组有1只大鼠死于灌胃意外,治疗组有1只大鼠因咬伤死亡。
1.4.3 指标检测
1.4.3.1 大鼠子宫组织形态学观察 将大鼠子宫及异位内膜组织用10%甲醛溶液固定48 h,经梯度脱水、透明、浸蜡、包埋、切片,常规HE染色,光学显微镜下观察。
1.4.3.2 免疫组化法检测增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)表达 二甲苯和梯度酒精对组织切片进行脱蜡、水化,0.3%的H2O2室温孵育10 min去除过氧化物酶,山羊血清37 ℃封闭30 min,一抗稀释浓度为1∶50,4 ℃孵育过夜。二抗孵育参照试剂说明书进行操作。DAB显色,苏木素复染、脱水、透明、中性树胶封片。每张切片在400倍镜下随机选择5个视野进行拍照,采用ImageProPlus6.0软件分析细胞增殖指数,增殖指数(‰)=增殖细胞数/总细胞数×1000。
1.4.3.3 末端转移酶介导的缺口末端标记法(terminaldeoxynucleotidyltransferase-mediateddUTPnickendlabeling,TUNEL)检测细胞凋亡 严格按照试剂盒说明书进行操作,每张切片在400倍镜下随机选择5个视野进行拍照,采用ImageProPlus6.0软件分析细胞凋亡指数,凋亡指数(%)=凋亡细胞数/总细胞数×100。
1.4.3.4 免疫荧光双标法检测CD34、平滑肌肌动蛋白α(α-smoothmuscleactin,SMA-α)蛋白表达 二甲苯和梯度酒精对组织切片进行脱蜡、水化,山羊血清37 ℃封闭30min,一抗稀释浓度为1∶200,4 ℃孵育过夜。二抗孵育参照试剂说明书进行操作,DAPI染核,每张切片在200倍镜下随机选择3个视野进行拍照,采用ImageProPlus6.0软件分析微血管密度(microvesseldensity,MVD)、SMA-α阳性MVD及血管成熟指数(vascularmaturityindex,VMI)。MVD=CD34阳性血管计数/视野面积,VMI(%)=SMA-α阳性MVD/MVD×100。
1.5 统计学处理
采用SPSS22.0进行统计学分析。实验数据以均数±标准差进行描述;符合正态分布的多组数据比较,采用单因素方差分析one-wayANOVA;不符合正态分布的多组数据比较,采用Kruskal-WallisH检验。P<0.05为差异有统计学意义。
2 结 果
2.1 少腹逐瘀汤对在位内膜组织形态学及内膜厚度的影响
病理结果显示,对照组子宫内膜规整,间质内腺体完整、排列整齐,间质细胞疏松排列整齐;模型组子宫内膜增厚,间质内腺体管腔不规则,部分管腔消失,间质细胞致密,炎症细胞增多;治疗组间质内腺体管腔完整,形态较规则,间质细胞排列整齐,但较对照组更为密集,可见少量炎症细胞。各组大鼠子宫内膜组织图片见图1。对照组大鼠在位内膜厚度为(475.00±29.43) μm,模型组在位内膜明显增厚达(523.60±33.32) μm,差异有统计学意义(P<0.05);治疗组大鼠在位内膜为(458.25±19.43) μm,与模型组比较差异有统计学意义(P<0.01);治疗组与对照组在位内膜厚度比较,差异无统计学意义(P>0.05)。
2.2 少腹逐瘀汤对在位内膜细胞增殖、凋亡的影响
3组大鼠在位子宫内膜腺上皮及间质细胞中PCNA表达均较低,各组间细胞增殖指数比较差异无统计学意义(P>0.05)。在位内膜间质细胞凋亡较腺上皮明显,其中对照组及治疗组内膜间质细胞凋亡指数高于模型组,差异有统计学意义(P<0.01),对照组与治疗组比较差异无统计学意义(P>0.05);3组大鼠在位内膜腺上皮细胞凋亡指数比较差异无统计学意义(P>0.05)。见图2、表1。
2.3 少腹逐瘀汤对在位内膜血管生成的影响
模型组MVD值高于对照组,差异有统计学意义(P<0.05),治疗组MVD值低于模型组及对照组,差异有统计学意义(P<0.01)。治疗组SMA- α阳性MVD低于对照组(P<0.01)。模型组VMI值显著低于对照组及治疗组,差异有统计学意义(P<0.01)。见图3、表2。
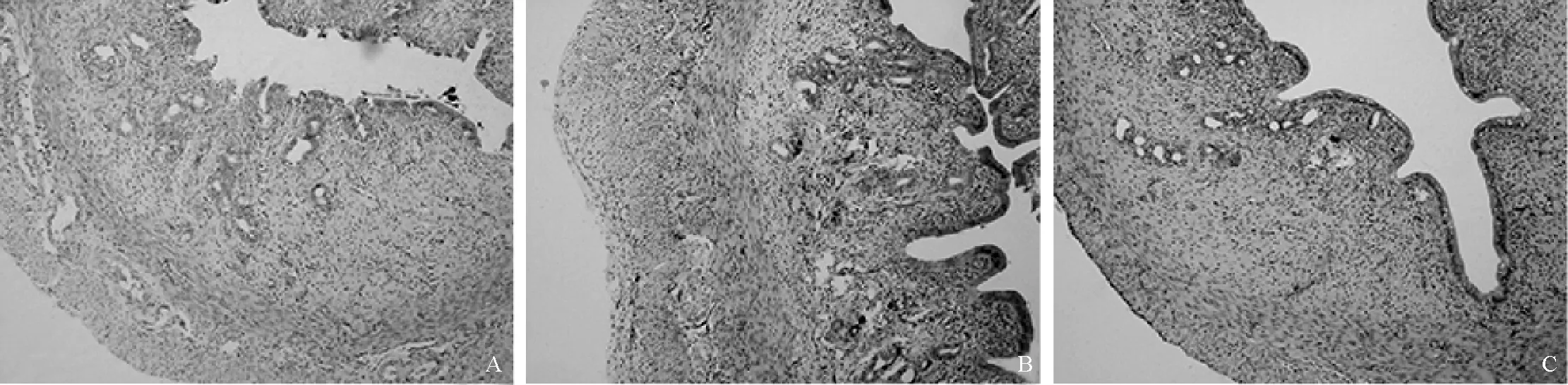
A.对照组;B.模型组;C.治疗组
图1 各组大鼠子宫内膜 HE染色×100
Fig 1 HE staining of endometrium of different groups of rats ×100
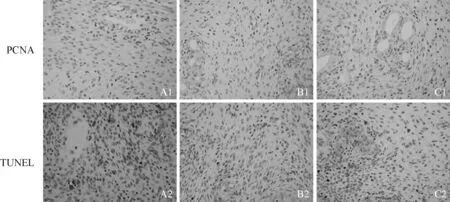
A1- 2.对照组;B1- 2.模型组;C1- 3.治疗组
图2 各组大鼠子宫内膜PCNA、TUNEL表达 ×400
Fig 2 Expressions of PCNA and TUNEL in endometrium of different groups of rats ×400
表1 各组大鼠在位内膜细胞增殖指数及凋亡指数比较
Tab 1 Comparisons of proliferative and apoptotic index in endometrium of different groups of rats
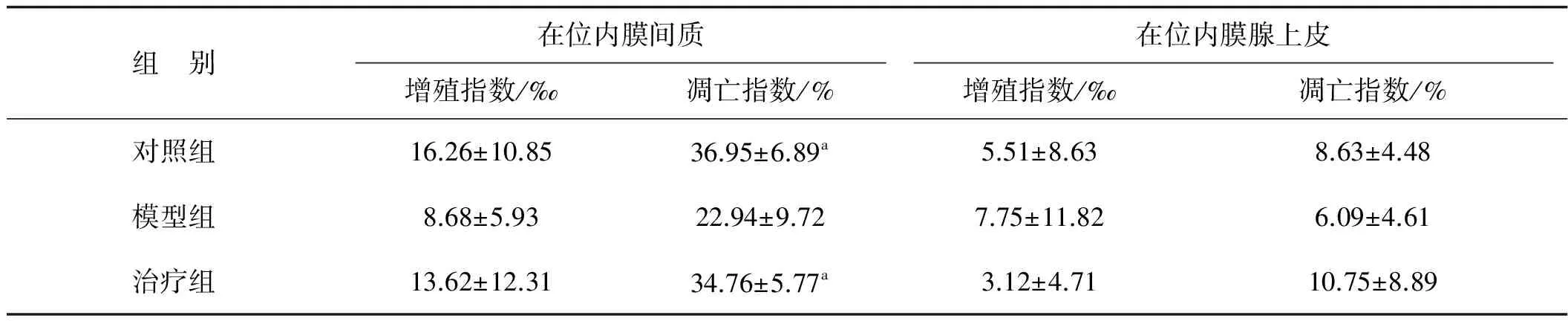
组 别在位内膜间质在位内膜腺上皮增殖指数/‰凋亡指数/%增殖指数/‰凋亡指数/%对照组16.26±10.8536.95±6.89a5.51±8.638.63±4.48模型组8.68±5.9322.94±9.727.75±11.826.09±4.61治疗组13.62±12.3134.76±5.77a3.12±4.7110.75±8.89
a 与模型组比较,P<0.01
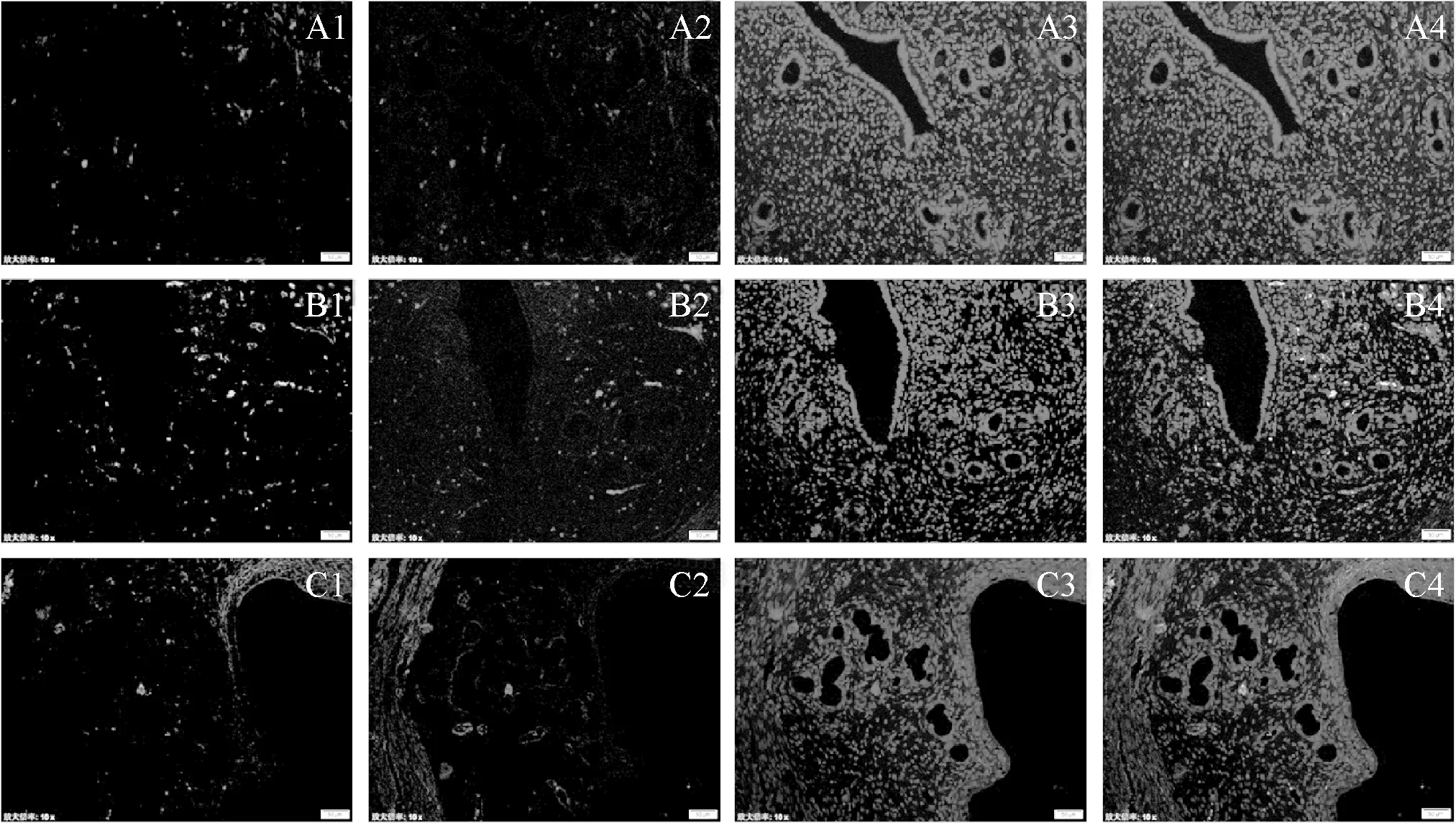
A1- 4.对照组;B1- 4.模型组;C1- 4.治疗组;绿色为CD34标记的微血管,红色为SMA- α标记的微血管,蓝色为DAPI标记的细胞核
图3 各组大鼠子宫内膜CD34、SMA- α免疫荧光染色 ×200
Fig 3 Expressions of CD34 and SMA- α in endometrium of different groups of rats ×200
表2 各组大鼠在位内膜MVD、SMA- α阳性血管密度、VMI水平的比较
Tab 2 Comparisons of MVD, SMA- α positive MVD and VMI in endometrium of different groups of rats

组 别MVD/个·mm-2SMA⁃α阳性血管密度/个·mm-2VMI水平/%对照组91.78±5.50a88.92±11.6296.67±9.43b模型组127.01±29.9273.49±21.4457.78±10.32治疗组70.17±12.91bc65.72±10.95c95.08±13.93b
与模型组比较, aP<0.05,bP<0.01; c 与对照组比较,P<0.01
3 讨 论
在EMT的诸多发病学说中,Sampson的经血逆流理论居于主导地位。近年来,在位内膜异常在EMT发病中的作用日益受到重视。郎景和院士提出的“在位内膜决定论”正是基于对EMT患者在位内膜研究的成果所提出的病因假说。本研究发现,在动情期EMT模型大鼠子宫内膜的厚度大于对照组,而治疗组子宫内膜厚度小于模型组,与对照组比较无统计学差异,说明EMT造模改变了子宫内膜微环境,促进了在位内膜增殖。余燚薇等[11]比较EMT患者与非EMT患者增殖期、分泌期在位内膜厚度发现,EMT患者在位内膜明显增厚;在EMT保守治疗后3年随访期间,42.11%的复发患者于复发前出现在位内膜增厚;据此认为EMT患者在位内膜厚度与疾病发生、复发密切相关,本研究结论与之一致。
大鼠子宫内膜厚度的变化与内膜细胞的增殖、凋亡直接相关。本研究中以PCNA作为检测细胞增殖的标志。PCNA主要表达于细胞周期的S期,位于细胞核内,是DNA聚合酶δ的辅助蛋白,为DNA复制所必需,可作为研究细胞增殖的有效标志。本研究显示,各组大鼠在位内膜增殖均不明显,组间比较差异无统计学意义,这是由于大鼠的动情期与女性月经周期中的黄体期类似。在动情期,大鼠子宫内膜的增殖被抑制,核分裂及PCNA指数水平均处于动情周期中的最低值[12]。因此,由于取材时间的局限,研究数据并不能全面反映细胞增殖对在位内膜厚度的影响。研究中选用TUNEL方法监测细胞凋亡,结果显示模型组在位内膜间质细胞的凋亡指数明显低于对照组及治疗组,说明模型组大鼠在位内膜增厚可能与间质细胞抗凋亡能力增强有关,而少腹逐瘀汤能够诱导在位内膜间质细胞凋亡。对EMT患者经血及分泌晚期、月经期子宫内膜标本的研究均显示,在位内膜凋亡指数显著高于正常子宫内膜。这一变化使得逆流经血中的子宫内膜碎片中具有更多的活细胞,由于这些细胞中抗凋亡因子B淋巴细胞瘤- 2(B- cell lymphoma- 2, bcl- 2)表达上调,促凋亡因子bcl- 2相关X蛋白(bcl- 2 assaciated X protein, bax)表达下调,细胞对各种凋亡信号的敏感性下降,其发生异位种植的几率自然更大[13]。而少腹逐瘀汤能够诱导子宫内膜间质细胞凋亡,使其恢复到正常水平,是否意味着少腹逐瘀汤能通过诱导凋亡起到预防EMT复发的治疗作用呢?这一推论需要我们进一步设计实验加以证实。
血管生成是维持子宫内膜异位种植生长的必要条件,因此抗血管生成被认为是EMT治疗药物的研究方向之一,多项动物实验结果也显示出抗血管生成药物对于EMT具有良好的疗效。EMT患者皆为育龄期女性,生理性血管生成是女性生殖功能正常及胚胎发育的先决条件,抗血管生成治疗对女性生殖功能的影响是药物评价中需要解决的问题。促进血管生成的因素众多,如血管内皮生长因子(vascular endothelial growth factor, VEGF)、血管生成素(angiogenin, Ang)、血小板源性生长因子(platelet derived growth factor, PDGF),甚至多种炎症细胞因子也能诱导血管生成[14]。中药复方往往通过多层次、多靶点调节发挥抗血管生成作用,因此本研究选择MVD作为评价血管生成的指标,组织中MVD值越高说明毛细血管越丰富,MVD可以直接反映出药物抗血管生成的疗效。EMT患者在位内膜血管新生活跃,表现为VEGF高表达,MVD值明显高于正常子宫内膜[3]。血管生成异常活跃的子宫内膜,其对胚胎的接受能力反而更差[15],子宫内膜容受性差正是出现EMT不孕的原因之一[16]。综上所述,纠正在位内膜异常的血管生成状态将有益于EMT的治疗。本研究结果显示:模型组在位内膜MVD值明显高于对照组,与以往研究结论[3]一致;少腹逐瘀汤可以抑制在位内膜血管生成。但出人意料的是,治疗组的MVD值明显低于对照组,这一现象是否会影响胚胎着床及发育还需深入研究。周细胞与血管内皮细胞共同构成毛细血管,在维持血管稳定性中发挥着重要作用。新生血管中周细胞覆盖率偏低是导致血管生成活跃的原因之一[17]。SMA- α是周细胞的主要标志蛋白之一,VMI即微血管的周细胞覆盖率,是反映微血管成熟度的指标。本研究结果显示,模型组在位内膜的周细胞覆盖率明显低于对照组及治疗组。说明异位病灶在促进在位内膜血管生成的同时,还造成了新生血管结构不稳定。这种血管通透性高,更有利于炎症细胞浸润[17]。少腹逐瘀汤能够调控周细胞的生物学行为,促进新生血管成熟,具体机制有待进一步研究。
少腹逐瘀汤作为治疗寒凝血瘀型痛经的代表方剂,被诸多中医妇科名家如季金玲、王大增等作为治疗EMT的主方[18- 19]。已有研究表明,少腹逐瘀汤可以改善寒凝血瘀型EMT 大鼠血液流变学指标,降低血清中E2水平[20],抑制异位病灶中血管新生及异位内膜细胞侵袭[21- 22]。本研究结果表明,少腹逐瘀汤能够从诱导细胞凋亡、抑制血管新生、促进新生血管成熟3个方面改善EMT大鼠在位内膜的病理状态,提示其可能具有提高EMT大鼠子宫内膜容受性或降低EMT保守术后复发率的治疗作用,为少腹逐瘀汤在EMT治疗中的临床应用提供思路。
[1] MEULEMAN C,VANDENABEELE B,FIEUWS S,et al.High prevalence of endometriosis in infertile women with normal ovulation and normospermic partners[J].Fertil Steril,2009,92(1):68- 74.
[2] MAY K E,VILLAR J,KIRTLEY S,et al.Endometrial alterations in endometriosis:a systematic review of putative biomarkers[J].Hum Reprod Update,2011,17(5):637- 653.
[3] BROSENS I,BROSENS J J,BENAGIANO G.The eutopic endometrium in endometriosis:are the changes of clinical significance[J].Reprod Biomed Online,2012,24(5):496- 502.
[4] SANTAMARIA X,MASSASA E E,TAYLOR H S.Migration of cells from experimental endometriosis to the uterine endometrium[J].Endocrinology,2012,153(11):5566- 5574.
[5] KHALEQUE N K,MICHIO K,KOICHI H,et al.Changes in tissue inflammation,angiogenesis and apoptosis in endometriosis,adenomyosis and uterine myoma after GnRH agonist therapy[J].Hum Reprod,2010,25(3):642- 653.
[6] HUANG F,WANG H,ZOU Y,et al.Effect of GnRH- Ⅱ on the ESC proliferation,apoptosis and VEGF secretion in patients with endometriosis in vitro[J].Int J Clin Exp Pathol,2013,6(11):2487- 2496.
[7] 陈彦辛,曹立幸.子宫内膜异位症不孕的中医药研究现状与展望[J].中国中西医结合杂志,2012,32(11):1580- 1584.
[8] FLOWER A,LIU J P,LEWITH G,et al.Chinese herbal medicine for endometriosis[J].Cochrane Database Syst Rev,2012,16(5):CD006568.
[9] 郭铭川.SD大鼠子宫内膜异位症模型的建立和评价[D].成都:四川大学,2007.
[10] 楚博,江涛,唐春萍,等.正交试验优化大鼠子宫内膜异位症模型[J].中国药理学通报,2009,25(7):973- 975.
[11] 余燚薇,孙伟伟,赵双俏,等.在位内膜厚度与子宫内膜异位症相关性初探[J].中国医刊,2014,49(8):87- 88.
[12] 孙爱军,朱蓬弟,王介东,等.大鼠正常周期子宫内膜核分裂率与增殖细胞核抗原[J].生殖医学杂志,1999,8(2):103- 105.
[13] AGIC A,DJALALI S,DIEDRICHE K,et al.Apoptosis in endometriosis[J].Gynecol Obstet Invest,2009,68(4):217- 223.
[14] DJOKVIC D,CALHAZ- JORGE C.Angiogenesis as a therapeutic target in endometriosis[J].Acta Med Port,2014,27(4):489- 497.
[15] GONG X,YU Y,TONG Q,et al.Effects of “Bu Shen Huo Xue Decoction” on the endometrial morphology and expression of leukaemia inhibitory factor in the rat uterus during the oestrous cycle[J].Evid Based Complement Alternat Med,2013,doi:10.1155/2013/496036.
[16] MACER M L,TAYLOR H S.Endometriosis and infertility:a review of the pathogenesis and treatment of endometriosis- associated infertility[J].Obstet Gynecol Clin North Am,2012,39(4):535- 549.
[17] KELLY- GOSS M R,SWEAT R S,STAPOR P C,et al.Targeting pericytes for angiogenic therapies[J].Microcirculation,2014,21(4):345- 357.
[18] 王兰芬,金季玲.金季玲治疗子宫内膜异位症经验[J].湖南中医杂志,2016,32(1):26- 27.
[19] 汤倩珏,王珍贞,吴胜男.王大增教授治疗子宫内膜异位症术后病证[J].吉林中医药,2014,34(4):358- 360.
[20] 吴修红,杨恩龙,杨新鸣,等.少腹逐瘀汤对寒凝血瘀型子宫内膜异位症大鼠激素及其受体的影响[J].中药材,2015,38(6):1251- 1253.
[21] 刘姣,贺克,李清.少腹逐瘀丸对子宫内膜异位症大鼠TNF- α和VEGF mRNA表达的影响[J].北京中医药大学学报,2012,35(6):391- 393.
[22] 刘姣,贺克,李清.少腹逐瘀丸对子宫内膜异位症大鼠MMP- 9和TIMP- 1 mRNA表达的影响[J].中成药,2012,34(4):610- 613.
(本文编辑:周兰波)
Effects of Shao Fu Zhu Yu Decoction on proliferation, apoptosis and angiogenesis in eutopic endometrium of rat endometriosis model
CHEN Yu- shi1,ZHU Guang- hui1,DONG Jian- xin2,BAI Su- fen1,DU Chen- guang1,CAO Ying1
(1.NorthChinaUniversityofScienceandTechnology,Tangshan063000,China; 2.TheAffiliatedHospital,NorthChinaUniversityofScienceandTechnology,Tangshan063000,China)
Objective: To observe the effects of Shao Fu Zhu Yu Decoction(SFZY) on proliferation, apoptosis and angiogenesis in eutopic endometrium of endometriosis rats, and to explore the mechanisms of SFZY for treating endometriosis. Methods: 10 rats were randomly assigned to control group from 58 female SD rats, the rest rats underwent surgical induction of endometriosis with autotransplantation. 38 rats with successful ectopic implants were divided into two groups: model group and treated group. SFZY was administered to rats in the treated group by gastrogavage. After a 4- week treatment period, histopathological properties of the eutopic endometrium were evaluated, expression of PCNA in the eutopic endometrium was detected by immunohistochemistry, apoptotic cells were assessed by TUNEL, expression of CD34 and SMA- α in the eutopic endometrium was detected by immunofluorescence double- staining for calculating microvessel density(MVD) and vascular maturity index(VMI). Results: The eutopic endometrium was significantly thicker(P<0.05)in the model group compared to the control and treated group, the apoptosis index and VMI were significantly lower(P<0.01)in the model group compared to the control and treated group, the MVD was significantly increased(P<0.05)in the model group compared to the control and treated group. Conclusion: SFZY can inhibit the proliferation of eutopic endometrium through inducing apoptosis of eutopic endometrial stromal cells in endometriosis rats, and inhibit angiogenesis and induce vessel maturation in eutopic endometrium.
Shao Fu Zhu Yu Decoction; endometriosis; cell proliferation; cell apoptosis; angiogenesis; rats
2016- 09- 28
2016- 12- 09
国家自然科学基金资助项目(81603455);河北省中医药管理局科研计划项目(2015165);2015年河北省大学生创新创业训练计划项目;2015年华北理工大学大学生创新创业训练计划项目(X2015061)
陈雨诗(1993-),女,辽宁鞍山人,在读本科生。E- mail:529621925@qq.com
曹颖 E- mail:couny02@163.com
陈雨诗,朱广辉,董建新,等.少腹逐瘀汤对子宫内膜异位症模型大鼠在位内膜增殖、凋亡及血管生成的影响[J].东南大学学报:医学版,2017,36(2):142- 148.
R285.5; R711.71; R- 332
A
1671- 6264(2017)02- 0142- 07
10.3969/j.issn.1671- 6264.2017.02.003

