胃肠道恶性肿瘤患者围手术期肠外营养的治疗效果
周路琦,孙超 ,程艳芬,王艳新,李玲,代俊利
(承德医学院附属医院 1.营养科,2.静脉用药调配中心,3.介入中心,4.内分泌科,河北 承德 067000; 5.承德市中心医院 放化疗中心,河北 承德 067000)
·论 著·
胃肠道恶性肿瘤患者围手术期肠外营养的治疗效果
周路琦1,孙超2,程艳芬3,王艳新4,李玲1,代俊利5
(承德医学院附属医院 1.营养科,2.静脉用药调配中心,3.介入中心,4.内分泌科,河北 承德 067000; 5.承德市中心医院 放化疗中心,河北 承德 067000)
目的:探讨围手术期肠外营养对胃肠道恶性肿瘤患者术后营养状况的干预效果。方法: 胃肠道恶性肿瘤患者84例,按随机数字表法随机分为实验组与对照组,每组各42例。实验组术前7 d开始给予肠外营养,对照组常规给予糖电解质输液;两组患者均于术后第1天开始给予等氮等热量的肠外营养治疗,观察两组患者术前1 d、术后7 d各项指标的变化。结果:实验组患者术前1 d的体重指数(body mass index,BMI)值、血清前白蛋白(prealbumin,PA)和转铁蛋白(transferrin,TF)值均高于对照组,差异有统计学意义(P<0.05)。术后7 d,实验组患者的BMI、肱三头肌皮褶厚度(triceps skinfold thickness,TSF)值、血白蛋白(albumin,ALB)、血红蛋白(hemoglobin,HGB)、PA和TF值均高于对照组,实验组肺部感染发生率低于对照组,差异均有统计学意义(P<0.05)。结论:存在营养风险的胃肠道恶性肿瘤患者术前给予肠外营养治疗可有效改善患者术后的营养状况,降低术后肺部感染发生率。
胃肠道恶性肿瘤;围手术期肠外营养;体重指数;白蛋白;前白蛋白
营养不良可引起患者机体免疫功能降低、组织器官萎缩以及心情抑郁等,从而影响疾病的治疗效果[1]。因此,营养支持已从辅助治疗措施逐渐转变为主要治疗手段之一[2],及时改善患者的营养状况已成为降低手术并发症发生率和提高治疗效果的重要手段。本研究选择2013年9月至2015年9月间我院收治的84例胃肠肿瘤患者,调查其术前营养状况,观察术前肠外营养支持对其术前及术后营养状况的影响,现报道如下。
1 资料与方法
1.1 一般资料
选择我院收治的胃肠道恶性肿瘤营养风险筛查2002(nutrition risk screening 2002,NRS)评分≥3分的患者84例,按随机数字表法将其分为实验组与对照组,每组各42例。实验组男25例,女17例;对照组男28例,女14例。入选标准:(1)患者年龄为35~70岁;(2)临床症状、体征及各项实验室检查均支持胃肠道恶性肿瘤的诊断;(3)均符合应用外科肠外营养的指征[3];(4)患者未合并其它器官恶性肿瘤;(5)患者未合并代谢性疾病;(6)NRS评分≥3分的患者;(7)肿瘤无转移。
1.2 方法
实验组术前7 d开始给予个体化的肠外营养,对照组同期给予糖电解质输液。两组患者均于术后第1天开始给予每公斤体重等氮等热量的肠外营养治疗(能量83.7~104.6 kJ·kg-1·d-1,氮量0.16~0.2 g·kg-1·d-1),氮热比 1∶125~150,糖脂比0.6∶0.4,微量营养素和矿物质参照成人营养素推荐摄入量(recommendednutrientintake,RNI)和适宜摄入量(adequateintake,AI)[4]给予。肠外营养方案由营养科营养医师会诊出具,由静脉用药调配中心在层流净化台配制成“三升袋”,经中心或外周静脉给入,应用至术后7d观察治疗效果。
1.3 监测指标
身体测量指标:体重指数(BMI)=体重(kg)/身高2(m2)。根据WHO建议,18岁以上成人BMI<18.5为营养不良; 肱三头肌皮褶厚度(TSF)正常参考值:男性8.3mm,女性15.3mm,实测值为正常值的90%以下即为亏损。实验室指标:白蛋白(ALB)、总蛋白(TP)、血红蛋白(HGB)、前白蛋白(PA)、转铁蛋白(TF)。感染指标:肺部感染、切口感染。
1.4 统计学处理
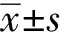
2 结 果
2.1 两组患者一般资料比较
实验组男25例(59.5%),女17例(40.5%);对照组男28例(66.7%),女14例(33.3%),两组患者性别构成比差异无统计学意义(χ2= 0.460,P=0.498)。实验组患者平均年龄(56.45±4.43)岁,对照组(59.77±3.13)岁,两组患者平均年龄比较差异无统计学意义(t=- 0.362,P=0.719)。实验组胃癌3例(7.1%),结肠癌例26例(61.9%),直肠癌13例(31%);对照组胃癌5例(11.9%),结肠癌23例(54.8%),直肠癌14例(33.3%),两组患者疾病分布比较无显著性差异(χ2= 0.721,P=0.697)。实验组患者术后TNM分期:Ⅰ期3例(7.1%),Ⅱ期21例(50.1%),Ⅲ期15例(35.7%),Ⅳ期3例(7.1%);对照组Ⅰ期8例(19%),Ⅱ期18例(42.9%),Ⅲ期10例(23.8%),Ⅳ期6例(14.3%),两组患者术后分期比较差异无统计学意义(χ2= 4.503,P=0.212)。
2.2 两组患者人体测量指标的比较
经独立两样本t检验,两组患者术前7 d的BMI、TSF值比较差异均无统计学意义(P>0.05)。实验组患者术前1 d及术后7 d的BMI值高于对照组,差异有统计学意义(P<0.05);两组患者术前1 d的TSF值比较差异无统计学意义(P>0.05),实验组术后7 d的TSF值高于对照组,差异有统计学意义(P<0.05)。见表1。
2.3 两组患者血液生化指标的比较
经独立两样本t检验,两组患者术前7 d的血ALB、TP、HGB、PA和TF值比较差异均无统计学意义(P>0.05)。实施干预后,实验组患者术前1 d血PA、TF值高于对照组,差异有统计学意义(P<0.05);术后7 d实验组患者血ALB、HGB、PA、TF值均高于对照组,差异有统计学意义(P<0.05);两组患者血TP值比较差异无统计学意义(P>0.05)。见表2。
表1 两组患者人体测量指标的比较

组 别BMI/kg·m-2TSF/mm术前7d术前1d术后7d术前7d术前1d术后7d实验组17.76±10.6118.88±0.2219.27±0.3411.53±0.7511.87±0.5312.22±0.12对照组17.95±0.3418.11±0.4018.45±0.1211.50±0.8511.57±0.3511.80±0.23t值-0.4622.9027.1680.0510.8152.858P值0.6680.044a0.002a0.9620.4610.046a
a 实验组与对照组比较,P<0.05
表2 两组患者血液蛋白指标的比较

指 标ALB/g·L-1TP/g·L-1HGB/g·L-1PA/mg·L-1TF/g·L-1实验组术前7d35.57±2.2062.97±4.41132.00±2.65197.83±14.101.99±0.13 术前1d36.93±1.2565.97±1.99138.00±4.36227.50±4.52a2.30±0.07a 术后7d37.83±1.10a64.70±1.12141.33±2.08a232.13±7.49a2.42±0.11a对照组术前7d34.03±1.4161.43±2.76133.33±4.73194.13±23.762.08±0.12 术前1d34.57±1.5261.37±1.70136.00±4.36210.60±5.462.13±0.09 术后7d34.03±1.2263.43±1.15137.00±1.00214.73±4.822.18±0.06
a 与同期对照组比较,P<0.05
2.4 两组患者感染发生率的比较
术后7 d实验组发生肺部感染3例(7.1%),对照组10例(23.8%),经行×列表χ2检验,两组患者肺部感染发生率差异有统计学意义(χ2=0.067,P=0.034);术后7 d实验组患者切口感染1例(2.4%),对照组1例(2.4%),两组患者术后7 d切口感染率差异无统计学意义(χ2=1.000,P=0.753)。
3 讨 论
胃肠肿瘤外科患者营养风险及营养不足的发生率较高[5- 6],近70%的消化系统肿瘤患者在其病情发展过程中会发生营养不良。据文献报道[7],手术前伴有营养不良的肿瘤患者,术后并发症的发生率以及术后的死亡率明显高于营养状况较好者。陈满宇等[8]的研究显示,胃肠道恶性肿瘤患者营养不良的发生率为27.5%,潜在营养不良(存在营养不良风险)发生率则高达49.5%,营养不良已经成为临床肿瘤防治中不容忽视的问题。因此,早期发现、评估患者营养不良风险至关重要。Velasco等[9]研究表明,NRS 2002能够早期发现患者是否存在营养不良风险、预测临床结局、监测营养治疗的效果,对于胃肠道肿瘤具有良好的适用性。营养治疗作为一种医疗干预措施,其主要功能是维持细胞、器官与组织的代谢,加速组织修复,逆转营养不良,达到改善患者生活质量和促进病人康复的目的[10]。赵自然等[10]认为术前营养支持治疗的目的是使患者能适应手术创伤,顺利度过围手术期。有研究证实,合并营养不良的胃肠肿瘤患者术前进行肠外或肠内营养支持1~2周可明显改善手术后结局[11]。BMI被认为是反映营养不良的可靠指标,TSF则通过测定皮下脂肪含量推算体脂总量。ALB、HGB、TP、PA、TF是反映人体营养状况的主要实验室指标。金吉安[12]等术前8 d至术后5 d为实验组患者实施肠外营养治疗,对照组输注糖电解质液,研究结果表明术后7 d实验组患者的血HGB和ALB值明显高于对照组,体重减少低于对照组。卜君等[13]术前7 d开始给予实验组肠外营养治疗,该组患者术后7 d的血ALB、PA值均高于对照组,肺部感染率低于对照组。李燕等[14]的研究表明,术前进行营养风险评估并实施营养支持有助于改善术后7 d的血PA和TF值。
本研究依据ESPEN制订的《外科肠外营养指南》[3]建议,“术前PN的指征为存在严重营养不良及经口或肠内途径不能摄入足够营养,7~14 d的术前营养支持有利于改善严重营养不良病人的临床结局,术后PN的指征为预计手术后不能经口或肠内途径摄入或吸收足够的营养超过7 d以上”为患者进行肠外营养治疗。本研究对术前NRS≥3分的实验组患者实施术前为期7 d的肠外营养治疗以改善患者术前的营养状况,结果发现,术前肠外营养治疗7 d后实验组患者的BMI、血PA和TF值即显著高于对照组;术后两组患者同时接受每公斤体重等氮等热量的肠外营养治疗,实验组术后7 d的ALB、HGB、PA和TF值均高于对照组,说明术前营养状况的改善有益于术后各项指标的恢复;同时,实验组肺部感染发生率低于对照组,可能与营养状况改善后降低感染发生率有关。
综上所述,对于胃肠道恶性肿瘤患者术前应早期进行营养评估,早期发现营养不足并及早给予营养干预。同时,科学、合理的围手术期肠外营养治疗可有效改善患者术后营养状况,减少术后并发症的发生。
[1] 崔丽英,陈海波,宿英英,等.北京大医院神经科住院患者营养风险、营养不足、超重和肥胖发生率及营养支持应用状况[J].中华临床营养杂志,2009,20(2):67- 70.
[2] 顾景范,杜寿玢,郭长江.现代临床营养学[M].北京:科学出版社,2009:36- 37.
[3] BRAGA M L,JUNGQVIST O,SOETER P,et a1.ESPEN guidelines on parenteral nutrition:surgery[J].Clin Nutr,2009,28(4):378- 386.
[4] CURI R,LAGRANHA C J,DOI S Q,et al.Molecular mechanisms of glutamine action[J].J Cell Physiol,2005,204(2):392- 401.
[5] SCHWEGLER I,von HOLZEN A,GUTZWILHR J P,et al.Nutritional risk is a clinical predictor of postoperative mortality and morbidity in surgery for colorectal cancer[J].Br J Surg,2010,97(10):92- 97.
[6] RYU S W,KIM I H.Comparison of different nutritional assessments in detecting malnutrition among gastric cancer patients[J].World J Gastroenterol,2010,16(26):3310- 3317.
[7] MOYNAGH P.Postoperative starvation after gastrointestina surgery[J].BMJ,2002,324(7335):481.
[8] 陈满宇,吕龙,何秋山.胃肠道恶性肿瘤患者营养状况评价及影响因素分析[J].东南大学学报:医学版,2016,35(2):208- 211.
[9] VELASCO C,GARDA E,RODRTGUEZ V,et al.Comparison of four nutritional screening tools to detect nutritional risk in hospitalized patients:a muhiccntre study[J].Eur J Clin Nutr,201l,65(2):269- 274.
[10] 赵自然,康维明,于健春.消化道肿瘤患者营养支持治疗[J].临床药物治疗杂志,2013,11 (4):9- 13.
[11] 于健春.胃肠外科患者营养状况评估与营养支持途径的选择[J].中华胃肠外科杂志,2012,15(5):429- 432.
[12] 金吉安,于翠敏.胃肠道肿瘤患者围手术期肠外营养支持的观察[J].中国医药指南,2015,13(17):183.
[13] 卜君,黄雄,李念.术前营养支持对于减少存在营养不良的胃癌患者术后呼吸系统并发症的作用[J].实用医学杂志,2013,29(8):1246- 1248.
[14] 李燕,程垚,徐斌,等.食管癌患者术前营养风险评估与干预的效果评价[J].中华护理杂志,2015,50(2):166- 170.
(本文编辑:周兰波)
The therapeutic effect of perioperative parenteral nutrition on patients with gastrointestinal malignant tumor
ZHOU Lu- qi1,SUN Chao2,CHENG Yan- fen3,WANG Yan- xin4,LI Ling1,DAI Jun- li5
(1.DepartmentofNutrition,2.DepartmentofPharmacyIntravenousAdmixture,3.InterventionalTherapyCenter, 4.DepartmentofEndocrinology,theAffiliatedHospitalofChengdeMedicalCollege,Chengde067000,China; 5.CenterofRadiationandChemo-therapy,CentralHospitalofChengde,Chengde067000,China)
Objective:To explore the intervention effect of perioperative parenteral nutrition on postoperative nutritional status in patients with gastrointestinal malignant tumors. Methods: 84 patients with gastrointestinal malignant tumor had been divided into experimental group and control group according to random number table, 42 cases of experimental group, 42 cases of control group. The patients in the experimental group had been given parenteral nutrition from 7th day pre- operation, at the same time, the patients in the control group had been given glucose- electrolyte solution routinely; both two groups had been given equal nitrogen amount and isocaloric parenteral nutrition from 1th day postoperation, and then indicators of 1th day and 7th day after operation were observed.Results: At l day pre- operation, the body mass index, blood prealbumin and transferrin in the experimental group were higher than those in the control group, the differences were statistically significant (P<0.05). At 7 days after operation, the body mass index, triceps skinfold, blood albumin, hemoglobin, prealbumin and transferrin values in the experimental group were higher than those in the control group, the pulmonary infection incidence rate was lower in the experimental group than that in the control group, the differences had statistical significances (P<0.05). Conclusion: In gastrointestinal malignant tumor patients with nutritional risk, preoperative parenteral nutrition therapy can effectively improve nutritional status and reduce incidence rate of pulmonary infection after operation.[Key words] gastrointestinal malignant tumors; perioperative parenteral nutrition; body mass index; albumin; prealbumin
2016- 07- 22
2016- 12- 11
承德市科学技术研究与发展计划项目(20132062)
周路琦(1977-),女,河北隆化人,主管技师,公共卫生与预防医学硕士。E- mail:gaolele0815@163.com
代俊利 E- mail:18713400666@163.com
周路琦,孙超,程艳芬,等.胃肠道恶性肿瘤患者围手术期肠外营养的治疗效果[J].东南大学学报:医学版,2017,36(2):213- 216.
R735.2; R735.3
A
1671- 6264(2017)02- 0213- 04
10.3969/j.issn.1671- 6264.2017.02.016

