非小细胞肺癌患者外周血hTERT mRNA水平检测的临床意义
周婉婉,梁冰,王效静,胡丙清
(1.蚌埠医学院第一附属医院 老年病科,安徽 蚌埠 233003; 2.安徽呼吸系病临床基础省级实验室,安徽 蚌埠 233004)
·论 著·
非小细胞肺癌患者外周血hTERT mRNA水平检测的临床意义
周婉婉1,梁冰1,王效静2,胡丙清1
(1.蚌埠医学院第一附属医院 老年病科,安徽 蚌埠 233003; 2.安徽呼吸系病临床基础省级实验室,安徽 蚌埠 233004)
目的:探讨非小细胞肺癌(NSCLC)发展与外周血端粒酶逆转录酶(hTERT)表达的相关性。方法: 采用Real- time PCR技术检测114例NSCLC患者和35例肺部良性病变患者外周血hTERT mRNA表达水平,比较二者之间的差异并分析。结果:检测结果显示,肺鳞癌Ⅰ~Ⅳ期hTERT mRNA表达量分别为(0.134±0.018)×10-3、(0.185±0.044)×10-3、(0.576±0.267)×10-3、(3.409±2.544)×10-3,Ⅰ、Ⅱ期之间差异无统计学意义(P>0.05),其余各组之间差异有统计学意义(P<0.05);肺腺癌Ⅰ~Ⅳ期hTERT活性分别为(0.156±0.006)×10-3、(0.220±0.052)×10-3、(0.630±0.282)×10-3、(3.230±2.245)×10-3,Ⅰ、Ⅱ期之间差异无统计学意义(P>0.05),其余各组之间差异有统计学意义(P<0.05);同期鳞癌与腺癌之间差异无统计学意义(P>0.05);肺部良性病变组外周血hTERT mRNA表达水平为(0.042±0.017)×10-3,与肺癌组之间存在显著性差异 (P<0.05)。结论:NSCLC患者外周血hTERT mRNA表达显著升高,并与NSCLC临床分期正相关,提示其可作为肺癌诊断和临床分期的有益参考,但与NSCLC的病理类型无关。
非小细胞肺癌; hTERT mRNA; 实时荧光定量PCR
肺癌是当今世界发病率和死亡率最高的恶性肿瘤,是男性癌症死亡的主要原因,也是女性癌症死亡的第二大原因。国际癌症研究机构(IARC)估计,每年世界各地有超过1 400 000例患者死于肺癌[1]。其中,非小细胞肺癌(NSCLC)约占肺癌的85%[2],但因非小细胞肺癌(NSCLC)的早期症状不典型且出现较晚,绝大多数患者在临床确诊时已处在中晚期,晚期 NSCLC 患者比例可达30%~40%[3],总的5年存活率仅为15%[4]。且在经过根治性手术治疗的早期NSCLC患者中仍有30%~40%的患者会出现不同程度的复发状况,并且最终因癌细胞转移至其他内脏而导致死亡[5]。因此,NSCLC的早期诊断及预后风险的有效评估是攻克癌症难题中的研究重点,其中作为肿瘤标志物之一的端粒酶则是该研究中的热点。因此,作者通过对检测外周血hTERT表达水平在NSCLC中的早期诊断作用进行深入研究,以期为临床上对NSCLC的诊治提供指导。
1 对象和方法
1.1 研究对象
选取蚌埠医学院第一附属医院2015年3月至2016年4月期间呼吸科或心胸外科的住院患者作为研究对象。其中NSCLC组114例,男71例,女43例,平均年龄(58.7±15.0)岁,均经临床病理明确病理类型,同时根据患者胸部CT、头颅MRI、骨ECT、腹部彩超等检查确定临床分期。病理分型:鳞癌59例,腺癌55例。临床分期鳞癌Ⅰ期11例、Ⅱ期12例、Ⅲ期21例、Ⅳ15例;腺癌Ⅰ期10例、Ⅱ期11例、Ⅲ期19例、Ⅳ15例。良性肺部疾病组35例,男21例,女14例,平均年龄(62.0±12.2)岁,其中肺炎21例,肺结核5例,胸膜炎2例,炎性假瘤4例,错构瘤2例,腺瘤1例,均经临床诊断性治疗或病理诊断后明确诊断。
1.2 标本采集
所有疑似肺癌的患者入院后即采集空腹血标本。
1.3 RNA提取
使用淋巴细胞分离液(按照血∶生理盐水∶淋巴细胞分离液=1∶1 ∶2的比例,1 500r·min-120min离心后获取淋巴细胞,然后按照TRNzol法提取RNA,采用ThermoDNA/RNA检测仪检测RNA的A260nm/A280nm值,经液氮速冻后置-80 ℃冰箱保存。
1.4RNA逆转录
根据患者诊断选取合格的标本,用Thermo公司生产的逆转录试剂盒进行逆转录。逆转录步骤:端粒酶RNA模板1 000ng、Oligo(dT)18primer1μl、RNaseFreedH2O定容值12μl,混匀后短暂离心,置PCR机 65 ℃ 5min后取出放置冰浴速降温度,然后再次加入5×ReactionBuffer4μl、RibolockRNaseInhibitor1μl、10mmol·L-1dNTPMix2μl、RevertAidM-Mul.VRT1μl,混匀后短暂离心,反转录反应条件为42 ℃ 60min、70 ℃ 5min。合成后的cDNA储存于-80 ℃的冰箱中。
1.5RT-PCR扩增
应用凯基生物的端粒酶荧光定量PCR检测试剂盒进行扩增,反应体系体积为25μl,包括MaximaSYBRGreenqPCRMasterMix(2×) 12.5μl、引物(试剂盒自带)上下游各0.5μl、端粒酶DNA模板2μl、无酶水9.5μl。PCR实验在ABIStepOnePlusPCR仪上执行。循环参数设置:95 ℃ 10min、95 ℃ 15s、60 ℃ 30s、72 ℃ 30s,共40个循环。循环结束后软件自动分析实验结果,显示为扩增曲线和溶解曲线图以及内参和样本的CT值。实验过程采用无酶水作为阴性对照组。
1.6 统计学处理
2 结 果
2.1 两组患者外周血hTERT mRNA的相对表达量
Real- time PCR结果显示如图1~4,外周血hTERT mRNA在各实验组的表达情况如下:鳞癌Ⅰ~Ⅳ期分别为(0.134±0.018)×10-3、(0.185±0.044)×10-3、(0.576±0.267)×10-3、(3.409±2.544)×10-3,Ⅰ、Ⅱ期之间差异无统计学意义(P>0.05),其余各组间有显著差异(P<0.05);腺癌Ⅰ~Ⅳ期hTERT活性分别为(0.156±0.006)×10-3、(0.220±0.052)×10-3、(0.630±0.282)×10-3、(3.230±2.245)×10-3,Ⅰ、Ⅱ期之间差异无统计学意义(P>0.05),其余各组间比较差异显著(P<0.05);而同一临床分期的腺癌与鳞癌组之间差异无统计学意义(P>0.05);肺部良性病变组为(0.042±0.017)×10-3,与肺癌各组间差异有统计学意义(P<0.05),见表1。

图1 目的基因扩增曲线Fig 1 Amplification plot of hTERT
图2 内参扩增曲线Fig 2 Amplification plot of GAPDH

图3 目的基因溶解曲线Fig 3 Melting curve of hTERT

图4 内参溶解曲线Fig 4 Melting curve of GAPDH
表1 肺癌患者各临床病理参数下外周血hTERT mRNA表达情况
Tab 1 Expression of hTERT mRNA in peripheral blood of NSCLC with different clinical pathological parameters

项 目n端粒酶阳性表达情况/例端粒酶活性(×10-3)鳞癌组Ⅰ期114(36.4)0.134±0.018 Ⅱ期125(41.7)0.185±0.044 Ⅲ期2116(76.2)0.576±0.267 Ⅳ期1514(93.3)3.409±2.544腺癌组Ⅰ期103(30)0.156±0.006 Ⅱ期115(45.6)0.220±0.052 Ⅲ期1913(68.4)0.630±0.282 Ⅳ期1513(86.7)3.230±2.245肺部良性病变组353(8.6)0.042±0.017
注:括号中为所占百分比
2.2 Real- time PCR产物的琼脂糖凝胶电泳结果
如图5所示,电泳条带的大小符合Real- time PCR的结果。其中,NSCLC组患者的hTERT mRNA阳性总表达率为64.0%,肺良性病变组患者的hTERT mRNA阳性表达率为8.6%,两组比较差异具有统计学意义(P<0.05)。
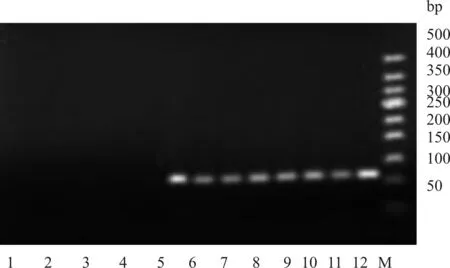
M.为50 bpDNA梯度;1~4.为肺部良性病变组hTERT mRNA扩增产物;5~12.为非小细胞肺癌组hTERT mRNA扩增产物
图5 各组hTERT mRNA扩增结果
3 讨 论
目前,针对肺癌的相关研究主要是通过在预测肺癌患者有益的方面来探讨肺癌的相关生物学特性。在各种癌症中,端粒酶活性被认为是肿瘤早期诊断、病理程度以及预后的指标。端粒酶主要由人端粒酶RNA(TERC)、具有反转录酶活性的人端粒酶逆转录酶(TERT)、端粒酶相关蛋白组成[6],其中TERT是现在研究的热点。有研究在肺癌组织[7]、胸水[8]中证实肺癌的进展及预后与端粒酶显著相关。且随着研究深入,研究者正在通过非侵入性的方式获得肿瘤标志物,进而能够及时早期地诊断肿瘤,并在随访中对肿瘤进行风险评估。
癌细胞的转移是临床肺癌低存活率的主要原因,因此肺癌的早期诊断是降低其病死率的主要措施之一。临床上,肿瘤细胞转移的主要方式是血液播散,如果能早期监测到血液循环中的癌细胞,则有可能极大程度地提高肿瘤的诊治率。有研究[9]也证实循环血中的生物标志物在肿瘤的诊治和预后评估方面具有检测作用。现已有研究人员在循环血及痰液中检测到了端粒酶活性[10- 12]。
本实验检测了NSCLC患者外周血中hTERT mRNA的表达水平,结果显示hTERT mRNA在NSCLC患者的外周血中具有较高的表达率,且与TMN分期相关,其中Ⅰ期和Ⅱ期两者之间差异无统计学意义(P>0.05),但随着疾病的进展、恶化,hTERT mRNA表达水平呈显著性升高(P<0.05),且NSCLC组患者的hTERT mRNA表达水平明显高于肺良性病变组(P<0.05),提示端粒酶在NSCLC的血循环标志方面具有较高的特异性。同时,本实验结果显示同一临床分期的不同类型NSCLC患者的外周血hTERT mRNA的表达差异无统计学意义(P>0.05),提示端粒酶可能在肺癌的类型诊断方面无明显意义。同时Ding等[10,13]研究也证实了NSCLC患者外周血hTERT mRNA的表达水平在不同临床分期中的表达存在着差异,但在病理类型方面无明显差异。综上所述,端粒酶的活性表达作为肺癌发生发展过程中的一个重要影响因素,与肺癌的临床分期呈正相关,因而端粒酶可以作为肺癌患者早期的分子标志物之一,对肺癌的早期诊断具有重要的参考意义。
目前,外周血端粒酶活性的检测作为一种新的非侵入性的早期检测手段可广泛应用于各种肿瘤中,国内外相关研究也展现出了良好的发展前景,但目前大部分相关试验的样本数量比较有限,因此,仍需要进一步的大样本研究。同时在今后的研究中我们还需进一步探讨外周血端粒酶活性与肿瘤发展和预后的相关性,并可对其发挥作用的机制进行探讨。
[1] XING Y L,LIU F,LIN J C,et al.Case- control study on impact of the telomerase reverse transcriptase gene polymorphism and additional single nucleotide polymorphism (SNP)- SNP interaction on non- small cell lung cancers risk in Chinese Han population[J].J Clin Lab Anal,2016,30(6):1071- 1077.
[2] FRINK R E,PEYTON M,SCHILLER J H,et al.Telomerase inhibitor imetelstat has preclinical activity across the spectrum of non- small cell lung cancer oncogenotypes in a telomere length dependent manner[J].Oncotarget,2016,7(22):31639- 31651.
[3] 王晶.第一代靶向药物治疗晚期 NSCLC 的临床观察[J].现代医学,2016,43(11):1423- 1424.
[4] SUN Y,YANG C,CHEN J,et al.Overexpression of WDR79 in non- small cell lung cancer is linked to tumour progression[J].J Cell Mol Med,2016,20(4):698- 709.
[5] 李献文,仇铁峰,丁明,等.hTERT mRNA 在肺癌中的作用[J].癌症进展,2016,14(1):71- 73.
[6] LIU T J,ULLENBRUCH M,CHOI Y Y,et al.Telomerase and telomere length in pulmonary fibrosis[J].Am J Resp Cell Mol,2013,49(2):260- 268.
[7] KUBICA K D,ZIOB M Z,BRULINSKI K,et al.Telomerase activity in non- small cell lung cancer[J].Kardiochir Torakochi, 2016,13(1):15- 20.
[8] CHA N,LI X Y,ZHAO Y J,et al.hTERT gene amplification and clinical significance in pleural effusions of patients with lung cancer[J].Clin Lung Cancer,2012,13(6):494- 499.
[9] PELLATT A J,WOLFF R K,HERRICK J,et al.TERT’s role in colorectal carcinogenesis[J].Mol Carcinogen,2013,52(7):507- 513.
[10] DING M,LI X,QIU T.Combination of multiple gene markers to detect circulating tumor cells in the peripheral blood of patients with non- small cell lung cancer using real- time PCR[J].Genet Mol Res,2015,14(4):13033- 13040.
[11] DORSEY J F,KAO G D,MACARTHUR K M,et al.Tracking viable circulating tumor cells(CTCs) in the peripheral blood of non- small cell lung cancer(NSCLC) patients undergoing definitive radiation therapy:pilot study results[J].Cancer,2015,121(1):139- 149.
[12] 李红梅,滑峰,赵诚,等.诱导痰、胸水和纤维支气管镜活组织端粒酶活性的联合检测对肺癌的诊断价值[J].中国肺癌杂志,2010,13(2):128- 131.
[13] 杨斌,马莉,岳强,等.非小细胞肺癌患者手术和辅助化疗期间人端粒酶逆转录酶mRNA的表达变化及临床意义[J].中国药物与临床,2016,16(1):67- 69.
(本文编辑:周兰波)
The level of hTERT mRNA in peripheral blood of non- small cell lung cancer detected by real- time PCR
ZHOU Wan- wan1,LIANG Bing1,WANG Xiao- jing2,HU Bing- qing1
(1.DepartmentofGeratology,theFirstAffiliatedHospitalofBengbuMedicalCollege,Bengbu233003,China; 2.ProvincialKeyLabcratoryofRespiratoryDiseaseinAnhui,Bengbu233004,China)
Objective:To discuss the correlation between human telomerase reverse transcriptase (hTERT) activity in peripheral blood and the development of non- small cell lung cancer(NSCLC). Methods: 114 cases of NSCLC and 35 cases of lung benign lesions were collected. hTERT mRNA expression of the patients with NSCLC or lung benign lesions were determined and analyzed by the real- time PCR. Results: The expressions of hTERT mRNA in peripheral blood of Ⅰ- Ⅳ clinical stages of lung squamous carcinoma were (0.134±0.018)×10-3, (0.185±0.044)×10-3,(0.576±0.267)×10-3and (3.409±2.544)×10-3, excepting clinical stage Ⅰand Ⅱ,the differences among other groups were statistically significant(P<0.05); The expressions of hTERT mRNA in peripheral blood of Ⅰ- Ⅳ clinical stages of lung adenocarcinoma were(0.156±0.006)×10-3, (0.220±0.052)×10-3, (0.630±0.282)×10-3, (3.230±2.245)×10-3,excepting clinical stage Ⅰand Ⅱ,the differences among other groups were statistically significant(P<0.05); in the same clinical stage, the differences between squamous carcinoma and adenocarcinoma were not statistically significant(P>0.05). The level of hTERT mRNA in peripheral blood of lung benign lesions was (0.042±0.017)×10-3, and the difference between lung benign lesions and NSCLC was significant (P<0.05). Conclusion: The level of hTERT mRNA of NSCLC increase significantly and it is positively associated with clinical stages, which also implies that the expression of hTERT mRNA may be benefit to make the diagnose and clinical stages of NSCLC, but it is not associated with clinical pathological type.
non- small cell lung cancer; hTERT mRNA; real- time PCR
2016- 08- 02
2016- 12- 11
2014年度安徽省重点实验室、工程中心(蚌埠医学院)开放课题(BYKL1413ZD)
周婉婉(1990-),女,安徽蚌埠人,医师,医学硕士。E- mail:1020455575@qq.com
梁冰 E- mail:407281726@qq.com
周婉婉,梁冰,王效静,等.非小细胞肺癌患者外周血hTERT mRNA水平检测的临床意义[J].东南大学学报:医学版,2017,36(2):217- 221.
R734.2
A
1671- 6264(2017)02- 0217- 05
10.3969/j.issn.1671- 6264.2017.02.017

