肾小管上皮细胞G2- M期阻滞在缺氧诱导的肾间质纤维化中的作用
刘婷,党杨杰,刘利敏,张磊,付爱萍,张玉明,吴笛,杜锐,孙世仁
(1.第四军医大学西京医院 肾内科,国家肿瘤重点实验室 陕西 西安 710032; 2.军事口腔医学国家重点实验室,口腔疾病国家临床医学研究中心,陕西省口腔生物工程技术研究中心,第四军医大学口腔医学院麻醉科陕西 西安 710032; 3.第四军医大学学员一旅;4.海军总医院肿瘤诊疗中心 北京 100048)
·论 著·
肾小管上皮细胞G2- M期阻滞在缺氧诱导的肾间质纤维化中的作用
刘婷1,党杨杰2,刘利敏1,张磊1,付爱萍1,张玉明1,吴笛3,杜锐4,孙世仁1
(1.第四军医大学西京医院 肾内科,国家肿瘤重点实验室 陕西 西安 710032; 2.军事口腔医学国家重点实验室,口腔疾病国家临床医学研究中心,陕西省口腔生物工程技术研究中心,第四军医大学口腔医学院麻醉科陕西 西安 710032; 3.第四军医大学学员一旅;4.海军总医院肿瘤诊疗中心 北京 100048)
目的:探讨肾小管上皮细胞G2- M期阻滞在缺氧诱导的肾间质纤维化中的作用。方法:体外实验,人肾小管上皮细胞(HK2)分别置于常氧21%和缺氧1%的孵箱里,培养24,48 hrs。采用流式细胞术检测缺氧48 hrs后上皮细胞的周期分布;采用Western blot法检测Collagen4A1(COL4A1)及α- 平滑肌肌动蛋白(α- SMA)的蛋白表达水平。单侧输尿管梗阻(UUO)14 d小鼠模型,HE及Masson染色观察肾组织病理改变及纤维化程度,免疫组化染色观察α- SMA的表达及部位;Western blot检测低氧标记分子HIF- 1α、细胞周期蛋白cyclinB1和cyclinD1的蛋白水平。结果:与常氧组比较,缺氧组肾小管上皮细胞G2/M期比例增高(P<0.05),同时α- SMA和COL4A1的蛋白表达水平增高(P<0.05);与假手术组比较,HE及Masson染色显示模型组肾组织纤维化程度增高,α- SMA的表达增高且主要分布在间质中;Western blot结果显示:HIF- 1α及G2/M期标记物cyclinB1/cyclinD1比值增加。结论:肾小管上皮细胞G2- M期阻滞参与缺氧诱导的肾间质纤维化。
缺氧; G2- M阻滞; 肾小管上皮细胞; 肾间质纤维化
肾间质纤维化是各种慢进肾脏病发展至终末期肾脏病的主要病理变化和共同通路[1],以炎细胞浸润,成纤维细胞的激活和增殖,细胞外基质(extracellular matrix,ECM)大量沉积[2],肾脏固有细胞消失以及微血管减少为特征。近来研究发现,缺氧损伤是影响肾间质纤维化的关键因素和重要途径[4],大量研究发现缺氧有可能通过细胞表型发生间充质转变、启动炎症反应及免疫应答,刺激成纤维细胞增殖和能量代谢障碍,导致纤维化相关因子大量释放和细胞外基质合成与降解失衡最终促进肾间质纤维化的发生[3- 5],但我们研究发现缺氧能诱导肾小管上皮细胞发生G2/M期阻滞,提示除了以上途径外,缺氧还可能通过其他机制参与肾间质纤维化的过程。因此本研究旨在阐明缺氧能通过肾小管上皮细胞G2/M期阻滞参与肾间质纤维化。
1 材料与方法
1.1 实验材料
HK2细胞购于上海细胞库,流式细胞仪由第四军医大学生化教研室提供。HIF- 1α(北京博奥森生物技术有限公司)、羊抗兔α- SMA抗体(abcam公司)、羊抗兔Collagen4A1(COLA1)抗体(上海生工)和β- actin(北京博奥森生物技术有限公司);羊抗兔IgG- HRP Santa Cruz公司;F12培养基(HyClone);胎牛血清(浙江天杭生物),HE染色试剂盒(北京蓝博斯特生物技术有限公司)及病理特殊染色液套组Masson三色染色液试剂盒(珠海贝索生物技术有限公司)。
1.2 方法
1.2.1 细胞培养 细胞于含10%胎牛血清的F12培养基中培养,消化传代如常。以1×105/瓶接种于25 cm2的大皿,生长至70%- 80%时,换成无血清F12培养基,培养24 hrs以达到同步化处理。细胞分为常氧组(氧浓度21%)和缺氧组(1% O2),将缺氧组细胞置于1% O2、5% CO2、37 ℃的缺氧孵箱中培养24 hrs、48 hrs,常氧组细胞置于21% O2、5% CO2、37 ℃的常氧孵箱中培养24 hrs、48 hrs。
1.2.2 流式细胞术检测细胞周期分布 常规消化分组处理人肾小管上皮细胞,48 hrs 后收集细胞并加入2 mL PBS吹悬后离心,重复加PBS洗一次,弃上清后加入2 mL无水乙醇和1 mL PBS吹匀细胞,置于4 ℃冰箱固定过夜,次日送检。
1.2.3 Western blot法检测 HIF- 1α、α- SMA、COL4A1、cyclinB1、cyclinD1的蛋白表达:将常氧组及缺氧组细胞用4 ℃预冷的PBS洗一遍,置于冰上,然后分别加入200 μL的RIPA裂解液,将细胞用细胞刮刮下,加入1.5 mL离心管中,置于冰上裂解15 mins后用超声枪吹打5- 7次,再裂解10 mins,随后4 ℃下12 000 r·min-1离心20 mins,取上清。留取30 μL采用BCA法测定上清中蛋白量,其余上清中加入1/4体积的5×上样缓冲液,混匀后置于上100 ℃ 5 mins,即为制备好的蛋白样品,于- 20 ℃冰箱保存。取假手术组及模型组小鼠左侧肾组织,加裂解液后匀浆,离心,取上清,测蛋白浓度,加各组蛋白上样液进行SDS- PAGE凝胶电泳,PVDF转膜,室温封闭液封闭1 h,分别加一抗,β- actin(1∶1 500,Bioss,China),HIF- 1α(1∶400,Bioss,China),a-SMA(1∶1 000,Abcam),COL4A1(1∶300,SangonBiotech.Co.),cyclinB1(1∶200,SangonBiotech.Co.),cyclinD1(1∶500,SangonBiotech.Co.)4 ℃孵育过夜,TBST洗膜3次,与HRP标记的二抗孵育1h,TBST洗膜3次,最后ECL显色。
1.2.4 动物模型 雄性C57小鼠(由第四军医大学实验动物中心提供),6- 8周,体重20- 25g。实验前小鼠维持12hrs昼夜交替周期的标准条件下,适应性饲养一周,环境温度22~26 ℃,湿度40%~70%,自由进食、饮水。实验期间动物自由饮用自来水,进食标准颗粒饲料,术前12hrs禁食,自由饮水。将小鼠随机分为两组:假手术组(6只)及模型组(6只)。选用单侧输尿管梗阻(UUO)致肾间质纤维化模型,即:用1.5%的戊巴比妥钠按50mg·kg-1腹腔麻醉动物,固定,去毛消毒后打开左侧腹腔并双重结扎左侧输尿管,消毒后缝合伤口,关闭腹腔。假手术组麻醉后打开腹腔,分离左侧输尿管但不结扎,消毒后缝合伤口,关闭腹腔。于手术后14d麻醉灌注后处死两组小鼠,取梗阻侧肾脏,部分组织固定于4%多聚甲醛中待免疫组化染色,剩余组织保存于-80 ℃冰箱中蛋白分析。
1.2.5HE及Masson染色 用HE染色试剂盒(北京蓝博斯特生物技术有限公司)及病理特殊染色液套组Masson三色染色液试剂盒(珠海贝索生物技术有限公司)说明书进行染色。
1.2.6 免疫组织化学染色 石蜡切片常规脱蜡水化,用0.3%甲醇-H2O2液灭活内源性过氧化物酶,用枸橼酸缓冲液微波煮沸法进行抗原修复,然后用血清封闭30mins,加入一抗anti-a-SMA(1∶650,Abcam),于4 ℃冰箱过夜。次日加生物素标记的二抗,室温1h,滴加链霉亲和素- 过氧化物酶封闭30mins,DAB显色后,苏木素衬染细胞核,自来水冲洗后,常规脱水,透明,封片。
1.3 统计学处理
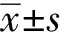
2 结 果
2.1 缺氧刺激HK2细胞G2/M期比例增加
通过流式细胞术检测常氧组和缺氧组细胞培养48 hrs后周期比例的变化,结果显示,缺氧组G2/M期细胞比例(11.96±0.07)高于常氧组G2/M期细胞比例(6.47±1.16)(图1),差异有统计学意义(P<0.05)。
2.2 缺氧刺激HK2细胞表达纤维化因子COL4A1及α- SMA
通过Western blot方法检测常氧组和缺氧组细胞培养24 hrs及48 hrs后,纤维化因子COL4A1及α- SMA的蛋白表达水平。结果显示与常氧组(0 h)相比,缺氧组细胞纤维化因子COL4A1及α- SMA在缺氧不同时间点蛋白表达增加(图2A、B),差异有统计学意义(aP<0.05)。
2.3 UUO模型肾脏间质纤维化的程度
HE染色显示模型组肾小管扩张,小管上皮细胞变性或坏死,炎症细胞浸润(图3A、B、);Masson染色显示UUO 14 d肾间质发生明显纤维化(图3C、D);α- SMA在模型组显著高表达,并且主要定位于间质中(图3E、F)。
2.4 UUO模型HIF- 1α及细胞周期蛋白的表达
与假手术组比较,模型组HIF- 1α表达增加,细胞周期蛋白cyclinB1表达增加而cyclinD1的表达降低(图4A、B),差异有统计学意义(aP<0.05)。cyclinB1与cyclinD1的比值是G2/M期的标记物,结果显示,与假手术组比较,cyclinB1/cyclinD1在UUO 14 d后表达增加(图4C),差异有统计学意义(aP<0.05),即G2/M期细胞比例增加。
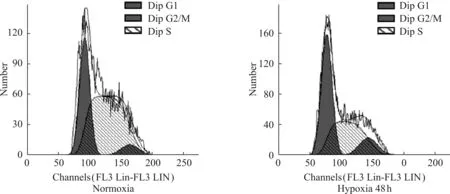
图1 流式细胞术检测常氧组和缺氧组细胞周期比例的变化
Fig 1 To detect the cell cycle distribution of HK2 cells by flow cytometry in normoxia and hypoxia group
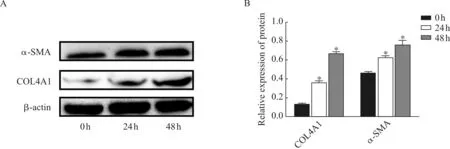
A、B. Western blot方法检测常氧组和缺氧组细胞纤维化因子COL4A1及α- SMA的蛋白表达水平
A、B. To examine the protein level of COL4A1and α- SMA in normoxia and hypoxia group by Western blot
图2 缺氧刺激HK2细胞表达纤维化因子COL4A1及α- SMA
Fig 2 Hypoxia induced the expression of COL4A1and α- SMA in HK2 cells

A、B.HE染色观察假手术组(sham组)及模型组(UUO 14 d)肾组织病理改变;C、D.Masson染色观察假手术组及模型组肾脏纤维化程度;E、F.免疫组化染色观察假手术组及模型组肾组织α- SMA表达及部位(n=6×400)。
A、B.Observed the pathological changes by HE in sham and UUO group. C、D.Observed renal tissue fibrosis degree by Masson staining in sham and UUO group.E、F.The expression and distribution of α- SMA was detected by immunohistochemical staining in sham and UUO group(n=6×400).
图3 UUO模型肾脏纤维化程度的观察
Fig 3 Observed renal tissue fibrosis degree in sham and UUO group

A.Western blot法检测模型组HIF- 1α及细胞周期蛋白cyclinB1及cyclinD1的表达;B.定量分析UUO 14 d后HIF- 1α的表达;B.定量分析UUO 14 d后cyclinB1/cyclinD1的比值变化(n=6)。
A.To detect the expression of HIF- 1α、cyclinB1and cyclinD1by Western blot. B. Quantitatively analysis the expression of HIF- 1α at 14 days after UUO.B. Quantitatively analysis the rate of cyclinB1/cyclinD1(n=6).
图4 UUO模型HIF- 1α及细胞周期蛋白的表达变化
Fig 4 To detect the expression of HIF- 1α、cyclinB1and cyclinD1 in UUO model
3 讨 论
肾间质纤维化以大量细胞外基质过度沉积为特点[6],研究表明,慢性缺氧是发展到终末期肾病的最终共同通路,并且,慢性缺氧可以通过调节促纤维化基因的表达、刺激成纤维细胞增殖、促进上皮细胞发生上皮细胞转分化、促进能量代谢障碍,炎症及免疫应答加速肾脏纤维化的发生[7]。近年研究发现,细胞周期阻滞是肾脏纤维化发生的重要病因之一[8- 11],也越来越引起研究者的关注,但是目前还很少有研究关注缺氧所致肾脏纤维化是否与细胞周期阻滞相关。参照文献我们通过1%氧浓度的缺氧孵箱建立细胞缺氧模型,通过单侧输尿管结扎建立梗阻性肾损伤肾间质纤维化模型,本研究HE、masson染色及Western blot检测低氧标记分子HIF- 1α,均提示缺氧性肾间质纤维化模型制备成功。
我们通过Western blot检测缺氧后COL4A1及α- SMA的表达。肾间质中胶原含量被人们广泛地用于评估纤维化严重程度,如CollagenⅠ、CollagenⅢ、CollagenⅣ及Collagen4A1等。肌成纤维细胞激活后可以产生大量胶原,是肾脏纤维化发生的重要机制之一,α- SMA是肌成纤维细胞的标记物,作为评估肾纤维化的另一重要细胞因子[12],因此,本实验选用COL4A1及α- SMA作为评估肾纤维化的重要细胞因子。本实验结果表明,与常氧组比较,缺氧组细胞COL4A1及α- SMA在缺氧后的肾脏高表达。与假手术组比较,模型组高表达α- SMA且主要分布于间质中。
细胞周期是进入增殖的细胞,通过一系列有序的事件最终实现细胞分裂,产生两个子细胞的过程,可以分为分裂期和间期,间期又包括G1期、S期和G2期。细胞能否顺利完成增殖过程与细胞能否顺利的从上一个阶段进入下一个阶段密切相关,这些过程受到严密的调控[13]。我们通过流式细胞术检测HK2细胞缺氧48 hrs之后G2/M期细胞比例,研究发现,与常氧组比较,缺氧组细胞G2/M期细胞比例显著增加,提示肾小管上皮细胞G2/M期阻滞可能参与缺氧诱导的肾间质纤维化的发生。有研究发现,当急性短暂缺氧时,诱发的肾损伤可以通过小管上皮细胞去分化、增生得到修复使肾功能恢复,然而,长期慢性缺氧通常使得小管发生异常修复过程,损伤的小管上皮细胞大量阻滞在G2/M期,未能顺利进入下一阶段,阻滞的细胞刺激纤维化因子TGF- β,CTGF及胶原大量产生,最终导致肾间质纤维化[14]。
细胞周期蛋白及细胞周期蛋白依赖性蛋白激酶在保证细胞周期有序进展中发挥着至关重要的作用,细胞周期蛋白随着细胞周期变化周而复始的出现和消失,使得蛋白激酶的活性发生周期性变化[15- 16]。其中,细胞周期蛋白cyclinB1主要在G2期合成,M晚期降解,cyclinD1主要在G1期合成,离开G1期时降解,cyclinB1与cyclinD1的比值是G2/M期的标记物[11],因此,本实验通过检测梗阻性肾损伤肾间质纤维化模型cyclinB1/cyclinD1的比值发现,与假手术组比较,模型组cyclinB1/cyclinD1的比值显著升高,验证了肾小管上皮细胞G2/M期阻滞参与了缺氧诱导的肾间质纤维化。
综上所述,缺氧能通过肾小管上皮细胞G2/M期阻滞参与肾间质纤维化。
[1] EDDY A A.Overview of the cellular and molecular basis of kidney fibrosis [J].Kidney Int,2014 4(1):2- 8.
[2] SUN Y B,QU X,CARUANA G,et al.The origin of renal fibroblasts/myofibroblasts and the signals that trigger fibrosis[J].Differentiation,2016,92(3):102- 107.
[3] DU R,XIA L,NING X,et al.Hypoxia- induced Bmi1 promotes renal tubular epithelial cell- mesenchymal transition and renal fibrosis via PI3K/Akt signal[J].Mol Biol Cell,2014,25(17),2650- 2659.
[4] GUERROT D,DUSSAULE J C,KAVVADAS P,et al.Progression of renal fibrosis:the underestimated role of endothelial alterations[J].Fibrogenesis Tissue Repair,2012,5(Suppl 1):S1- S15.
[5] 刘春凤,丁小强,朱加明,等.低氧在单侧输尿管梗阻模型肾间质纤维化中的作用初探 [J].复旦学报:医学版,2007,34(5).732- 736
[6] LIU Y.Cellular and molecular mechanisms of renal fibrosis[J].Nat Rev Nephrol,2011,7(12):684- 696.
[7] DARBY I A,HEWITSON T D.Hypoxia in tissue repair and fibrosis[J].Cell Tissue Res,2016,365(3):553- 562.
[8] LOVISA S,LEBLEU VS,TAMPE B,et al.Epithelial to mesenchymal transition induces cell cycle arrest and parenchymal damage in renal fibrosis[J].Nat Med,2015,21(9):998- 1009.
[9] LI H,PENG X,WANG Y,et al.Atg5- mediated autophagy deficiency in proximal tubules promotes cell cycle G2/M arrest and renal fibrosis[J].Autophagy,2016,12(9):1472- 1486.
[10] ZHU F,LIU W,LI T,et al.Numb contributes to renal fibrosis by promoting tubular epithelial cell cycle arrest at G2/M[J].Oncotarget,2016,7(18):25604- 25619.
[11] YANG L,BESSCHETNOVA TY,BROOKS CR,et al.Epithelial cell cycle arrest in G2/M mediates kidney fibrosis after injury[J].Nat Med,2010,16(5):535- 543.
[12] FAULKNER JL,SZCYKALSKI LM,SPRINGER F,et al.Origin of interstitial fibroblasts in an accelerated model of angiotensin Ⅱ- induced renal fibrosis[J].Am J Pathol,2005,167(5):1193- 1205.
[13] HAASE SB,WITTENBERG C.Topology and control of the cell- cycle- regulated trans- criptional circuitry[J].Genetics,2014,196(1):65- 90.
[14] CANAUD G,BONVENTRE JV.Cell cycle arrest and the evolution of chronic kidney disease from acute kidney injury[J].Nephrol Dial Transplant,2015,30(4):575- 583.
[15] GUO J M,XIAO B X,LIU Q,et al.Anticancer effect of aloe- emodin on cervical cancer cells involves G2/M arrest and induction of differentiation[J].Acta Pharmacol Sin,2007,28(12):1991- 1995.
[16] BARONE S,OKAYA T,RUDICH S,et al.Distinct and sequential upregulation of genes regulating cell growth and cell cycle progression during hepatic ischemia- reper- fusion injury[J].Am J Physiol Cell Physiol,2005,289(4):C826- 835.
(编辑:孙茂民)
Effect of G2/M phase arrest in renal tubular epithelial cells on hypoxia- induced renal interstitial fibrosis
LIU Ting1,DANG Yang- jie2,LIU Li- min1,ZHANG Lei1,FU Ai- ping1,ZHANG Yu- ming1, WU Di3,DU Rui4,SUN Shi- ren1
(1.StateKeyLaboratoryofCancerBiology,DepartmentofNephrology,XijingHospital,FourthMilitaryMedicalUniversity,Xi’an710032,China;2.StateKeyLaboratoryofMilitaryStomatology&NationalClinicalResearchCenterforOralDiseases&ShaanxiEngineeringResearchCenterforDentalMaterialsandAdvancedManufacture,DepartmentofAnesthesiology,SchoolofStomatology,TheFourthMilitaryMedicalUniversity,Xi’an710032,China; 3.CadetBrigade,FourthMilitaryMedicalUniversity,Xi’an710032,China; 4.DepartmentofRadiationOncology,NavyGeneralHospital,Beijing,100048,China)
Objective: To investigate the effect of G2/M phase arrest in renal tubular epithelial cells on hypoxia- induced renal interstitial fibrosis.Methods:Invitro, HK2 cells were subjected to hypoxia(1%O2) or normoxia(21%O2) for 24 and 48 hrs. We examined the cell cycle distribution of HK2 cells by flow cytometry, the expression of COL4A1 and α- SMA was detected by Western blot 48 hrs after hypoxia;We observed the pathological changes and renal tissue fibrosis degree by HE and Masson staining. The expression of α- SMA was detected by immunohistochemical staining in UUO model. Then we tested the protein level of HIF- 1α, cyclinB1and cyclinD1 by Western blot in UUO model. Results: Compared with normoxia group, hypoxia group showed a significant increase in the percentage of G2/M stage in HK2 cells(P<0.05). Hypoxia induced a significant increase of α- SMA and COL4A1 in protein level(P<0.05); Compared with the sham group, HE and Masson staining revealed the increased degree of renal tissue fibrosis and increased expression of α- SMA that was mainly expressed in interstitial; HIF- 1α and G2/M phase marker cyclinB1/cyclinD1 was increased in UUO model by Western blot. Conclusion: Chronic hypoxia induced renal interstitial fibrosis is associated with G2/M arrest in renal tubular epithelial cells.
hypoxia; G2/M arrest; renal tubular epithelial cell;renal interstitial fibrosis
2016- 11- 08
2017- 02- 22
国家自然科学基金面上项目(NO.81370789)
刘婷(1990-),女,汉族,陕西杨凌示范区人,在读硕士研究生,肾脏内科,研究方向:肾脏纤维化。E- mail:408634060@qq.com
孙世仁 E- Mail:sunshiren@medmail.com.cn
刘婷,党杨杰,刘利敏,等.肾小管上皮细胞G2- M期阻滞在缺氧诱导的肾间质纤维化中的作用[J].东南大学学报:医学版,2017,36(2):240- 245.
R692.2
A
1671- 6264(2017)02- 0240- 06
10.3969/j.issn.1671- 6264.2017.02.022

