抗虫耐除草剂转基因玉米SW-1目标性状测试及多重PCR检测
张 欣, 董玉凤, 王旭静, 王志兴
中国农业科学院生物技术研究所, 北京 100081
抗虫耐除草剂转基因玉米SW-1目标性状测试及多重PCR检测
张 欣, 董玉凤, 王旭静, 王志兴*
中国农业科学院生物技术研究所, 北京 100081
以转基因玉米IE034和12-5为亲本,通过杂交复合获得同时含有cry1Ie、cry1Ab/cry2Aj和G10evo-EPSPs基因的复合性状转基因玉米SW-1。农艺性状检测证明SW-1同时具有抗虫和耐除草剂的特性。通过引物特异性筛选、退火温度和引物浓度等条件优化,建立了SW-1的多重PCR检测体系。多重PCR检测体系所用的内标基因为zSSIIb,反应体积为30 μL,最佳退火温度为62℃,各引物加入量为0.3 μL(10 μmol/L)。利用此多重PCR检测体系,当产品中SW-1的质量百分比超过0.5% 时,目标基因cry1Ie、cry1Ab/cry2Aj和G10evo-EPSPs都能同时被检测出来。研究结果为复合性状转基因玉米SW-1的分子特征检测提供了良好的技术支撑,同时也为含有cry1Ie、cry1Ab/cry2Aj和G10evo-EPSPs基因的其他转化体的多重PCR检测提供了科学数据。
复合性状;抗虫;耐除草剂;转基因玉米;多重PCR检测
复合性状转基因植物是同时含有两个或两个以上的基因或性状的转基因植物。复合性状转基因植物能够同时满足种植者的多元化需求,自问世以来就受到广大农民的喜爱。目前,复合性状已成为转基因植物发展的重要趋势。据ISAAA统计,2015年复合性状转基因植物的种植面积为5 850万hm2,占全球转基因植物种植面积的33%,共有14个国家种植了两个及以上复合性状的转基因植物[1]。当前,批准商业化应用的复合性状转基因植物主要是抗虫抗除草剂和多基因抗虫[2]。
随着转基因植物的大面积推广应用,其安全性问题引起了公众和研究人员的广泛关注。不同国家根据自身国情建立了相应的转基因植物安全管理制度,在保证安全的前提下,使转基因植物充分发挥其优势,带来更大的经济和社会效益。转基因成分检测是转基因植物安全管理的主要内容之一。转基因成分检测主要包括DNA检测和蛋白质检测[3]。在DNA检测中,PCR技术在国际上应用最为广泛,我国玉米、大豆、棉花、油菜等的转基因成分PCR检测也已作为国家标准应用[4~7]。但普通PCR检测技术用于复合性状转基因植物的成分检测时存在一定的不足,如无法同时检测多个目标基因、单个基因的依次检测导致工作量增加和检测成本提高等。因此,在复合性状转基因产品日益增多的情况下,新的检测技术体系的建立具有十分重要的意义和应用前景。
多重PCR在一个反应体系中能同时扩增出多个目标基因片段,因具有快速、灵敏和高通量等优点而受到研究者的关注。目前多重PCR技术不但在疾病诊断和食品检测等领域得到广泛应用[8,9],而且在转基因成分检测领域也得到应用[10~12],如尹全等[13]建立了能同时检测4种转基因玉米的多重PCR体系,Germini等[14]建立了能同时检测4种转基因玉米和1种转基因大豆的多重PCR检测体系。但多重PCR在检测复合性状转基因玉米方面,尤其是能同时检测抗虫基因cry1Ie、cry1Ab/cry2Aj及耐除草剂基因G10evo-EPSPs的多重PCR体系的报道较少。
本研究以抗虫转基因玉米IE034和抗虫耐除草剂转基因玉米12-5为亲本,通过有性杂交获得了同时含有抗虫基因cry1Ie、cry1Ab/cry2Aj及耐除草剂基因G10evo-EPSPs的转基因玉米SW-1,并通过引物筛选和条件优化,建立了同时检测cry1Ie、cry1Ab/cry2Aj和G10evo-EPSPs3个基因和玉米内参基因zSSIIb的多重PCR检测体系,为SW-1的快速检测提供了科学数据和技术支撑。
1 材料与方法
1.1 材料
1.1.1 试验材料 转cry1Ie基因抗虫玉米IE034由中国农业科学院作物科学研究所王国英研究员馈赠;转cry1Ab/cry2Aj和G10evo-EPSPs抗虫耐除草剂转基因玉米12-5由浙江大学沈志成教授馈赠;非转基因玉米郑58为本实验室保存。
供试昆虫:亚洲玉米螟(Ostriniafurnacalis)由中国农业科学院植物保护研究所何康来研究员馈赠。供试除草剂:41%草甘膦异丙胺盐(glyphosate isopropylamine salt)水剂购自美国孟山都公司。
1.1.2 主要试剂 广谱植物基因组DNA快速提取试剂盒购于博迈德生物技术有限公司;2×EasyTaqSuperMix、DNA标准分子量(M)购于北京全式金生物技术有限公司;引物合成由上海生工生化公司完成,其他试剂为分析纯。
1.2 方法
1.2.1 复合性状转基因玉米SW-1的获得 田间分期播种保证两个亲本花期相遇。花期以12-5为母本,以IE034为父本进行杂交,获得同时含有两个抗虫基因和耐除草剂基因的复合性状抗虫耐除草剂转基因玉米SW-1。
1.2.2 转基因玉米基因组DNA提取 利用广谱植物基因组DNA快速提取试剂盒提取玉米基因组DNA,具体操作详见说明书。提取的玉米基因组DNA利用NANODROP 2000C测定浓度和纯度。DNA浓度稀释至25 ng/μL备用。
1.2.3 复合性状转基因玉米SW-1的检测 ①PCR检测。采用转化体特异性引物检测SW-1中3个外源基因的插入位点稳定性。12-5的左侧边界引物SP1/LB-test(304 bp)(序列见表1)、右侧边界引物R1/RB-test(350 bp),PCR反应体系为:2×EasyTaqSuperMix 15 μL,正向、反向引物各0.5 μL(10 μmol/L),模板DNA 2 μL(25 ng/μL),加ddH2O至30 μL。PCR条件是:95℃ 5 min;95℃,45 s,65℃,50 s,72℃,30 s,共32个循环;72℃ 7 min(已申请专利:CN 104946631 A)。IE034的左侧边界引物IE034F/IE034R(314 bp),PCR反应体系为:2×EasyTaqSuperMix 15 μL,正向、反向引物各0.5 μL(10 μmol/L),模板DNA 2 μL(25 ng/μL),加ddH2O至30 μL。PCR条件是:95℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 1 min,共35个循环;72℃ 7 min(已申请专利:CN102604940 A)。
②农艺性状检测。以复合性状转基因玉米SW-1为试验材料,12-5和非转基因玉米Z58为对照。所用试剂为41%草甘膦异丙胺盐水剂,4~6叶期对转基因玉米和非转基因玉米材料喷施除草剂草甘膦,喷施浓度为推荐使用浓度的2倍,即0.4%。喷施7 d后观察玉米表型变化。

表1 本研究所用引物
以复合性状转基因玉米SW-1为试验材料,IE034、12-5和非转基因玉米Z58为对照。在室内可控条件下开展转基因玉米抗虫性鉴定试验,取V6期新鲜心叶组织,将不同品种样品清洗干净后分别放置于培养皿中,每平皿接20头待测品系的初孵幼虫,每个培养皿为1个处理,每个处理设4次重复。放置在温度28℃,相对湿度80%,光周期16:8 (L:D)的人工气候培养箱中培养。接种幼虫2 d 后,开始统计幼虫的存活情况,根据组织被取食消耗情况更换相同来源的新组织。采用t检验进行差异显著性分析。
1.2.4 复合性状转基因玉米SW-1多重PCR检测体系的建立 ①引物特异性检测。PCR检测中采用的内标基因为编码玉米淀粉合酶异构体ZSTSⅡ-2的基因zSSIIb,所用引物(表1)和反应程序均参照国家标准《转基因植物及其产品成分检测玉米内标准基因定性PCR方法》(农业部1861号-3-2012)[15]。目标基因的引物设计原则为:3′端要避免发生碱基配对,当3′端发生聚合现象时,其︱△G︱尽量控制在8.0以内[16];为保证在琼脂糖凝胶电泳中能够清晰的分辩不同条带,当PCR 产物片段大小在 200 bp 以内时,片段大小之间的差异应大于30 bp,片段大小在500 bp以上时,差异要大于70 bp[17]。依据目标基因的DNA序列设计了相应的检测引物,具体见表1。各检测引物浓度稀释至10 μmol/L备用。
以复合性状转基因玉米SW-1、亲本IE034和12-5、非转基因玉米郑58基因组DNA为模板,分别利用目标基因对应的引物对进行PCR扩增(引物序列见表1)。PCR反应体系为: 2×EasyTaqSuperMix 15 μL,正向引物和反向引物各0.5 μL(10 μmol/L),模板DNA 2 μL(25 ng/μL),加ddH2O至30 μL。扩增程序为95℃ 3 min;95℃ 30 s,62℃ 30 s,72℃ 30 s,30个循环;72℃ 5 min,4℃保存。PCR反应结束后,取5 μL反应产物用1%琼脂糖凝胶电泳,利用凝胶成像系统分析每对引物的特异性。
②多重PCR退火温度的优化。以复合性状转基因玉米SW-1、亲本IE034和12-5、非转基因玉米郑58基因组DNA为模板进行PCR扩增,扩增时在PCR反应体系中同时加入扩增基因zSSIIb、cry1Ie、cry1Ab/cry2Aj和G10evo-EPSPs的引物对(引物见表1),引物的浓度为0.17 μmol/L,反应体系为(30 μL):2×EasyTaqSuperMix 15 μL,各引物对正向、反向引物各0.5 μL(10 μmol/L),模板DNA 2 μL(25 ng/μL),加ddH2O至30 μL。扩增程序为:95℃预变性3 min;95℃ 30 s,退火温度(设置不同梯度65℃、64℃、63℃、62℃、61℃、60℃、59℃、58℃)30 s,72℃ 30 s,30个循环;72℃ 5 min。PCR产物用3%琼脂糖凝胶电泳进行结果分析,选择特异性好、扩增效率一致的温度为最佳退火温度。
③多重PCR引物浓度的优化。复合性状转基因玉米SW-1、亲本IE034和12-5、非转基因玉米郑58基因组DNA为模板进行PCR扩增,扩增时在PCR反应体系中同时加入扩增基因zSSIIb、cry1Ie、cry1Ab/cry2Aj和G10evo-EPSPs的引物对,按照表2中所示的比例设置引物浓度梯度,反应体系为(30 μL):2× EasyTaqSuperMix 15 μL,各引物对体积比见表2(10 μmol/L),模板DNA 2 μL(25 ng/μL),加ddH2O至30 μL。退火温度为62℃,其余扩增程序与②相同。PCR产物用3%琼脂糖凝胶电泳进行分析,筛选出特异性好、扩增效率一致的浓度为最适引物浓度配比。
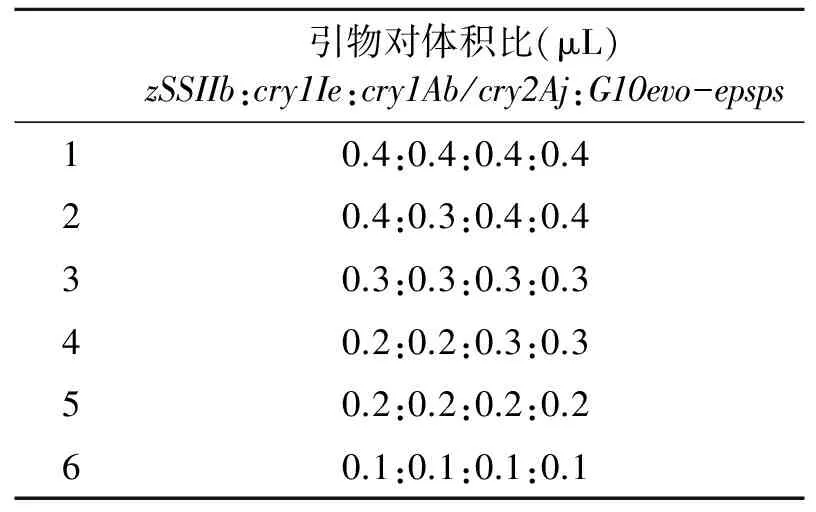
表2 30 μL反应体系中不同引物对的体积配比
④多重PCR方法灵敏度检测。将SW-1和非转基因玉米郑58的DNA稀释到相同浓度25 ng/μL,按质量比混合,制备成SW-1基因组质量分数为50%、10%、5%、1%、0.5%、0.1%、0.05%等7份不同比例的样品,根据已经优化好的PCR反应体系进行扩增。
1.2.5 样品检测 采用优化好的多重PCR反应体系,对已知样品进行验证,确定所建体系的特异性。
2 结果与分析
2.1 复合性状转基因玉米SW-1检测结果
2.1.1 PCR检测结果 在田间同时播种SW-1、12-5、IE034、郑58,取4~6叶期的叶片,用转化体特异性引物检测插入位点的稳定性。图1结果表明:转基因玉米IE034和复合性状转基因玉米SW-1均扩增出目的大小为314 bp的条带,阴性对照和空白对照未出现特异性条带,条带7为非特异性条带;复合性状转基因玉米SW-1能够扩增出350 bp、304 bp大小的特异性条带,其大小与阳性对照12-5一致。阴性对照和空白对照未出现特异性条带。该结果说明复合性状转基因玉米SW-1 同时含有3个目的基因且插入位点未发生改变。

图1 转化体特异性检测引物扩增图谱Fig.1 The amplification of specific detection for transformant.M:DNA Marker(2 000 bp);1~4:转基因玉米IE034右侧边界;5~8:转基因玉米12-5左侧边界;9~12:转基因玉米12-5右侧边界。1:转基因玉米IE034;2、6、10:复合性状转基因玉米SW-1;3、7、11:非转基因玉米郑58;5、9:转基因玉米12-5;4、8、12:阴性对照。
2.1.2 抗虫抗除草剂检测结果 在4~6叶期,对转基因玉米12-5、复合性状转基因玉米SW-1和非转基因玉米郑58进行除草剂草甘膦喷施处理,结果见图2(彩图见图版一)。本实验喷施浓度为推荐使用浓度的2倍即0.4%,喷施7 d 后观察表型:转基因玉米12-5和复合性状转基因玉米均能正常生长,且无明显变化,非转基因玉米出现病害,受害率为100%。表明杂交后的复合性状转基因玉米SW-1具有除草剂耐性。

图2 喷施2倍除草剂后田间植株除草剂耐性Fig.2 Herbicide-tolerance of transgenic maize after spraying 2 times glufosinate-ammonium in the field.(彩图见图版一)
室内生测法试验结果表明(表3),亚洲玉米螟幼虫取食转基因玉米IE034和复合性状转基因玉米SW-1 V6期玉米心叶片3 d后存活率明显降低;取食非转基因玉米对照郑58心叶,亚洲玉米螟幼虫存活率变化不大。 4 d后取食转基因玉米IE034和复合性状转基因玉米SW-1心叶的亚洲玉米螟幼虫4 d后存活率为0.00,全部死亡;而取食非转基因对照郑58的亚洲玉米螟幼虫4 d后存活率为0.80。结果表明,复合性状转基因玉米SW-1具有抗虫性。

表3 亚洲玉米螟幼虫取食不同样品的存活率
注:表中数据代表平均数±标准误,同一列数据后不同小写字母表示P<0.05 水平上差异显著。
2.2 多重PCR体系的建立与优化
2.2.1 DNA质量分析 样品总DNA提取采用广谱植物基因组DNA快速提取试剂盒,通过NANODROP 2000C(Thermo scientific)分光光度计测定浓度及质量。结果表明,所有样品浓度都大于25 ng/μL,且OD260/OD280范围介于1.8~2.0,OD260/OD230大于2.0。用提取的DNA进行玉米内参基因zSSIIb的扩增,在所有的玉米材料中均扩增出151 bp大小的目的条带,表明提取的玉米基因组DNA满足转基因植物PCR检测的要求(图3)。

图3 玉米内参基因zSSIIb扩增图谱Fig.3 The amplification of reference gene zSSIIb.M:DNA Marker;1:转基因玉米IE034;2:转基因玉米12-5;3:复合性状转基因玉米SW-1;4:非转基因玉米郑58;5:阴性对照。
2.2.2 引物特异性分析 引物的特异性是影响PCR检测的主要因子之一,本研究通过对设计的系列引物进行筛选,发现引物对IE-1-F/R、Ab-1-F/R、G10-1-F/R分别扩增目标基因cry1Ie、cry1Ab/cry2Aj和G10evo-EPSPs时特异性非常好,没有杂带,而且扩增效率很高,可用于多重PCR检测体系(图4)。
2.2.3 多重PCR反应条件优化 在不同退火温度下,内标基因zSSIIb、3个目标基因cry1Ie、cry1Ab/cry2Aj和G10evo-EPSPs都能有效扩增,但随温度升高,基因zSSIIb、cry1Ie和cry1Ab/cry2Aj的扩增效率明显降低,温度降低时,基因G10evo-EPSPs的扩增效率逐渐降低(图5)。因此考虑所有目的条带的扩增效率和单基因扩增时的退火温度,选择62℃作为多重PCR反应时的最佳退火温度。
在多重PCR扩增时,引物的浓度也是影响扩增效率的一个重要因子。经过引物浓度梯度试验,发现在30 μL反应体系中,加入不同体积的引物,扩增结果明显不同,引物浓度过低或引物对间配比不合适,都会导致目标基因的扩增效率不一致或不能同时扩增到4个基因。如图6所示,当扩增内标基因zSSIIb、目标基因cry1Ie、cry1Ab/cry2Aj和G10evo-EPSPs引物对的体积均为0.3 μL和0.4 μL时,4个基因都能得到很好的扩增,而且没有非特异条带出现。考虑到引物浓度增加可能会导致引物二聚体的产生,认为在30 μL反应体系中,扩增内标基因zSSIIb、目标基因cry1Ie、cry1Ab/cry2Aj和G10evo-EPSPs的引物对的最佳体积均为0.3 μL。

图4 单一目标基因的PCR检测Fig.4 The amplification of single target gene.A:cry1Ie;B:G10evo-EPSPs;C:cry1Ab/cry2Aj;M:DNA Marker;1:转基因玉米IE034;2:转基因玉米12-5;3:复合性状转基因玉米SW-1;4:非转基因玉米郑58;5:阴性对照。

图5 不同退火温度下目标基因的扩增Fig.5 Target gene amplification at different annealing temperature.M:DNA Marker;1~8:退火温度65℃、64℃、63℃、62℃、61℃、60℃、59℃、58℃;9:Z58;10:空白对照。

图6 不同引物对体积比下的目标基因扩增Fig.6 Target gene amplification at different volume ratio of primer pair.M:DNA Marker;1~6:引物对体积比0.4:0.4:0.4:0.4, 0.4:0.3:0.4:0.4, 0.3:0.3:0.3:0.3, 0.2:0.2:0.3:0.3, 0.2:0.2:0.2:0.2, 0.1:0.1:0.1:0.1;7:Z58;8:阴性对照。
2.2.4 灵敏度检验 为验证多重PCR检测体系的灵敏度,将SW-1基因组DNA与同浓度的非转基因玉米郑58基因组DNA按质量比混合,制备成50%、10%、5%、1%、0.5%、0.1%、0.05%的DNA样品,采用优化后的反应体系和条件进行PCR扩增,结果发现只要样品中含有0.5%以上的SW-1转基因成分,利用此体系都能稳定的检测出3个目标基因(图7),证明本试验建立的多重PCR检测体系所达到的灵敏度可达0.5%。
2.3 已知样品的验证
采用此多重PCR体系检测复合性状基因玉米SW-1、转基因亲本12-5和IE034、非转基因受体。结果表明,复合性状转基因玉米SW-1能同时扩增出cry1Ie、cry1Ab/cry2Aj和G10evo-EPSPs的目的条带;转基因亲本IE034能够扩增出cry1Ie基因的目的条带;12-5能够扩增出cry1Ab/cry2Aj、G10evo-EPSPs基因的目的条带;对于非转基因玉米仅有内参基因的扩增(图8)。此结果进一步验证了该试验建立的多重PCR检测方法的特异性及可靠性。

图7 多重PCR灵敏度检测Fig.7 The amplification of sensitivity test.M:100 bp DNA Marker;1~7:SW-1的质量分别为:50%、10%、5%、1%、0.5%、0.1%、0.05%;8:非转基因玉米郑58。

图8 已知样品的验证Fig.8 Validation of known sample.M:DNA Marker(100 bp);1:转基因玉米IE034;2:转基因玉米12-5;3、4:复合性状转基因玉米SW-1;5:非转基因玉米郑58;6:空白对照。
3 讨论
多重 PCR在一个反应中同时完成多个基因的扩增,是一种简便快捷的DNA检测方法,最早是由Chamberlain等[18]在1988年提出的,用于诊断杜氏肌营养不良症。与常规PCR相比,多重PCR的反应体系涉及到多对引物,容易导致引物二聚体、错配、非特异性扩增等现象,从而降低了扩增效率[19]。因此,在建立多重PCR反应体系时,首先需要对反应体系和反应条件两部分进行优化[13,20]。反应体系主要包括引物、缓冲液、Taq酶、模板等。反应条件包括退火温度、循环数等。
建立多重PCR反应体系的前提是筛选到特异性高的引物。一般而言,引物的退火温度越高、引物越长,其特异性就更好。因此,建议设计的引物解链温度在65℃以上,GC含量在50%~60%,避免3′端出现超过3个连续的G或C,引物对解链温度相似并避免互补序列[17,21]。依据此原则,本研究设计了多对引物,并筛选得到了特异性良好的引物对。因此,建议在进行多重PCR检测时,应多设计几对引物,并相互结合,最终才能筛选出特异性好的引物,为后续工作奠定坚实基础。
引物浓度是影响多重PCR扩增效率的重要因素之一。如果多重PCR反应体系中添加与单基因PCR相同的引物量,则会导致引物浓度过高而出现扩增效率低和引物二聚体明显等问题。因此,多重PCR反应体系中各引物对的用量要比单基因PCR少。李忆等[22]发现,P-CaMV 35S和T-NOS两个基因的多重PCR检测时的最适引物配比为0.2∶0.2,当多重PCR检测P-CaMV 35S、P-ract1、T-NOS、bar、pat、PMI6个基因时,反应体系中引物的最适配比为0.2∶0.1∶0.1∶0.1∶ 0.1∶0.05。同样,在本研究中也发现,多重PCR检测体系中所需的引物对浓度低于单基因PCR扩增。通过不同引物浓度的配比来摸索合适的反应体系,发现在引物浓度为10 μmol/L的初始浓度下,30 μL反应体系中内标基因zSSIIb、目标基因cry1Ie、cry1Ab/cry2Aj和G10evo-EPSPs的引物对的最佳体积为0.3∶0.3∶0.3∶0.3,比单基因PCR扩增时的引物体积减少了0.2 μL。
在复合性状转基因植物的安全评价中,所有亲本的外源基因是否在杂交后代中稳定遗传是研究者和管理者共同关注的问题之一,建立适宜的检测方法是解决问题的关键。单基因PCR检测已不能满足复合性状转基因植物检测的需求,如对于含有8个基因的复合性状转基因植物玉米SmartStaxTM,单基因PCR检测耗时、费力、增加成本。多重PCR检测为复合性状转基因植物检测提供了新的思路,本研究结果和数据为多重PCR检测在复合性状转基因植物上的应用提供了技术支撑。
[1] James C. 2015年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志, 2016,36(04): 1-11.
[2] 王旭静, 张 欣, 刘培磊, 等. 复合性状转基因植物的应用现状与安全评价[J]. 中国生物工程杂志,2016,36(04):18-23.
[3] 张富丽, 雷绍荣, 刘 勇. 转基因作物及加工品检测技术概述[J]. 生物技术通讯, 2009, 20(5):733-737.
[4] 中华人民共和国农业部. 转基因植物及其产品成分检测抗虫耐除草剂玉米59122及其衍生品种定性PCR方法[S]. 北京:中国标准出版社, 2010.
[5] 中华人民共和国农业部. 转基因植物及其产品成分检测耐除草剂大豆 MON87708 及其衍生品种定性PCR方法[S]. 北京:中国标准出版社, 2015.
[6] 中华人民共和国农业部. 转基因植物及其产品成分检测耐除草剂油菜 MON88302 及其衍生品种定性PCR方法[S]. 北京:中国标准出版社, 2015.
[7] 中华人民共和国农业部. 抗虫玉米IE09S034及其衍生品种定性PCR方法[S]. 北京:中国标准出版社, 2015.
[8] 赵红庆, 苑锡铜, 黄留玉. 多重PCR技术在病原检测中的应用[J]. 生物技术通讯, 2007, 18(5): 863-865.
[9] 张玉霞, 黄 鸣. 食品检验中多重PCR技术的应用[J]. 中国卫生检验杂志, 2008, 18(5): 958-960.
[10] 刘光明, 苏文金, 梁基选, 等.多重PCR方法检测食品中转基因成分[J].食品与生物技术学报,2002,21(4):379-383.
[11] 邵碧英, 江树勋, 陈文炳,等. 番茄、甜椒中转基因成分和内源基因的多重PCR检测方法的建立[J]. 食品科学, 2004, 25(10):219-223.
[12] 陈文炳, 邵碧英, 李寿崧, 等. 应用多重PCR同时检测多种转基因成分[J]. 检验检疫学刊, 2002, 12(3):11-13.
[13] 尹 全, 李 忆, 宋 君,等. 四种转基因玉米多重PCR检测方法的建立[J]. 湖北农业科学, 2016, 55(6):1540-1544.
[14] Germini A, Zanetti A, Salati C,etal.. Development of a seven-target multiplex PCR for the simultaneous detection of transgenic soybean and maize in feeds and foods.[J]. J. Agric. Food Chem., 2004, 52(11):3275-3280.
[15] 中华人民共和国农业部. 转基因植物及其产品成分检测玉米内标准基因定性PCR 方法[S]. 北京:中国标准出版社,2012.
[16] Morie N, Tomohiro Y, Somako T,etal.. Genotyping of human papillomaviruses by a novel one-step typing method with multiplex PCR and clinical applications[J]. Clin. Microbiol., 2008, 46(4): 1161-1168.
[17] 陈 贞, 芦春斌, 杨梦婕, 等. 多重PCR检测转基因菜籽粕中的转基因成分[J]. 植物检疫, 2011, 25(3):35-38.
[18] Chamberlain J S, Gibbs R A, Rainer J E,etal.. Deletion screening of the Duchenne muscular dystrophy locus via multiplex DNA amplification[J]. Nucl. Acids Res., 1988, 16(23): 11141-11156.
[19] 刘志杰, 李如举, 曾智勇, 等. 多重PCR反应的影响因素及其优化[J]. 黑龙江畜牧兽医, 2011, 13(7): 26-28.
[20] Liu Z, Gao Q, Wang R,etal.. Application of multiplex PCR to studies on plant biology[J]. Mol. Plant Breed., 2005, 2(3): 261-268.
[21] 王 稳, 屈武斌, 申志勇, 等. 利用MPprimer设计引物并优化扩增条件以提高多重PCR效率的实验研究[J]. 生物化学与生物物理进展, 2010, 37(03): 342-346.
[22] 李 忆, 尹 全. 基于MPCR法检测抗虫与耐除草剂转基因玉米Bt1[J]. 贵州农业科学, 2016, 44(6): 48-52.
Target Trait Test and Multiple PCR Detection of Insect-resistance and Herbicide Tolerance Transgenic Maize SW-1
ZHANG Xin, DONG Yufeng, WANG Xujing, WANG Zhixing*
BiotechnologyResearchInstitute,ChineseAcademyofAgriculturalSciences,Beijing100081,China
Stacked transgenic maize SW-1 containingcry1Ie,cry1Ab/cry2AjandG10evo-EPSPs, was cultivated by hybridization using transgenic maize IE034 and 12-5 as parents. Agronomic traits test showed that SW-1 had the characteristics of insect-resistance and herbicide tolerance. The multiplex PCR detection system was established by optimizing specific primers, annealing temperature and primer concentration. Multiplex PCR detection system used an endogenous reference genezSSIIb, the reaction volume was 30 μL, the best annealing temperature was 62℃ and the amount of each primer was 0.3 μL (10 μmol/L ). Using this multiplex PCR detection system, the target genecry1Ie,cry1Ab/cry2AjandG10evo-EPSPscan simultaneously be detected, when the mass percentage of SW-1 in the product was more than 0.5%. The results provided a good technical support for the molecular detection of stacked genetically modified maize SW-1. Meanwhile, this study provided scientific data for multiplex PCR detection of other transformation containingcry1Ie、cry1Ab/cry2AjandG10evo-EPSPsgenes.
stack trait; insect-resistance; herbicide-tolerance; transgenic maize; multiplex PCR detection
2016-12-16; 接受日期:2017-02-14
国家转基因新品种培育重大专项(2014ZX08011-04B)资助。
张欣,硕士研究生,主要从事转基因安全研究。E-mail:zhangxin2014916@sina.com。*通信作者:王志兴,研究员,研究方向为转基因生物安全。E-mail:wangcotton@126.com
10.19586/j.2095-2341.2016.0160

