意大利蝗血蓝蛋白亚基Ⅰ基因的克隆与原核表达
王 頔, 张 早, 王张平, 印 红
河北大学生命科学学院, 河北省动物系统学与应用重点实验室, 河北 保定 071002
意大利蝗血蓝蛋白亚基Ⅰ基因的克隆与原核表达
王 頔, 张 早, 王张平, 印 红*
河北大学生命科学学院, 河北省动物系统学与应用重点实验室, 河北 保定 071002
昆虫血蓝蛋白是在昆虫体内普遍存在的一种含Cu2+的多功能蛋白,除参与呼吸外还具有能量贮存、抗菌和抗病毒等多种生物学功能。为了研究意大利蝗(Calliptanusitalicus)血蓝蛋白亚基CitHc-1的结构和表达,通过RACE技术获得了CitHc-1的全长cDNA(2 335 bp)序列,其中开放阅读框2 079 bp,编码692个氨基酸,预测蛋白分子量79.88 kDa。序列比对结果显示CitHc-1基因cDNA序列与蝗总科其他物种血蓝蛋白亚基Ⅰ的cDNA序列的相似性为91%~94%。利用MEGA的NJ法构建昆虫纲血蓝蛋白亚基Ⅰ系统发育树,结果显示意大利蝗CitHc-1与东亚飞蝗LmiHc-1血蓝蛋白遗传距离最近形成姐妹群。为了研究血蓝蛋白的结构和功能,成功构建了意大利蝗CitHc-1基因活性区域的原核表达载体。融合蛋白pEASY-E1-Hc分子量约为32 kDa,与预期值一致,为进一步分析意大利蝗C.italicusCitHc-1的功能提供了理论基础。
意大利蝗;血蓝蛋白亚基Ⅰ;基因克隆;表达分析;原核表达
血蓝蛋白是位于节肢动物和软体动物血淋巴中含铜的呼吸蛋白,脱氧状态为无色,结合氧状态为蓝色[1]。血蓝蛋白除载氧之外,还参与能量贮存、渗透压的维持以及蜕皮过程的调节,是一种多功能蛋白[2,3]。近年来的研究表明,血蓝蛋白还具有酚氧化物酶活性和抗菌功能[4],在节肢动物和软体动物体液免疫等生命活动中扮演重要角色。
最近几年的研究表明,血蓝蛋白广泛存在于昆虫中[5~8]。在弹尾纲(Collembola)、石蛃目 (Archaeognatha)、直翅目(Orthoptera)和蜚蠊目(Blattodea)等多种六足动物中发现了血蓝蛋白。
节肢动物血蓝蛋白的基本结构为六聚体,或由多个六聚体组成[9,10]。一个典型的节肢动物血蓝蛋白亚基的大小约为70~80 kDa,一般包含630~660个氨基酸,结构分为三级[11,12]。第一个结构域包括N端的150~180个氨基酸,主要由α螺旋组成,并通过超二级结构形成稳定的螺旋束;第二个结构域为α螺旋区,螯合1对Cu2+,这两个铜离子为血蓝蛋白结合O2所必需;第三个结构域主要由β折叠结构组成,进一步折叠为超二级结构而形成反平行的7股β桶结构[11,12]。研究表明,血蓝蛋白广泛存在于昆虫中,但目前相关直翅目昆虫血蓝蛋白的研究非常少,迄今有Yin等[13]获取了东亚飞蝗(Locustamigratoriamanilensis) Hc1的完整序列,张新新等[14]构建了东亚飞蝗血蓝蛋白亚基Ⅰ基因的原核表达并预测了其蛋白结构。
意大利蝗(Calliptanusitalicus),属于节肢动物门,昆虫纲(Insecta),直翅目(Orthoptera),蝗总科(Acridoidea),斑腿蝗科(Acridoidea),星翅蝗属(Calliptamus)[15]。主要分布于新疆及周边国家和地区[16]。其取食范围达17科45种植物,喜食冷蒿、新疆鼠尾草、黄花苜蓿等,每年给当地的畜牧业经济、生态和社会造成严重损失[17]。本研究选取意大利蝗为实验材料,通过RACE技术获得CitHc-1基因全长cDNA序列,进而构建CitHc-1的原核表达载体,重组质粒转化到大肠杆菌BL21 (DE3) 表达系统中,SDS-PAGE 电泳表明,经过 IPTG 诱导,目的基因可以高效表达[18]。同时预测了CitHc-1蛋白的高级结构,以期进一步探讨直翅目昆虫血蓝蛋白的功能和作用机理,进而为害虫的综合治理以及昆虫资源的开发利用提供分子依据。
1 材料与方法
1.1 材料
1.1.1 供试昆虫 意大利蝗卵由山东农业大学植保学院刘玉升教授惠赠,后由本实验室参照Gillespie等[19]的方法人工饲养。
1.1.2 主要试剂 pEASYTM-T3 Cloning试剂盒、EasyPureTMPCR Purification试剂盒和TransScriptTMFirst-Strand cDNA Synthesis SuperMix购于北京全式金生物技术有限公司。LATaq酶、T4 DNA Ligase、RNAiso plus试剂盒、3′-full RACE Core Set Ver.2.0和5′-full RACE试剂盒购于TaKaRa公司。
1.2 意大利蝗CitHc-1基因的扩增及序列分析
1.2.1 总RNA的提取及cDNA第一链的合成 利用液氮将孵育24 h的意大利蝗卵冷冻,按照RNAiso Plus试剂盒说明提取总RNA,采用反转录试剂盒TransScriptTMFirst-Strand cDNA Synthesis SuperMix合成 cDNA。

表1 本研究所用引物
注: W=A/T, R=A/G, Y=C/T。
1.2.2CitHc-1基因引物的设计及PCR扩增 利用已经在Genbank上发表的东亚飞蝗血蓝蛋白基因序列(登录号:HQ213937),设计引物(表1),以cDNA为模板扩增该基因保守片段,共3段, 分别为677 bp、500 bp和869 bp。PCR反应体系如下:10×PCR Buffer 2.5 μL,2.5 mmol/L dNTP 2 μL,LATaq酶0.5 μL,10 μmol/L引物Hem-F 0.5 μL,10 μmol/L引物Hem-R 0.5 μL,模板cDNA 2 μL,加ddH2O至25 μL。PCR反应条件为:94℃ 1 min;94℃ 30 s,62℃(由引物Tm决定)30 s,72℃ 1 min,30个循环;72℃延伸10 min。由深圳华大基因科技有限公司对其产物进行测序。利用已经得到的意大利蝗血蓝蛋白部分片段,分别设计5′和3′RACE的引物序列(5-O、5-I、3-O、3-I)见表1,并按照试剂盒推荐的反应体系和反应条件进行CitHc-1基因3′端和5′端序列的扩增,回收目的片段,克隆后测序。
1.2.3 序列分析及系统发育分析 在利用BioEdit生物学软件对其序列进行同源性分析之前,先利用ORF finder软件(http://www.ncbi.nlm.nih.gov/projects/gorf/)分析完整的开放阅读框并应用SignalP软件(http://www.cbs.dtu.dk/services/SignalP/)推测信号肽;对其完整基因序列以及推断的氨基酸序列使用在线生物软件RANSLATE (ExPASy Proteomics Server)进行组分、理化性质等生物信息学分析;血蓝蛋白亚基Ⅰ的结构域通过NCBI上的CD Search(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行预测分析;通过软件SWISS-MODEL(http://swiss model. expasy.org/)推测蛋白质三级结构,此处主要采用同源建模方法。应用ClustalX 1.81软件和MEGA4.0软件中的邻接法(neighbor-joining,NJ)对意大利蝗血蓝蛋白亚基Ⅰ与昆虫纲其他多个物种血蓝蛋白亚基Ⅰ构建分子系统发生树,并重复抽样1 000次进行Bootstrap检验。
1.3 意大利蝗CitHc-1蛋白的原核表达
1.3.1CitHc-1活性区域的克隆 根据所得到的意大利蝗血蓝蛋白基因CitHc-1序列设计用于扩增其活性区域的引物Hc-F/Hc-R,引物序列见表1。以cDNA为模板,Hc-F/Hc-R为引物,PCR扩增CitHc-1的活性区域。反应体系如下:2×GC BufferⅠ10 μL,2.5 mmol/L dNTP1.6 μL,LATaq酶0.2 μL,10 μmol/L引物Hc-F 1 μL,10 μmol/L引物Hc-R1 μL,模板cDNA 2 μL,ddH2O至20 μL。PCR反应条件:94℃ 3 min;94℃ 30 s,55℃(由引物Tm决定)30 s,72℃ 1 min,共30个循环;72℃延伸10 min。将切胶回收纯化后的目的片段于表达载体pEASYTM-E1进行TA连接。重组载体命名为pEASY-E1-Hem。
1.3.2CitHc-1原核表达载体的构建 将测序正确的阳性重组质粒转入表达宿主菌BL21(DE3)感受态细胞中。对在Amp的平板上筛选出来的阳性重组子进行DNA测序分析,并将其命名为pEASY-E1-Hc/BL21(DE3)。
1.3.3 重组蛋白的诱导表达 把重组子接种于LB培养基(含Ampicilin)中,37℃过夜培养,然后取0.2 mL菌液接种于5 mL新培养基(含Ampicilin)中,37℃ 220 r/min继续培养至OD600≈0.6,取1 mL菌液于1.5 mL的离心管中,离心弃上清,收集菌体作为对照。在剩下的菌液中加入IPTG至终浓度为1 mmol/L,继续培养3 h,然后取1 mL菌液,离心弃上清收集菌体沉淀,使其悬浮于0.01 mol/L PBS缓冲液中。随后进行超声破碎,将完全变至澄清的菌液10 000 r/min离心3 min,收集上清和沉淀。最后,分别取全菌液、上清和沉淀的样品进行 SDS-PAGE 电泳,以检测表达产物的可溶性。
2 结果与分析
2.1CitHc-1基因的克隆和序列分析
将利用RT-PCR和RACE技术克隆得到的CitHc-1基因全长,录入GenBank数据库,序列登录号为JX204834。CitHc-1基因全长为2 335 bp,包含1个2 079 bp的完整开放阅读框(ORF)和1个256 bp 3′-UTR,编码692个氨基酸。将所得序列通过SignalP 4.1软件进行信号肽分析,结果显示其蛋白质N端具有19个氨基酸的信号肽,预测为分泌型蛋白。将意大利蝗血蓝蛋白亚基ⅠCitHc-1序列输入到NCBI上的CD Search上,结果显示CitHc-1含有节肢动物血蓝蛋白家族蛋白所具有的3个结构域(图1,彩图见图版一)。经Blastn分析发现,意大利蝗血蓝蛋白亚基Ⅰ基因与东亚飞蝗血蓝蛋白亚基Ⅰ的一致性最高,达94.0%。
意大利蝗CitHc-1蛋白的理论分子量是79.88 kDa,理论PI为6.12;从氨基酸组成上看,意大利蝗CitHc-1富含Leu 9.1%、Val 8.1%、Glu 6.9%、Alg 6.8%、Asp 6.6%、Pro 6.1%。对意大利蝗CitHc-1蛋白三级结构进行预测,结果显示其结构为混合型,由α螺旋和β折叠以及无规则卷曲构成(图2,彩图见图版二)。

图1 CitHc-1蛋白功能结构域Fig.1 The conserved domain of CitHc-1 protein.(彩图见图版一)
2.2 同源性分析及系统发育树的构建
将意大利蝗CitHc-1基因序列与GenBank数据库中已知的蝗总科昆虫血蓝蛋白亚基Ⅰ基因进行比对,做同源性分析。结果表明,该基因与其他蝗总科昆虫血蓝蛋白亚基Ⅰ基因的同源性达到91%~94%,确定所得序列为血蓝蛋白亚基Ⅰ基因。
以弹尾纲血蓝蛋白亚基Ⅰ作为外群,选取昆虫纲10目11物种,利用MEGA软件包中的NJ法基于p-distance模型构建昆虫纲血蓝蛋白亚基Ⅰ系统发育树(图3)。结果表明:昆虫纲为单系群,其中有翅亚纲(直翅目、竹节虫目、蜚蠊目、等翅目、襀翅目、螳螂目、革翅目)与无翅亚纲的衣鱼目形成姐妹群。无翅亚纲的石蛃目为昆虫纲原始的类群。直翅目为单系群,意大利蝗与东亚飞蝗形成姐妹群。

图2 CitHc-1蛋白三级预测结构Fig.2 The predicted tertiary structure of CitHc-1.(彩图见图版二)
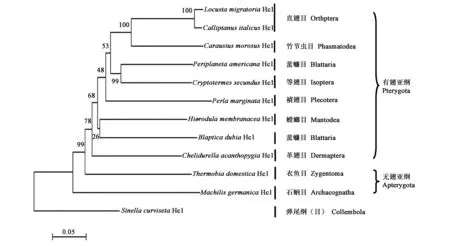
图3 昆虫血蓝蛋白的分子系统进化树Fig.3 Molecular phylogeny of insect hexamerins.注:东亚飞蝗 Locusta migratoria Hc1 HQ213937; 意大利蝗Calliptanus italicus Hc1 JX204834; Carausius morosus Hc1 FM242640; 美洲大蠊 Periplaneta americana Hc1 FM242648; Cryptotermes secundus Hc1 FM242644; Perla marginata Hc1 AJ555403; 勇斧螳螂 Hierodula membranacea Hc1 FM242642; 杜比亚蟑螂 Blaptica dubia Hc1 FM242646; 棘燕球螋 Chelidurella acanthopygia Hc1 FM242641; 小灶衣鱼 Thermobia domestica Hc1 FM165288; Machilis germanica Hc1 FM242639; 曲毛裸长角跳虫 Sinella curviseta Hc1 FM242638。
2.3 CitHc-1蛋白的原核表达分析
将含有重组质粒的表达菌在终浓度为1 mmol/L的IPTG诱导3 h后,收集菌体沉淀,加入2×SDS上样缓冲液,进行SDS-PAGE电泳检测,结果可见相对分子量32 kDa处(pEASY-E1-Hc)有1条明显的蛋白条带,与预计的融合蛋白分子量大小基本相符,电泳结果如图4A所示。
利用超声对全菌液破碎,分别取诱导前、诱导后、上清和沉淀的样品进行 SDS-PAGE 电泳。可以看出:目的蛋白大部分在沉淀中表达,以包涵体形式存在,结果如图4B所示。

图4 重组蛋白CitHc-1的SDS-PAGE电泳分析和可溶性分析Fig.4 SDS-PAGE analysis and soluble analysis of CitHc-1 protein.注:A. M:protein marker;1:空载未诱导;2:空载诱导;3:pEASY-E1-Hc重组未诱导;4:pEASY-E1-Hc重组诱导;B. M:protein marker;1:pEASY-E1-Hc重组菌液未诱导;2:pEASY-E1-Hc重组菌超声破碎后全菌液;3:pEASY-E1-Hc重组菌超声破碎后上清;4:pEASY-E1-Hc重组菌超声破碎后沉淀。
3 讨论
本研究通过RT-PCR和RACE技术,获得了全长为2 335 bp的CitHc-1基因cDNA序列,其中开放阅读框(ORF)长度为2 079 bp。与LmiHc-1氨基酸序列的一致性高达98%。CitHc-1基因编码的蛋白具有可逆结合氧气的必需组件——6个结合Cu2+的组氨酸位点, 蛋白的二级结构为α螺旋、β折叠、无规则卷曲的混合型。大部分昆虫纲血蓝蛋白基因的cDNA长度都在2 000~2 600 bp之间,昆虫纲血蓝蛋白基因亚基Ⅰ编码的氨基酸在650~750之间, 意大利蝗血蓝蛋白亚基Ⅰ氨基酸序列与昆虫纲其他物种的血蓝蛋白亚基Ⅰ氨基酸序列相似性为56%~98%,以上数据均表明血蓝蛋白基因亚基Ⅰ在进化过程中相对比较保守;同时,核苷酸和氨基酸二者的差异性,也体现了该基因在进化过程中的变异性[8]。蛋白结构N端有19个氨基酸的信号肽,根据Pick等[8]的研究,这是所有昆虫血蓝蛋白行使呼吸功能所必需的结构。
以弹尾纲为外群,选取昆虫纲10目11物种构建昆虫纲血蓝蛋白亚基Ⅰ的分子系统进化树,系统发育分析显示,昆虫纲为单系群。有翅亚纲与无翅亚纲的衣鱼目形成姐妹群,无翅亚纲的石蛃目为最原始类群,与形态分类的研究结果一致[20],说明血蓝蛋白亚基Ⅰ的基因序列可作为很好的分子标记,用于分析昆虫纲各类群的系统发育关系。在直翅目中,直翅目形成单系群,意大利蝗与东亚飞蝗形成姐妹群,在形态分类上二者均属于直翅目蝗总科[15]。
意大利蝗是重要的农业害虫,为了进一步研究意大利蝗血蓝蛋白亚基Ⅰ的结构和功能,构建了意大利蝗CitHc-1基因活性区域的原核表达载体,进行了重组蛋白的表达,并对蛋白质结构进行了预测,表明CitHc-1可以在大肠杆菌中正常表达,为进一步研究其蛋白结构和功能打下了基础,进而为害虫的综合治理以及昆虫资源的开发利用提供分子依据。
[1] Terwilliger N B. Functional adaptations of oxygen-transport proteins [J]. J. Exper. Biol., 1998, 201(8):1085-1098.
[2] Jaenicke E, Föll R, Decker H. Spider hemocyanin binds ecdysone and 20-OH-ecdysone [J]. J. Biol. Chem., 1999, 274(48):34267-34271.
[3] Paul R J, Pirow R. The physiological significance of respiratory proteins in invertebrates [J]. Zoology, 1998, 100(4):298-306.
[4] Decker H, Jaenicke E. Recent findings on phenoloxidase activity and antimicrobial activity of hemocyanins [J]. Dev. Comp. Immunol., 2004, 28:673-687.
[5] Hagner-Holler S, Schoen A, Erker W,etal.. A respiratory hemocyanin from an insect.[J]. Proc. Natl. Acad. Sci. USA, 2004, 101(3):871-874.
[6] Burmester T, Storf J, Hasenjäger A,etal.. The hemoglobin genes ofDrosophila[J]. FEBS J., 2006, 273(3):468-480.
[7] Pick C, Hagner-Holler S, Burmester T. Molecular characterization of hemocyanin and hexamerin from the firebratThermobiadomestica(Zygentoma).[J]. Insect Biochem. Mol., 2008, 38(11):977-983.
[8] Pick C, Schneuer M, Burmester T. The occurrence of hemocyanin in Hexapoda.[J]. FEBS J., 2009, 276(7):1930-1941.
[9] Van-Holde K, Miller K H. Hemocyanins and invertebrate evolution.[J]. J. Biol. Chem., 2001, 276(19):15563.
[10] Burmester T. Origin and evolution of arthropod hemocyanins and related proteins.[J]. J. Comp. Physiol. B., 2002, 172(2):95-107.
[11] Gaykema W P J, Hol W G J, Vereijken J M,etal.. 3.2-structure of the copper-containing, oxygen-carrying proteinPanulirusinterruptushaemocyanin [J]. Nature, 1984, 309(5963):23-29.
[12] Volbeda A, Hol W G. Crystal structure of hexameric haemocyanin fromPanulirusinterruptusrefined at 3.2 A resolution[J]. J. Mol. Biol., 1989, 209(2):249-279.
[13] Yin H, Guan N, Dong L,etal.. Initial analysis of the hemocyanin subunit type 1 (Hc1 gene) fromLocustamigratoriamanilensis.[J]. Mol. Biol. Rep., 2012, 39(3):3305-3310.
[14] 张新新,游 婷,刘海霞,等.东亚飞蝗血蓝蛋白亚基Ⅰ基因的原核表达与蛋白结构预测[J].河北大学学报:自然科学版,2013,33(6):636-641.
[15] 刘举鹏.中国蝗虫鉴定手册[M]. 西安:天则出版社,1990,1-92.
[16] Sergeev M G, Van’Kova I A. The dynamics of a local population of the Italian locust (CalliptatusitalicusL.) in an anthropogenic landscape [J]. Contemp. Probl. Ecol., 2008, 1(1):204-209.
[17] 黄 辉,朱恩林.哈萨克斯坦蝗灾严重发生[J].世界农业,2001(6):46-47.
[18] 柳峰松,李 婷,王晓菲,等.中国明对虾ALFFc基因的原核表达与抗血清制备[J].河北大学学报(自然科学版),2010,30(1):88-92.
[19] Gillespie J P, Burnett C, Charnley A K. The immune response of the desert locustSchistocercagregariaduring mycosis of the entomopathogenic fungus,Metarhiziumflavoviride[J]. J. Insect Physiol., 2000, 46: 429-437.
[20] Whitfield J B. The insects: An outline of entomology[J]. J. Insect Conserv., 1995, 14(6):231-232.
Cloning and Prokaryotic Expression of the Hemocyanin Subunit TypeⅠ fromCalliptanusitalicus
WANG Di, ZHANG Zao, WANG Zhangping, YIN Hong*
TheKeyLaboratoryofZoologicalSystematicsandApplication,CollegeofLifeSciences,HebeiUniversity,HebeiBaoding071002,China
Hemocyanins are copper-containing (Cu2+) proteins in vivo of insect and play important roles not only in respiratory but also in energy storage, antibiosis and antivirus. To investigate the structure and expression profiles ofCalliptanusitalicushemocyanin subunit typeⅠ(CitHc-1), the complete cDNA (2 335 bp) ofCitHc-1 was obtained by RACE method. TheCitHc-1 contained an open reading frame of 2 079 bp encoding 692 amino acids. The predicted molecular weight is 79.88 kDa. Sequence alignment revealed that theCitHc-1 shared an identity of 91%~94% with hemocyanins from other Acridoidea species. The dendrograms of the arthropod hemocyanin subunit typeⅠinferred by Neighbor-joining (NJ) method showed that,Calliptanusitalichemocyanin subunit typeⅠandLocustamigratoriahemocyanin subunit typeⅠformed a subclade. In order to further study the structure and function of hemocyanin subunit typeⅠfromCalliptanusitalicus, the CitHc-1 prokaryotic expression vector was established successfully and the recombined plasmid was transfected into BL21(DE3). The result of SDS-PAGE showed that the molecular weight was consistent with the theory molecular weight (32 kDa). The results provided a theoretical basis for further analysis on the function of CitHc-1 inC.italicus.
Calliptanusitalicus; hemocyanin subunitⅠ; gene clone; expression analysis; prokaryotic expression
2017-04-05; 接受日期:2017-05-19
国家自然科学基金项目(31272293)资助。
王頔,硕士研究生,主要从事昆虫分子系统发育研究。 E-mail: 1530471926@qq.com。*通信作者:印红,教授,博士,主要从事昆虫分子系统发育研究。E-mail:yinhong@hbu.edu.cn
10.19586/j.2095-2341.2017.0023

