昆虫抗药性检测方法研究进展
马玉婷, 魏 娟, 李相敢
先正达生物科技(中国)有限公司, 北京 102206
昆虫抗药性检测方法研究进展
马玉婷, 魏 娟, 李相敢*
先正达生物科技(中国)有限公司, 北京 102206
随着杀虫剂被长期、广泛地使用,昆虫对杀虫剂产生了不同程度的抗性,昆虫抗药品种及抗药剂量也相应地逐年增加,这使得昆虫抗药性的监测逐渐成为人们关注的焦点,昆虫抗药性的检测方法也因此不断改进。介绍了检测昆虫抗药性的两类常见方法:生物测定法和分子生物学法,其中,生物测定法分为人工饲料混药法、浸叶法、点滴法、喷雾法及喷粉法、药膜法、浸虫法和IRAC No.5法;而分子生物学法又包括PCR限制性内切酶技术、特异性等位基因PCR技术、随机扩增多态性DNA技术、TaqMan实时荧光定量PCR技术、KASP技术和DNA测序技术。研究人员可通过比较昆虫特性、环境因素、实验条件及实验目的的不同,选择合适的检测方法,以快速掌握昆虫的抗性信息,并及时有效的调整昆虫的防治策略。
昆虫;抗药性;生物测定;分子检测
昆虫抗药性是指在昆虫群体中发展起来的、能够耐受杀死正常种群大多数个体的药量的能力[1]。长期以来,由于杀虫剂的选择作用,许多昆虫对杀虫剂产生了不同程度的抗药性。昆虫抗药性最早的记载是出现于1908年,Melander在研究美国加利福尼亚梨园蚧时,发现其对石硫合剂产生了抗药性[2]。随后的几年又发现红圆蚧对氢氰酸产生抗药性、苹果蠹蛾对砷酸铅产生抗药性[3]。迄今为止,全世界有近600多种害虫对1种或多种药剂产生了抗药性[4]。昆虫抗药性的产生会带来许多不利的影响,比如农作物产量降低、农民种植成本升高等,同时,大量的喷洒农药会导致食品中农药残留过高、污染生态环境并危害人类健康。因此,昆虫的抗药性问题一直是人们关注的焦点 。
1 昆虫抗药性机制
大多数研究认为,昆虫的抗药性机制主要包括药剂穿透率下降、昆虫体内解毒酶活力增强即代谢抗性与靶标敏感性降低等[5]。根据抗性机理,又可以将昆虫抗药性分为靶标抗性和代谢抗性。
靶标抗性是指昆虫在杀虫剂的长期选择下,其杀虫剂作用的靶标部位的敏感性可能降低,从而形成靶标抗性。昆虫靶标抗性主要涉及乙酰胆碱酯酶(AChE)、神经轴突钠离子通道(SC)和γ-氨基丁酸(GABA)受体氯离子通道这三大作用靶标[6]。乙酰胆碱酯酶是有机磷和氨基甲酸酯杀虫剂的靶标,可以通过降低其对杀虫剂的敏感性,使昆虫产生抗性[7]。对有机磷酸酯的抗性与Ⅰ型乙酰胆碱酯酶(ACE-1)中的点突变和羧酸酯酶的过表达之间存在一定的关系[8]。二氯二苯三氯乙烷(DDT)和拟除虫菊酯类杀虫剂的作用靶标是昆虫的神经轴突钠离子通道(SC),在这类杀虫剂的长期选择下,昆虫钠离子通道靶标部位敏感性下降,产生了击倒抗性(knockdown resistance,kdr)[9]。通过电生理学研究证明,DDT和拟除虫菊酯通过修饰钠离子通道,使其在一段时间内始终保持打开状态[10]。而Knipple等[11]分析了家蝇kdr抗性品系与敏感性钠离子通道基因cDNA的限制性片段,遗传连锁分析显示,kdr性状与电压敏感性钠离子通道基因片段紧密连锁,钠离子通道基因的突变是产生kdr抗性的基础。γ-氨基丁酸(GABA)是哺乳动物的脑部主要神经传输抑制素,作用于GABA-A受体。而GABA-A受体是配体门控氯离子通道,在调节神经元兴奋度上起着重要作用[12]。γ-氨基丁酸(GABA)受体氯离子通道是环戊二烯类、抗生素类、二环苯甲酸酯类、吡唑类杀虫剂的重要作用靶标,受到抑制后会影响氯离子转运,从而阻断神经递质的正常传递[6]。
代谢抗性是指由于解毒酶活性增高,昆虫对杀虫剂代谢加速产生抗性,涉及氧化作用、还原作用、水解作用以及基团的转移作用和轭合作用,通过这些生化过程把杀虫剂转变为易溶于水的极性分子,从而排出体外[6]。与代谢抗性关系最大的酶包括细胞色素P450酶系[13~15]、非专一性酯酶[16]、谷胱甘肽S-转移酶(GST)[13,17]和醛氧化酶[18]。测定这些酶在天然群体中的活性是检测其对杀虫剂的抗性机制的重要步骤。
近年来,随着分子生物学技术突飞猛进的发展,昆虫的抗药性机制在分子生物学方面也有了很大的进展,目前被普遍认同的昆虫抗药性的分子机制主要集中在基因过量表达和基因结构突变方面。比如斜纹夜蛾中细胞色素P450相关基因、家蝇中CYP6A1基因的表达量的升高与昆虫的抗药性呈正相关[19,20]。
2 昆虫的抗药性检测方法
长期以来,快速、准确的检测方法是昆虫抗药性监测的重要部分,并成为国内外学者获取最新的靶标害虫对农药的抗性信息,避免或减缓害虫抗药性继续发展的重要途径。过去的十几年中,昆虫的抗药性检测方法已经从传统的生物测定法发展到现代分子生物技术水平。
2.1 生物测定法
生物测定法(bioassay)是根据“药剂作用方式和昆虫种类”建立标准的抗药性检测方法[21]。由于生物测定法能够直观地得到抗性图谱,因而,长期以来得到广泛的应用。根据杀虫剂进入虫体部位及途径的不同,生物测定最常用的方式是胃毒毒力测定和触杀毒力测定。
2.1.1 人工饲料混药法 人工饲料混药法的目标昆虫通常是东方黏虫、二化螟、棉铃虫、甜菜夜蛾等鳞翅目昆虫。操作流程是将药粉与人工饲料按一定比例混合,每个处理接虫20~50头,然后置于适宜条件下培养,5 d后检查昆虫死亡情况[22]。由于此方法是杀虫剂与食物一同被目标昆虫吞食,进入消化道而发挥作用,故属于胃毒作用方式。
2.1.2 浸叶法 浸叶法的目标昆虫是小菜蛾、甜菜夜蛾等鳞翅目昆虫。该方法是将药液配置成不同的浓度,再将叶片浸入药剂溶液中,10 s后取出晾干置于培养皿中,接入供试昆虫,48 h后检查昆虫死亡情况。浸叶法是通过昆虫进食含杀虫剂的叶片而发挥毒杀作用的,属于胃毒作用方式。浸叶法操作简单、方便,在昆虫的抗药性实验中被广泛应用[23~27]。王玲等[28]通过改良浸叶法,建立了药管浸叶法。药管浸叶法采用2 mL的离心管和直径为1 cm的寄主叶片同时浸药、再饲喂叶螨的方法,可充分发挥其药剂的触杀和胃毒活性。分别采用传统的玻片浸渍法和药管浸叶法测定5种杀虫杀螨剂对室内截形叶螨种群的毒力,结果表明,与玻片浸渍法相比,药管浸叶法测定截形叶螨对药剂表现更为敏感,毒力测定的结果更低。
2.1.3 点滴法 点滴法是用毛细血管、微量点滴仪或微量注射器将一定浓度的药液点滴在虫体的一定部位,如胸部背面或胸部腹面,药液进入虫体后而发挥触杀作用。一定时间后检测试虫的生存及死亡个数。以计量对数为横坐标,概率值为纵坐标绘图,求该试虫的LD50(lethal dose,50%),即半数致死量[29]。并根据公式(抗性种群的LD50/敏感种群的LD50)计算抗性倍数。点滴法的靶标昆虫是黏虫、二化螟等鳞翅目幼虫以及蚜虫、叶蝉等同翅目昆虫。
2.1.4 喷雾法及喷粉法 喷雾法及喷粉法的目标昆虫是东方黏虫、小菜蛾、烟粉虱等昆虫。此方法是利用喷雾或喷粉装置,将定量的药液或粉剂均匀喷洒到盛有昆虫的器皿内,使药剂直接与昆虫接触,待药液稍干或虫体沾粉较稳定后,将目标昆虫转移到处理前的生长环境中恢复1~2 h,然后定期观察记录昆虫的生长、发育和死亡的情况。喷雾法与喷粉法在昆虫抗药性方面应用比较广泛[25,30~33],是杀虫剂穿透表皮引起昆虫中毒致死的触杀毒力测定方法,具有快速、简便等特点,可同时对大批试虫做不同浓度的处理。
2.1.5 药膜法 药膜法的基本原理是将一定量的杀虫药剂均匀地涂在滤纸或瓶壁上,形成一个药膜,放入一定量的供试昆虫,让其爬行1 h后,再移至正常环境中,观察试虫的中毒死亡情况[34,35]。药膜法的目标昆虫是东方黏虫、小菜蛾等昆虫。药膜法中,药剂不经过昆虫口器,而是通过体壁进入虫体而致死,因此属于触杀毒力测定。
2.1.6 浸虫法 浸虫法是将药剂稀释成不同的浓度,将虫子浸渍在供试药剂中,一段时间后取出虫子,放在吸水纸上晾干,根据虫子的致死率测定其对供试药剂的抗性。浸虫法属于触杀毒力测定方法,以死亡率的机率值为纵坐标,以药剂的浓度对数值为横坐标绘制LD-P线,求毒力回归方程和LD50[36]。浸虫法的目标昆虫是黏虫、二化螟等鳞翅目昆虫以及蚜虫等同翅目昆虫。
2.1.7 IRAC No.5法 IRAC No.5法是抗性行动委员会2013年提出的第5套抗性检测方法,简称IRAC No.5法。该方法的目标昆虫是叶蝉和褐飞虱。基本步骤是将杀虫剂配置成不同的浓度,将植物幼苗完全浸入药剂中,10 s后取出,干燥,放入塑料或玻璃管中,每个处理接种10~15只昆虫,一定时间后记录虫子的存活和死亡数量,利用Abbott公式计算虫子死亡率。胡君等[37]分别用稻苗浸根法、稻苗浸渍法和IRAC No.5法测定吡蚜酮对褐飞虱的毒力,通过比较,认为IRAC No.5法测定吡蚜酮对褐飞虱的LD50值更加接近实际水平。该方法属于触杀毒力的测试方法之一。
2.2 分子生物学法
随着昆虫抗药性机理分子水平上研究的不断深入,分子生物学检测技术已逐渐在抗药性检测中发挥重要的作用。目前,大多数的分子检测研究集中于靶标抗性方面,即检测靶标基因的突变。常用的方法有限制性内切酶技术、基于PCR的反应技术和测序技术。
2.2.1 PCR限制性内切酶技术(PCR restriction endonuclease,PCR-REN) PCR限制性内切酶技术是根据昆虫对药物的靶标序列产生变异,即相关作用位点基因的突变,从而使某些限制性内切酶的作用位点改变的特性发展起来的一种检测技术。其技术原理是先对靶标序列进行PCR扩增,再用合适的限制性内切酶对扩增产物进行酶切,由于昆虫抗性基因和敏感基因的差异,酶切之后产生了不同长度的片段,由此可以鉴定区分抗性和敏感性个体的基因型[38]。该技术能快速、经济地检测田间害虫的抗药性,但其缺点是仅局限于导致限制性内切酶切位点发生变化的抗性突变检测,若无合适的酶切位点,该技术则不能使用。
2.2.2 基于PCR的反应技术 ①特异性等位基因PCR技术(PCR amplication of specific alleles,PASA)。特异性等位基因PCR技术是一种快速检测DNA单个碱基突变的方法[39,40]。该技术的基本原理是设计引物时可以优先扩增等位基因之一,例如特异性引物的3′端碱基与突变型等位位点碱基互补,在基因扩增过程中含有突变型等位基因的序列优先被扩增出;而如果特异性引物的3′端碱基与等位敏感型位点碱基互补,则优先扩增出敏感型基因。PASA技术操作方便、成本低,省去了酶切的步骤,不仅能够区分抗性个体和敏感个体,而且能够进行个体基因型的鉴定。但其反应条件比较难控制,容易产生假阳性结果。
②随机扩增多肽性DNA技术(random amplified polymorphic DNA, RAPD)。随机扩增多肽性DNA技术(RAPD)是1990年由美国科学家Wiliams和Welsh分别研究提出的[41]。其原理是设计一组随机引物,对样品基因组DNA进行PCR扩增,可以得到一系列大小不等的PCR产物。如果基因组在某一区域发生了遗传变异,如碱基突变、DNA片断的插入或缺失,从而导致了PCR扩增产物的变化,通过对PCR产物的检测即可测出基因组DNA的多态性[42]。RAPD技术具有操作简单、灵敏度高、对DNA模板纯度要求不高等特点,目前已广泛应用于基因组研究的各个领域。
③TaqMan PCR检测技术。TaqMan PCR反应是目前分子生物学检测方法中普遍运用的方法,其原理是TaqMan双标记探针(5′标记荧光报告基团和3′标记荧光淬灭基团)完整时,报告基团发射的荧光信号被淬灭基团吸收,没有荧光信号产生(图1A);随着PCR扩增,Taq酶的5′-3′外切酶活性将探针酶切降解,报告基团和淬灭基团分离,从而报告基团发出的荧光信号被检测器接收(图1B)。
④TaqMan-MGB探针。在此基础上的TaqMan-MGB探针,是在双标记探针的3′端标记了MGB(minor grove binding)基团,它与DNA分子的小沟结合,不仅可以提高探针的退火温度Tm,还可以增加探针识别特异性,达到区分1个碱基的差异的目的。
因此,检测昆虫抗药性需要在昆虫已知突变位点设计MGB探针,在MGB探针的5′端标记不同的荧光基团分别检测敏感型和突变型,进行PCR检测。根据检测方法不同,还可以分为Endpoint定性PCR和Real-time定量PCR。Endpoint定性PCR是在普通的PCR反应后对Endpoint产物的荧光进行检测,根据样品与标准品的匹配程度来区分敏感型、抗药纯合突变型以及抗药杂合突变型(图2,彩图见图版一)。 通过在突变位点设计TaqMan MGB探针,对棉蚜虫的kdr基因突变进行了检测,并与传统的PCR-RFLP方法进行了比较,结果定量PCR方法比传统方法更加灵敏、可靠,更适用于大量样品的检测[43]。白亮等[44]用TaqMan MGB探针Real-time定量PCR方法检测中华按蚊kdr基因L1014位点的突变,对50个实验室和113个现场的中华按蚊样本进行了鉴定,经检测,50个实验室样品均为野生型纯合体,现场样本中有101个样本发生了突变,突变频率为87.61%。

图1 TaqMan Real-time PCR反应原理示意图Fig.1 Schematic diagram of TaqMan Real-time PCR.注:A.探针与模板序列不匹配,无荧光信号;B.探针与模板序列匹配,有荧光信号产生。R代表荧光报告基团,Q代表荧光猝灭基团。
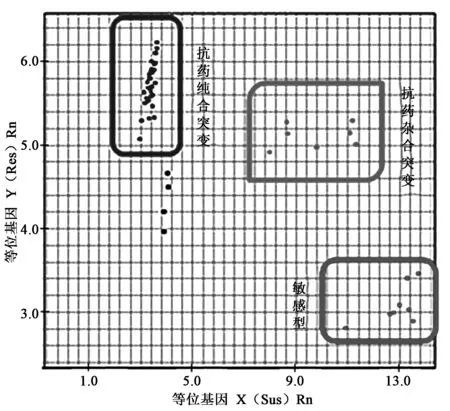
图2 TaqMan-MGB探针区分不同基因型Fig.2 Using TaqMan-MGB probes to distinguish different genotypes.注:纵坐标代表抗性基因产生的荧光,即抗药纯合突变(蓝点);横坐标代表敏感基因产生的荧光,即敏感型(红点);中间的为杂合型,即抗药杂合突变(绿点)。每个点代表一头虫子样品。(彩图见图版一)
⑤KASP技术。KASP PCR(kompetitive allele-apecific PCR),即竞争性等位基因特异性PCR,是由英国LGC公司新发展起来的一项技术,主要应用于基因分型,是一种高效经济的单核苷酸多态性(single nucleotide polymorphisms,SNP)检测方法。其原理是设计2个SNP PCR引物,引物的3′端各对应一个SNP的等位基因,SNP PCR引物的5′端是一段特定的序列,其与KASP反应试剂盒中通用的荧光探针序列一致(图3)。所以对于不同的反应,只需要设计SNP特性引物即可,这段引物没有荧光标记,因此大大节省了成本。KASP技术的灵敏度和特异性均较好。由于其成本较低,已成为目前大规模SNP基因分型的主流方法之一[45~47]。KASP在昆虫抗性检测方面还未有报道,但由于其在SNP方面的出色表现,同样能应用于由于单碱基突变而引起的昆虫抗性问题的研究。
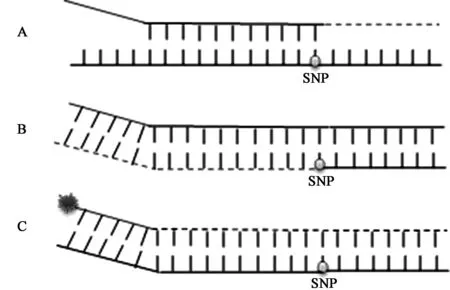
图3 KASP技术反应原理示意图Fig.3 Schematic diagram of KASP technology reactions.注:A:第1轮PCR反应,模板与可互补的(3′末端能配对的)PCR引物进行退火,并发生扩增;B:第2轮PCR反应,扩增出带有通用序列的PCR产物;C:接下来的PCR反应,荧光探针结合到没有淬灭基团的互补链上,发出荧光。图3C中球状标记为荧光发光基团。
2.2.3 DNA测序技术 测序技术最早可以追溯到20世纪50年代,Whitfeld等[48]用化学降解的方法测定多聚核糖核苷酸序列。1977年,Sanger首次发明了双脱氧核苷酸末端终止法,即Sanger测序法或一代测序法[49]。Sanger法简单、快速,并经过后续的不断改良,测序读长可达1 000 bp,准确性为99.999%,已成为DNA测序的主流,是目前基因检测的金标准。但一代测序技术通量较低,已无法完全满足研究的需要。随着科学技术的发展,以Roche公司的454技术、Illumina公司的Solexa技术和ABI公司的SOLID技术为代表的二代测序技术诞生了。二代测序技术降低了测序成本的同时,大幅提高了测序速度,并保持了高的准确性。这三个技术平台各有优点。454技术的测序片段较长,高质量的读长可以达到400 bp。Solexa技术的成本较低,大约只有454技术的1/10。SOLID技术的准确度很高,可达到99.999%,是目前二代测序技术中准确度最高的。二代测序过程主要包括DNA测序文库的制备、锚定桥接、PCR扩增、单碱基延伸和数据分析。用不同颜色的荧光标记4种dNTP, 当DNA合成时,每添加一种dNTP就会释放出不同的荧光,根据收集到的荧光信号确定DNA的序列信息。二代测序技术以及以纳米技术为核心的三代测序技术已经在诊断、法医生物学、生物系统学等众多领域发挥着重要的作用。在昆虫的抗药性鉴定方面,能够在突变位点附近直接进行DNA测序,无须繁琐的实验,即可得到昆虫抗性基因信息,是目前最简单、最准确的方法。拜耳作物科学的Benting等[50]利用测序技术对大批量棉蚜的拟除虫菊酯进行抗性测定,从而及时准确地对某一区域的棉蚜抗性水平进行有效监控。在转录组的测定方面,利用二代测序技术进行转录组水平的检测,能够全面快速地获得抗性及敏感昆虫几乎所有转录本的序列信息,对于研究抗性相关基因及其代谢功能具有重要意义[51,52]。
2.2.4 分子生物学方法的比较 分子生物学方法各有优缺点(表1)。测序技术的灵敏度无疑是最高的,无论是一代测序还是二代测序,灵敏度均可达99.9%以上,是目前基因检测领域的权威。二代测序技术独特的超高通量检测平台,使其已广泛应用于诊断医学等领域。但是,测序技术成本较高,操作比较复杂,周期较长,尤其是二代测序技术,从DNA提取、PCR反应到数据分析,大概需要1~2个月。因此,二代测序技术在缩短周期和降低成本方面仍有待提高。PCR方法由于操作简单、灵敏度高,目前应用比较广泛。尤其是TaqMan PCR反应,可以进行384孔板高通量操作,数据也可以批量分析,是一种很成熟的高通量检测方法。由于TaqMan探针的成本较高,为了降低成本,有时可以用KASP代替。酶切技术虽然通量低,但当PCR的引物探针不易设计或扩增效率较低时,就要考虑是否有合适的酶切位点。
3 展望
注:灵敏度比较中,“+”越多代表方法可检测的灵敏度越高;通量比较中,“+”越多代表通量越高,即单位时间内可完成的样品数越多;时间比较中,“+”越多代表实验所需时间越长;成本比较中,“+”越多代表所需成本越高;数据分析中,“+”越多代表数据分析越因难。
目前,常用的昆虫抗药性检测方法除生物测定法和分子生物学方法外,还有一些其他的方法,比如神经电生理检测法、生物化学检测法和免疫学检测法[53,54]。生物测定法操作比较复杂,并且当昆虫群体抗性较低或有多种抗性时,很难进行测定,因此往往具有滞后性,不利于昆虫抗药性的早期监测。分子生物学方法操作简单、特异性好,是目前昆虫抗性测定的主要方法,但是该方法是建立在对抗药性的分子机制深刻了解的基础上的,需要确定抗性基因的突变位点,然后再设计PCR引物或查找酶切位点才可以检测,如PCR-REN、PASA和TaqMan-MGB探针法。DNA测序不需要准确的突变位点,操作简单,但是也需要一个大致的靶区域,否则大规模的测序既是资金浪费又难以开展数据分析。RAPD技术无需预先确定突变位点,但需要对总基因组进行PCR扩增以及凝胶电泳、PCR产物鉴定,无法实现高通量检测。因此,目前较理想的方法是先找到农药的靶作用位点,将生物测定法和分子检测方法结合起来进行抗药性检测,第一时间掌握昆虫的抗性水平。通过调节杀虫剂的剂量、配比等,及时有效的对昆虫进行防治。
[1] 胡兴强, 刘春生. 家蝇抗药性机理研究综述[J]. 安徽预防医学杂志,2003, 9(5): 336-339.
[2] 唐振华. 我国昆虫抗药性研究的现状及展望[J]. 昆虫知识,2000, 37(2): 97-103.
[3] 陶黎明. 昆虫抗药性及其治理对策的研究[D]. 上海:中国科学院上海生命科学研究院植物生理生态研究所,博士学位论文, 2005.
[4] 王 凛, 廖文君, 王文雪. 害虫抗药性产生原因及预防措施[J]. 现代农业科技, 2010(23):194.
[5] 黄艳君,浦冠勤. 昆虫对农药抗性的研究进展[J]. 长江蔬菜,2011(6):7-9.
[6] 阮成龙,米 智,朱 勇. 昆虫抗药性机制研究进展[J]. 蚕业科学,2012(2):322-328.
[7] Assogba B S, Djogbénou L S, Saizonou J,etal.. Phenotypic effects of concomitant insensitive acetylcholinesterase (ace-1R) and knockdown resistance (kdrR) inAnophelesgambiae: a hindrance for insecticide resistance management for malaria vector control[J]. Parasite. Vector., 2014, 7(1):548.
[8] Alon M, Alon F, Nauen R,etal.. Organophosphates′ resistance in the B-biotype ofBemisiatabaci(Hemiptera: Aleyrodidae) is associated with a point mutation in anace1-type acetylcholinesterase and overexpression of carboxylesterase[J]. Insect Biochem. Molec., 2008, 38(10):940-949.
[9] 孙晓琴, 袁建忠, 唐振华. 家蝇和果蝇的靶标抗性研究进展[J]. 农药, 2008, 47(11):785-789.
[10] Narahashi T. Nerve membrane ion channels as the target site of environmental toxicants[J]. Environ. Health Persp., 1987, 71(2):25-29.
[11] Knipple D C, Doyle K E, Marsella-Herrick P A,etal.. Tight genetic linkage between the kdr insecticide resistance trait and a voltage-sensitive sodium channel gene in the house fly[J]. Proc. Natl. Acad. Sci. USA, 1994, 91(7):2483-2487.
[12] Brito V N, Mendonca B B, Guilhoto L M,etal.. Allelic variants of the gamma-aminobutyric acid-A receptor alpha1-subunit gene (GABRA1) are not associated with idiopathic gonadotropin-dependent precocious puberty in girls with and without electroencephalographic abnormalities[J]. J. Clin. Endocrinol. Metab., 2006, 91(6):2432-2436.
[13] Mamidala P, Jones S C, Mittapalli O. Metabolic resistance in bed bugs[J]. Insects, 2011, 2(1):36-48.
[14] Chouaïbou M, Zivanovic G B, Knox T B,etal.. Synergist bioassays: A simple method for initial metabolic resistance investigation of fieldAnophelesgambiaes.l. populations[J]. Acta Trop., 2014, 130(2):108-111.
[15] Karunker I, Benting J, Lueke B,etal.. Over-expression of cytochrome P450CYP6CM1 is associated with high resistance to imidacloprid in the B and Q biotypes ofBemisiatabaci(Hemiptera: Aleyrodidae)[J]. Insect Biochem. Molec., 2008, 38(6):634-644.
[16] Montella I R, Schama R, Valle D. The classification of esterases: an important gene family involved in insecticide resistance——a review[J]. Mem. I. Oswaldo Cruz, 2012, 107(4):437-449.
[17] Riveron J M, Yunta C, Ibrahim S S,etal.. A single mutation in the GSTe2, gene allows tracking of metabolically based insecticide resistance in a major malaria vector[J]. Genome Biol., 2014, 15(2):R27.
[18] 陆澄滢. 昆虫抗药性分子机制的研究进展[J]. 湖南农机,2010(5):253-254.
[19] 黄水金,秦文婧,陈 琼. 斜纹夜蛾P450基因CYP4M14和CYP4S9的克隆与mRNA表达水平研究[J]. 中国农业科学, 2010, 43(15): 3115-3124.
[21] 杨 健,王 真,姚安庆. 昆虫抗药性测定与杀虫剂穿透生物学[J]. 应用昆虫学报,2011, 48(2): 421-425.
[22] Pinto L M N, Fiuza L M. PCR and bioassays screening ofBacillusthuringiensisisolates from rice-fields of Rio Grande do Sul, specific to lepidopterans and coleopterans[J]. Braz. J. Microbiol., 2003, 34(4):305-310.
[23] Jones T, Scott-Dupree C, Harris R,etal.. The efficacy of spinosad against the western flower thrips,Frankliniellaoccidentalis, and its impact on associated biological control agents on greenhouse cucumbers in southern Ontario[J]. Pest Manag. Sci., 2005, 61(2):179-185.
[24] Vastrad A S, Lingappa S, Basavanagoud K. Sample size and bioassay method for monitoring insecticides resistance in diamond back moth,Plutellaxylostella(Linnaeus)[J]. Karnataka J. Agric. Sci., 2005, 18(1):47-51.
[25] Liu T X, Stansly P A. Deposition and bioassay of insecticides applied by leaf dip and spray tower againstBemisiaargentifoliinymphs (Homoptera: Aleyrodidae)[J]. Pest Manag. Sci., 1995, 44(4):317-322.
[26] 郭 磊, 边全乐, 张宏军, 等. 小菜蛾抗药性监测方法——叶片药膜法[J]. 应用昆虫学报, 2013, 50(2): 556-560.
[27] Cho K, Uhm K B, Lee J O. Effect of test leaf and temperature on mortality ofFrankliniellaoccidentalis, in leaf dip bioassay of insecticides[J]. J. Asia-Pac. Entomol., 1999, 2(1):69-75.
[28] 王 玲. 二斑叶螨抗药性监测及分子检测技术研究[D]. 北京:中国农业科学院蔬菜花卉研究所, 硕士学位论文,2016.
[29] 张 帅,李永平,邵振润,等. 水稻二化螟抗药性监测及防控对策[J]. 植物保护,2011, 37(2): 141-144.
[30] Wang J M, Ling B, Cao X,etal.. Toxicity evaluation of botanical insecticides and their mixture against the spiraling whitefly,Aleurodicusdispersus[J]. J. Biosafety, 2012,21(2):135-141.
[31] Herron G A, Gunning R V, Cottage E L A,etal.. Spinosad resistance, esterase isoenzymes and temporal synergism inFrankliniellaoccidentalis(Pergande) in Australia[J]. Pestic. Biochem. Phys., 2014, 114(1):32-37.
[32] Guillén J, Bielza P. Thiamethoxam acts as a target-site synergist of spinosad in resistant strains ofFrankliniellaoccidentalis[J]. Pest Manag. Sci., 2013, 69(2):188-194.
[33] Guillén J, Navarro M, Bielza P. Cross-resistance and baseline susceptibility of spirotetramat inFrankliniellaoccidentalis(Thysanoptera: Thripidae)[J]. J. Econ. Entomol., 2014, 107(3):1239-1244.
[34] 林玉英, 曾 玲, 陆永跃,等. 杀虫剂对橘小实蝇毒力测定方法的筛选和应用[J]. 植物保护, 2011, 37(4):158-162.
[35] 门兴元, 于 毅, 张安盛,等. 试管药膜法测定10种杀虫剂对绿后丽盲蝽若虫的室内毒力[J]. 植物保护, 2011, 37(4):154-157.
[36] Chandrasena D, Difonzo C, Byrne A. An aphid-dip bioassay to evaluate susceptibility of soybean aphid (Hemiptera: Aphididae) to pyrethroid, organophosphate, and neonicotinoid insecticides[J]. J. Econ. Entomol., 2011, 104(4):1357-1363.
[37] 胡 君. 褐飞虱抗药性监测及对吡蚜酮生测方法的探讨[D]. 南京:南京农业大学, 硕士学位论文,2014.
[38] Ffrench-Constant R H, Rocheleau T A, Steichen J C,etal.. A point mutation in a Drosophila GABA receptor confers insecticide resistance[J]. Nature,1993,363(6428):449-451.
[39] Zhu K Y, Lee S H, Clark J M. A point mutation of acetylcholinesterase associated with azinphosmethyl resistance and reduced fitness in colorado potato beetle[J]. Pestic. Biochem. Phys., 1996, 55(2):100-108.
[40] 王 玲,张友军,吴青君,等. 二斑叶螨对联苯菊酯抗药性的PASA快速检测技术建立与应用[J]. 应用昆虫学报, 2015, 52(2): 510-518.
[41] 王桂荣. RAPD技术及其在昆虫学研究中的应用[J]. 昆虫知识, 1999, 36(3): 184-188.
[42] Black W C, DuTeau N M, Puterka G J,etal.. Use of the random amplified polymorphic DNA polymerase chain reaction (RAPD-PCR) to detect DNA polymorphisms in aphids (Homoptera: Aphididae)[J]. B. Entomol. Res., 1992, 82(2):151-159.
[43] Suann M, Bogema D R, Chen Y,etal.. A TaqMan qPCR method for detectingkdr, resistance inAphisgossypii, demonstrates improved sensitivity compared to conventional PCR-RFLP[J]. J. Pest Sci., 2015, 88(4):785-791.
[44] 白 亮,朱国鼎,唐建霞,等. TaqManMGB探针实时荧光定量PCR用于中华按蚊kdr基因突变检测的研究[J]. 中国血吸虫病防治杂志, 2013, 25(2): 167-171.
[45] Zhao S, Li A, Li C,etal.. Development and application of KASP marker for high throughput detection of AhFAD2 mutation in peanut[J]. Electron. J. Biotechnol., 2017, 25:9-12.
[46] 杨子博, 顾正中, 周羊梅, 等. 江苏淮北地区小麦品种资源籽粒硬度基因等位变异的KASP检测[J].麦类作物学报, 2017, 37(2): 153-161.
[47] Awais R. Development and validation of high-throughput KASP assays for genes underpinning key economic traits in bread wheat[A].见:第七届国际作物科学大会摘要集[C].中国:第七届国际作物科学大会,2016,2.
[48] Whitfeld P R. A method for the determination of nucleotide sequence in polyribonucleotides[J]. Biochem. J., 1954, 58(3):390-396.
[49] Sanger F, Nicklen S, Coulson A R. DNA sequencing with chain-terminating inhibitors[J]. Proc. Natl. Acad. Sci. USA, 1977, 74(12):5463-5467.
[50] Benting J, Hauser H I, Nauen R,etal.. Molecular diagnosis of resistance[J]. Pflanzenschutz Nachrichten Bayer, 2014, 57(1): 78-86.
[51] Sagri E, Reczko M, Gregoriou M E,etal.. Olive fly transcriptomics analysis implicates energy metabolism genes in spinosad resistance[J]. BMC Genomics, 2014, 15(1):714.
[52] Kaur R. Accelerating Gene Discovery In Insects Using Next-Generation Sequencing-Applications in Phosphine Resistance Diagnostics[C]. San Diego: Plant and Animal Genome Conference XVII, 2009.
[53] 毛立新. 害虫抗药性的生物化学测试方法[J]. 昆虫知识,1991(2):113-114,105.
[54] 潘志萍,李敦松. 昆虫抗药性监测与检测技术研究进展[J]. 应用生态学报,2006,17(8):1539-1543.
Advance on Detection Method of Insecticide Resistance
MA Yuting, WEI Juan, LI Xianggan*
SyngentaBiotechnologyChinaCo.Ltd.,Beijing102206,China
Under widespread and long-time usage of insecticides, insects develop various degrees of resistance to insecticides, and the number of insect resistance varieties and resistance level to pesticides are increasing year by year accordingly. These situations make the monitor motheds become the focus so that the detection methods have been improved. This paper introduced two groups of methods commonly used for detecting insecticide resistance: Bioassay methods and molecular biology methods. Bioassay methods include artificial diet mixed drug, leaf dipping, topical application, spray and dusting, residual film, soaking method and IRAC No.5. And molecular biology methods include PCR-REN, PASA, RAPD, TaqMan Real-time PCR, KASP and DNA sequencing. By comparing insect characteristics, environmental factors, experimental conditions and objectives, researchers could select appropriate detection methods to quickly obtain insecticide resistance information and timely and effectively adjust the insect control strategy.
insects; insecticide resistance; bioassay; molecular detection
2016-11-23; 接受日期:2017-03-31
先正达生物技术平台项目资助。
马玉婷,研发助理,主要从事植物基因分型及表达分析研究。E-mail:yuting.ma@syngenta.com。*通信作者:李相敢,首席科学家,主要从事基因转化和基因组编辑研究。E-mail:xianggan.li@syngenta.com
10.19586/j.2095-2341.2016.0153

