腺苷激酶抑制剂ABT-702在大鼠脑缺血再灌注损伤中的保护作用及机制
郭 升, 殷 闯, 谭 军
腺苷激酶抑制剂ABT-702在大鼠脑缺血再灌注损伤中的保护作用及机制
郭 升1, 殷 闯2, 谭 军2
目的 探讨腺苷激酶抑制剂ABT-702在大鼠脑缺血再灌注损伤中的作用。方法 雄性SD大鼠84只,随机分为对照组、假手术组、模型组、ABT-702组,每组21只,所有大鼠在再灌注后进行神经功能缺失评分,每组选取6只进行TTC染色检测梗死体积;各组再随机选取9只分为3个亚组,在不同时间点通过HPLC法检测脑组织腺苷含量;最后各组再随机选取6只通过PCR法检测Beclin1的表达。结果 ABT-702组神经缺失功能评分低于模型组;模型组及ABT-702组在再灌注后TTC染色均有梗死灶形成,但ABT-702组的梗死体积明显低于模型组;各组脑组织中均检测出腺苷,但ABT-702组的含量明显高于其它各组;通过PCR法检测发现各组均有自噬蛋白Beclin1的表达,但ABT-702组表达量更大。结论 ABT-702对大鼠缺血再灌注损伤具有保护作用,其机制可能是通过上调体内腺苷含量并增强自噬作用,从而减轻脑组织及神经元损伤的程度。
ABT-702; 缺血再灌注; 腺苷含量; Beclin1
腺苷(adenosine)是广泛存在于人体细胞内的内源性核苷,是神经系统中兴奋性的调剂递质,自1920年以来,腺苷已在医学及生物学研究中被证实对于神经、心血管等机体系统具有多种保护作用。腺苷激酶(adenosine kinase,ADK)是调节机体内腺苷代谢水平的关键酶,其将腺苷磷酸化后转换为腺嘌呤核糖核苷酸(Adenosine monophosphate,AMP),从而导致腺苷含量降低。近年来对腺苷的研究的过程中发现,腺苷在体内会被腺苷激酶在几秒钟之内磷酸化为磷酸腺苷,因此其半衰期短,故而选择通过直接给予外源性腺苷,很难被机体较长时间地有效利用。基于此,通过利用腺苷激酶抑制剂,抑制腺苷激酶的水平以提高腺苷水平逐渐成为研究热点。ABT-702是一种新型的非核苷类腺苷激酶抑制剂(见图1)[1],其通过抑制炎症等多种方式在疾病中起到保护作用[2],但是目前暂无相关研究及文献报道其在大鼠脑缺血性再灌注损伤中是否有保护作用。本研究通过建立缺血再灌注大鼠模型,观察应用ABT-702后,大鼠脑组织腺苷含量变化及脑缺血损伤自噬相关蛋白Beclin1的变化,来探索ABT-702在大鼠脑缺血性再灌注损伤中是否会起保护作用。
1 材料和方法
1.1 实验动物 选用的实验动物为新乡医学院动物实验中心提供的雄性Sprague-Dawley大鼠84只,体重均介于250~300 g之间。
1.2 主要试剂及仪器 腺苷激酶抑制剂ABT-702 dihydrochloride购自美国ApexBio公司,腺苷标准对照品购自Solarbio公司,HPLC法检测腺苷含量使用美国Agilent Technologies 1260 Infiniby高效液相色谱仪进行检测,Beclin1和β-actin引物由上海生工生物有限公司合成。
1.3 实验方法
1.3.1 实验分组 将雄性SD大鼠随机分为对照组、假手术组、模型组、ABT-702组,每组21只。其中对照组在处死前12 h禁止进食及禁水,假手术组、模型组、ABT-702组在术前12 h禁用食、水。
1.3.2 实验模型制备 模型组及ABT-702组使用尼龙线线栓法行大脑中动脉栓塞术(middle cerebral artery occlusion,MCAO)。SD雄性大鼠腹腔注射10%水合氯醛溶液(3 ml/kg)麻醉,将成功麻醉后的SD大鼠仰卧固定于大鼠解剖专用手术台上,对颈部皮肤进行备皮并消毒,用手术刀沿大鼠颈正中线纵向切开约2.5~3 cm皮肤,逐层分离肌肉,将大鼠的右侧颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)、颈内动脉(internal carotid artery,ICA)充分暴露并使用玻璃分针对其周围神经与血管进行充分分离。使用无菌缝线将ECA结扎,将ICA分离至颅底,动脉夹充分夹闭ICA及CCA后,使用眼科剪在CCA上剪出斜形小口,将准备好的尼龙线轻轻插入斜形小口,当线头进入到ICA后及时松开ICA上的动脉夹,继续插入尼龙线,使其到达至大脑中动脉(middle cerebral artery,MCA)处,插入的深度约为17~19 mm,将MCA的血流予以阻断。固定尼龙线,消毒并进行逐层缝合,皮肤外的尼龙线使用记号笔涂色,保持体温,并腹腔注射生理盐水2 ml,以防大鼠术后脱水。ABT-702组给予腺苷激酶抑制剂(ABT-702 3.0 mg/kg)腹腔注射,模型组给予腹腔注射同等剂量的生理盐水。栓塞2 h后,将尼龙线轻轻拔出至CCA主干,恢复大鼠大脑中动脉及Willis环的血液供应。假手术组仅切开颈部皮肤后,分离ICA、ECA、CCA后进行逐层缝合并给予消毒,术后给予生理盐水2 ml腹腔注射。对照组仅腹腔注射生理盐水2 ml。
1.3.3 神经功能缺失评分 模型组及ABT-702组大鼠再灌注后(空白组及假手术组在相同时间点进行评分),均进行神经功能缺失评分,评分标准采用Zea Longa[3]的5分制方法进行评价。评分方法:0分:未发现神经功能缺损的症状;1分:线栓对侧前上肢不能完全伸展;2分:大鼠行走时上肢不能伸展完全;3分:大鼠进行行走时向被阻塞大脑的对侧倾倒:4分:大鼠出现昏迷及意识丧失。1~3分为纳入标准,0分及4分为排除标准。
1.3.4 TTC染色计算梗死体积 各组选取6只大鼠于再灌注6 h后,将SD大鼠于冰盘上断头后,分离大脑,将大脑冷冻后(置于-20 ℃冰箱中快速冷冻),再在预冷的大鼠脑槽中,将大鼠大脑均匀切成5个冠状切片,将各冠状切片放置在2%TTC染液中(pH 7.4),将染液放入恒温箱(温度设定为38 ℃)染色30 min,之后将脑片放入4%多聚甲醛溶液中固定约20h左右,用高清数码相机对脑片进行拍照,利用Image Pro Plus 6.0软件进行图像分析,计算脑组织中梗死的体积。
1.3.5 HPLC法检测脑组织腺苷含量变化 各组选取9只大鼠,每个组别再分为3个亚组,分别于再灌注后2 h,6 h,12 h后在冰盘上断头取出大脑脑组织,并将脑组织迅速放于液氮内冻干,在冰冻状态下,对脑组织精确称重后,放入20 ml的组织匀浆器中,加入其质量(g)10倍体积(ml)的4 ℃高氯酸提取溶液(含乙二胺四醋酸二钠0.2 mmol/L和高氯酸0.1 mmol/L的混合溶液),在冰浴下充分研磨匀浆,于4 ℃离心机中以12000 r/min的速度离心10 min,取离心后的上清液经针头滤器过滤后,放入-80 ℃超低温冰箱中备用。应用高效液相色谱仪进行腺苷含量检测,进样时,色谱柱选用Bio Pearl-HC Column C18(4.6 mm×250 mm),流动相使用甲醇-水(含有磷酸氢二钠4 mmol/L,磷酸二氢钠50 mmol/L,pH值为5.8)(18:82),流速调试为1.2 ml/min,每次进样量为20 μl,色谱柱柱温设置为40 ℃,波长为254 nm,经软件分析后,计算脑组织中腺苷含量。
1.3.6 PCR法检测脑组织中Beclin1的表达 每组选取6只大鼠,在缺血再灌注6 h后,进行RT-PCR检测。Beclin1上游引物:5-TTCAAGATCCTGGACCGAGTGAC-3’,下游引物:5’-AGACACCATCCTGGCGAGTTC-3’,产物长度为142bp。
β-actin上游引物:5’-CACGATGGAGGGGCCGGACTCATC-3’,下游引物:5’-TAAAGACCTCTATGCCAACACAGT-3’,产物长度为240 bp。将取出的大鼠右侧额顶叶大脑皮质组织放入2 ml组织匀浆器内,加入Trizol组织提取液1 ml,充分研磨匀浆,提取脑组织中的总RNA,测出总RNA的浓度,同时计算A260/A280的比值。之后以总RNA为合成模板,将其合成为cDNA,再后以cDNA为模板进行PCR扩增,循环反应条件为:95 ℃,3 min;95 ℃,30 s;59 ℃,45 s;72 ℃,30 s,共循环40次;72 ℃,5 min。反应结束后于1%琼脂糖凝胶中电泳,经BIO-RAD成像系统进行影像显影,利用image J软件计算Beclin1的表达量。

2 结 果
2.1 神经功能缺失评分结果 对照组与假手术组无神经功能缺失症状,通过Zea Longa法进行评分后,均为0分,模型组与ABT-702组均有神经功能缺失症状,但ABT-702神经功能缺失评分低于模型组,差距具有统计学意义(P<0.05)(见表1)。
2.2 TTC染色后梗死体积 对照组及假手术组TTC染色后未见梗死区域,模型组及ABT-702组均可见大片梗死区域(TTC染色后为白色)。但ABT-702组梗死体积与模型组相比,梗死体积小于模型组,差距具有统计学意义(P<0.05)(见表2)。
2.3 HPLC法检测大鼠大脑腺苷含量变化 各组在再灌注后,分别通过HPLC法在不同时间点(2 h、6 h、12 h)进行脑组织中腺苷含量检测。结果提示,各组在各时间点均可以检测处腺苷的存在。对照组与假手术组两组对比,在各时间点腺苷含量水平没有差距,模型组与ABT-702组在再灌注2 h、6 h时腺苷含量均高于对照组与假手术组组。ABT-702组与模型组对比,ABT-702组在再灌注各时间段腺苷含量水平均高于模型组。但是在再灌注12 h后时ABT-702组的腺苷含量水平低于本组再灌注后2 h及6 h时的水平(见图2、表3)。
2.4 脑组织中Beclin1的表达 各组在再灌注6 h后,Beclin1均有表达,但模型组Beclin1的表达量高于对照组与假手术组。而ABT-702组的Beclin1表达量明显高于其它3组(见表4)。

表1 各组神经功能缺失评分±s)
与对照组、假手术组相比较▲P<0.05,与模型组相比较*P<0.05

表2 各组TTC染色后大脑梗死体积的比较±s)
与对照组、假手术组相比较▲P<0.05,与模型组相比较*P<0.05

表3 各组不同时间点腺苷含量变化±s)
与对照组、假手术组相比较▲P<0.05,与模型组相比较*P<0.05
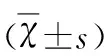
表4 各组在再灌注6 h后Beclin1的表达
与对照组、假手术组相比较▲P<0.05,与模型组相比较*P<0.05
图1 ABT-702的结构图
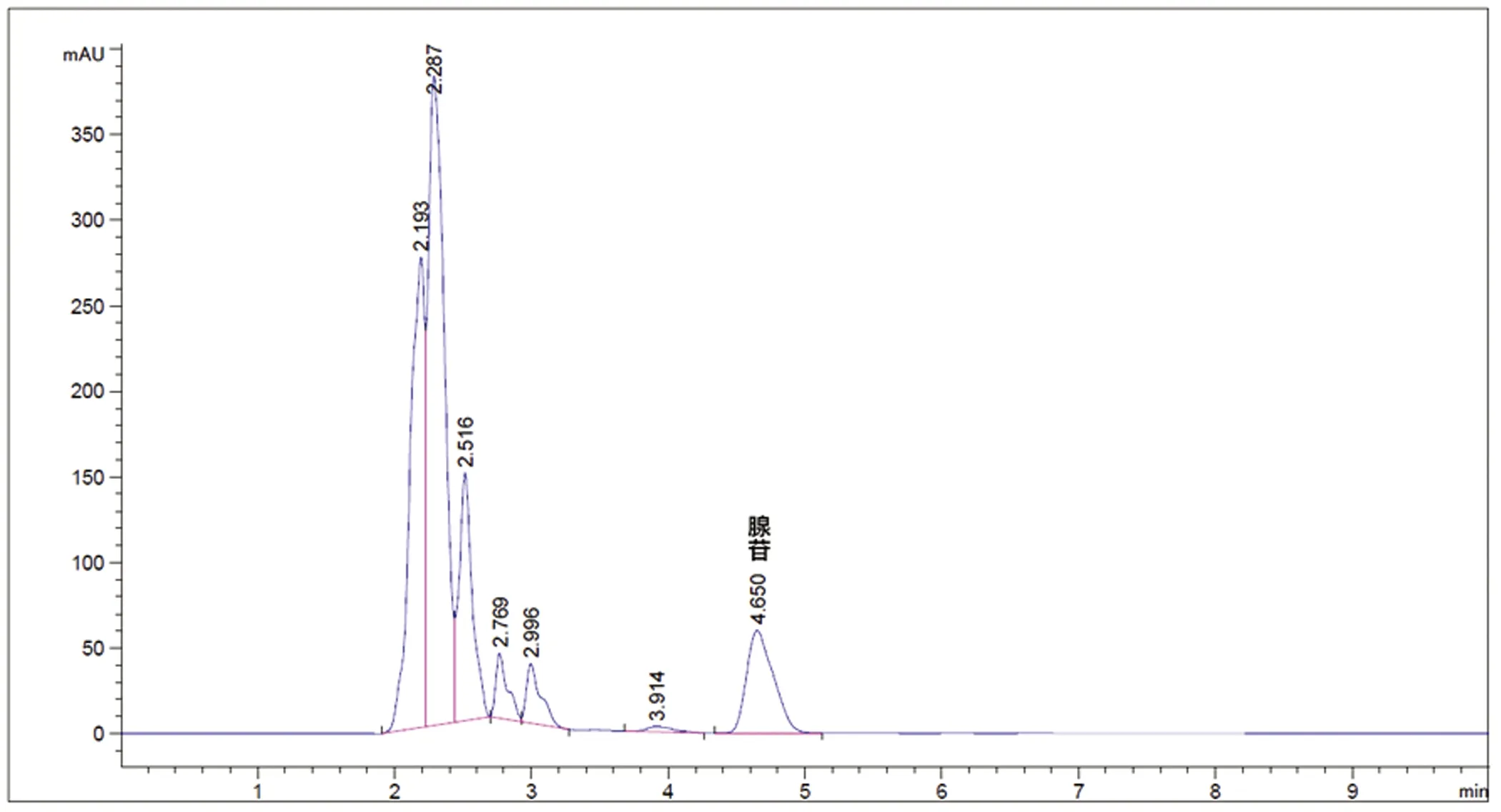
图2 HPLC法检测腺苷含量高效液相色谱图
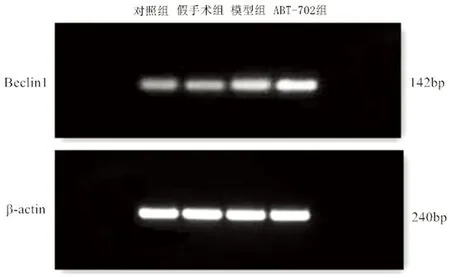
图3 RT-PCR法检测Beclin1的表达水平
3 讨 论
卒中在导致人类死亡的疾病中排名第2。腺苷已经被证实在缺血性脑损伤中具有保护作用,但腺苷半衰期短,在体内数秒内迅速被腺苷激酶磷酸化,降低机体内腺苷含量。动物大脑发育初期以及出现急性大脑损伤时,腺苷激酶会随之急剧升高,从而降低了颅内腺苷水平,所以可以通过抑制腺苷激酶而增加腺苷水平。5’-Amino-5’-deoxyadenosine、5’-iodotubercidin等早期的腺苷激酶抑制剂可以抑制腺苷激酶的水平,但是同时发现这些早期的抑制剂因为腺苷结构相近似,从而会产生多种毒副作用,由于它们在和腺苷一样,在体内半衰期短,口服的生物利用度和细胞穿透性差,缺乏药物选择性,易形成细胞毒性代谢物,因而应用受到限制[4,5]。研究发现非核苷类的腺苷激酶抑制剂生物利用度较高,细胞穿透性较强,且细胞毒性相对较小,且对细胞合成的DNA无明显的毒副作用,因而受到重视并引起新的研究热潮[6],非核苷类腺苷激酶抑制剂中,ABT-702作为一种新型的抑制剂,已被证实在年龄性听力功能损伤、糖尿病性肾病、视神经病变、佐剂性关节炎、糖尿病视网膜病变[7~10]等多种疾病中具有保护作用,也有学者通过18-FDG PET证实了ABT-702的增加降低了脑内局部区域的腺苷激酶的水平[11]。但是目前应用ABT-702进行缺血性脑血管病的研究尚少。
自噬是在真核细胞中发生的程序死亡中的一中特殊方式,自噬体将体内的蛋白质与其它成分的细胞以双侧膜的形式进行包裹,然后同体内的溶酶体相结合后形成自噬溶酶体,降解其所包裹的内容物,以此实现细胞本身的代谢需要和某些细胞器的更新,以维持机体的稳态和细胞的生长[12]。Beclin1基因又名BECN1,与酵母ATG6为同系物,Beclin 1是参与自噬调控的重要基因,其表达的强度与细胞自噬的发生有密切关系,早在1999年,Liang等已经证实通过上调Beclin1基因水平,能够促进自噬的发生[13]。Beclin1作为自噬发生的特异性标记蛋白,其应用在研究肿瘤、退行性神经病变、缺血性脑血管病等多个疾病领域中。2005年,Zhu等人研究发现,在缺血性脑损伤中,脑组织的自噬现象明显增多,但是在正常脑组织中,自噬现象发生较少[14]。
本研究通过制作大鼠脑缺血再灌注损伤模型,给予大鼠药物ABT-702应用,观察大鼠再缺血再灌注损伤中的损伤程度,发现在腺苷激酶抑制剂应用后,大鼠神经功能缺损症状减轻,其缺血后梗死的面积也明显减少。同时,为了证实是否是因药物保护而使缺血再灌注损伤减轻,通过高效液相色谱仪进行腺苷含量的测定,发现药物应用后,腺苷含量明显升高,并且应用ABT-702后,在再灌注6 h时腺苷含量最高,而腺苷对脑缺血性损伤有明显的保护作用,从而证实了ABT-702抑制了腺苷激酶,提高了损伤后大鼠脑组织内的腺苷含量。而为研究ABT-702是否在大鼠脑缺血性损伤中增强细胞自噬,通过PCR对Beclin1进行检测,发现在应用ABT-702后Beclin1蛋白水平明显升高,因此,提示腺苷激酶抑制剂可能通过增强损伤后细胞自噬,在脑缺血再灌注损伤中起到保护作用。但是ABT-702对激活自噬的具体机制以及在自噬发生的上下游通路中的作用,尚不清楚,需进一步研究,以便为今后缺血性脑血管的深入研究以及新的药物治疗靶点提供了新的思路。
[1]Boyle DL,Kowaluk EA,Jarvis MF,et al. Anti-inflammatory effects of ABT-702,a novel non-nucleoside adenosine kinase inhibitor,in rat adjuvant arthritis[J]. J Pharmacol Exp Ther,2001,296(2):495-500.
[2]Pye C,Elsherbiny NM,Ibrahim AS,et al. Adenosine kinase inhibition protects the kidney against streptozotocin-induced diabetes through anti-inflammatory and anti-oxidant mechanisms[J]. Pharmacol Res,2014,85:45-54.
[3]Longa EZ,Weinstein PR,Carlson S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[4]Kowaluk EA,Jarvis MF. Therapeutic potential of adenosine kinase inhibitors[J]. Expert Opin Investig Drugs,2000,9(3):551-564.
[5]Otsuguro K,Tomonari Y,Otsuka S,et al. An adenosine kinase inhibitor,ABT-702,inhibits spinal nociceptive transmission by adenosine release via equilibrative nucleoside transporters in rat[J]. Neuropharmacology,2015,97:160-170.
[6]Butini S,Gemma S,Brindisi M,et al. Non-nucleoside inhibitors of human adenosine kinase:synthesis,molecular modeling,and biological studies[J]. J Med Chem,2011,54(5):1401-1420.
[7]Vlajkovic SM,Guo CX,Telang R,et al. Adenosine kinase inhibition in the cochlea delays the onset of age-related hearing loss[J]. Exp Gerontol,2011,46(11):905-914.
[8]Steinsapir KD,Goldberg RA. Traumatic optic neuropathy:an evolving understanding[J]. Am J Ophthalmol,2011,151(6):928-933.
[9]Ahmad S,Elsherbiny NM,Bhatia K,et al. Inhibition of adenosine kinase attenuates inflammation and neurotoxicity in traumatic optic neuropathy[J]. J Neuroimmunol,2014,277(1/2):96-104.
[10]Zhu XF,Zou HD. PEDF in diabetic retinopathy:a protective effect of oxidative stress[J]. J Biomed Biotechnol,2012,2012:580687.
[11]Parkinson FE,Paul S,Zhang D,et al. The effect of endogenous adenosine on neuronal activity in rats:an FDG PET study[J]. J Neuroimaging,2016,26(4):403-405.
[12]Deretic V. Multiple regulatory and effector roles of autophagy in immunity[J]. Curr Opin Immunol,2009,21(1):53-62.
[13]Liang XH,Jackson S,Seaman M,et al. Induction of autophagy and inhibition of tumorigenesis by beclin 1[J]. Nature,1999,402(6762):672-676.
[14]Zhu C,Wang X,Xu F,et al. The influence of age on apoptotic and other mechanisms of cell death after cerebral hypoxia-ischemia[J]. Cell Death Differ,2005,12(2):162-176.
The Effects of ABT-702 on Ischemia-reperfusion Injury of Brain in Rats
GUOSheng,YINChuang,TANJun.
(TheFirstAffiliatedHospitalofXinxiangMedicalUniversity,Xinxiang453100,China)
Objective To investigate the effect of adenosine kinase inhibitor ABT-702 on ischemia-reperfusion injury in rats. Methods 84 male rats were randomly divided into control group,sham operation group,model group and ABT-702 group,21 rats in each group. All rats
neurological deficit score after reperfusion. We selected 6 rats to detect the infarct volume according to TTC staining in each group. Then we selected 9 rats and divided into three subgroups randomly to detect the adenosine content of brain tissue by High Performance Liquid Chromatography(HPLC) at different time points in each group. Six rats were randomly selected to detect the Beclin1 expression by RT-PCR in each group at last. Results The neurological functional score of ABT-702 group was lower than that model group;Both model group and ABT-702 group had the infarct after reperfusion according to TTC staining. But the infarct volume of ABT-702 group was significantly lower than the model group;The adenosine was contained in brain tissues of all groups,but the ABT-702 group was significantly higher than other groups;The autophagy marker protein Beclin1 was expressed in each group by PCR method but the ABT-702 group expressed more Beclin1 than other groups. Conclusion ABT-702 has protective effects on ischemia reperfusion injury in rats. The mechanism may be reduce the degree of damage of brain tissue and neurons by increasing the level of adenosine and enhancing the autophagy.
ABT-702; Ischemia reperfusion; Adenosine content; Beclin1
1003-2754(2017)07-0621-04
2017-03-05;
2017-06-20
(1.新乡医学院第一附属医院,河南 新乡 453100;2.新乡医学院第三附属医院,河南 新乡 453003) 通讯作者:谭 军,E-mail:tanjun1997@126.com
R743.3
A

