小麦LBD基因家族的全基因组鉴定、表达特性及调控网络分析
邢光伟,王梦醒,马小飞,赵 贤,张 婷,聂小军,宋卫宁
(1.西北农林科技大学农学院,陕西杨陵 712100; 2.山西省农业科学院小麦研究所,山西临汾 041000)
小麦LBD基因家族的全基因组鉴定、表达特性及调控网络分析
邢光伟1,王梦醒1,马小飞2,赵 贤1,张 婷1,聂小军1,宋卫宁1
(1.西北农林科技大学农学院,陕西杨陵 712100; 2.山西省农业科学院小麦研究所,山西临汾 041000)
为深入发掘小麦LBD基因的功能,利用小麦最新基因组数据,通过生物信息学手段,对小麦LBD基因家族进行了鉴定,并对其表达特性及调控网络进行了分析。鉴定结果表明,本研究得到了75个小麦LBD基因,根据系统进化分析结果,可将它们划分为Class Ⅰ和Class Ⅱ两个亚家族。染色体定位结果表明,除了5D和7D外,其余染色体均含有LBD基因。共表达调控网络分析表明,15个LBD基因参与了小麦功能基因调控。利用RNA-seq数据对所有小麦LBD基因在不同组织以及不同逆境胁迫下的表达情况进行分析表明,小麦LBD基因在不同组织间和胁迫下存在着差异表达,多个组织特异和胁迫响应相关LBD基因被鉴定到,可作为后续功能研究的候选基因。
小麦;LBD基因家族;逆境胁迫;共表达网络;表达谱
LBD(Lateral organ boundaries domain)基因也称作AS2/LOB基因,是一类植物中特有的转录因子基因家族。LBD通常包含四个高度保守的半胱氨酸基序CX2CX6CX3C,这是LBD家族最明显的特征[1]。同时,也发现一些LBD含有甘氨酸组成的GAS基序和类亮氨酸拉链基序LX6LX3LX6L[2]。根据这些保守结构域,前人将LBD转录因子家族分为两个亚家族ClassⅠ和ClassⅡ。其中,ClassⅠ包含上述三个完整基序,ClassⅡ包含完整的CX2CX6CX3C基序及残留的GAS基序和类亮氨酸拉链基序LX6LX3LX6L。根据含有的保守结构域数目和分布情况,ClassⅠ亚家族又可细分为ⅠA-ⅠE五个亚类[3]。迄今,多个物种的LBD转录因子家族已经在全基因组水平被鉴定和研究,如玉米基因组中鉴定到了44个LBD基因,在水稻中鉴定到了35个[4-5]。在此基础上,对LBD基因的生物学功能也开展了较为深入地研究。在拟南芥中, AS1和 AS2基因能够通过抑制KNOX基因的表达来形成对称叶片[6]; AtLBD16和 AtLBD18调控了侧根最初的形成,并且能够下调 ARF7和 ARF9的表达[7]; AtASL9参与调控了细胞分裂素的生物学合成[8]。在水稻中, OsARL1基因编码含有LBD结构域的蛋白,能够响应生长素调节因子,并参与生长素调节的细胞分化过程[9]; OsAS2基因参与嫩枝的分化和叶片的发育[10]; OsLBD3-7可能作为下游调控基因,参与了叶片卷曲的调控过程[11]。在大豆中, GmLBD12能够被干旱、盐胁迫和植物激素诱导表达[12]。这些研究表明,LBD基因广泛参与植物的生长发育调控和逆境胁迫响应过程。
小麦是世界上最重要的粮食作物之一[13]。从遗传上讲,小麦是由三个近缘祖先种经历两轮自然杂交而产生的异源六倍体[14]。因此,小麦的基因组巨大且复杂(约17 Gb),为开展小麦基因组研究带来了巨大挑战[15]。2014年,基于单条染色体测序的小麦品种中国春全基因组测序的完成,为小麦基因组学研究和小麦的基因家族鉴定奠定了基础[16]。目前,有关小麦LBD基因家族的全基因组鉴定还未见报道,这限制了小麦LBD基因的生物学功能的深入研究。鉴于此,本研究利用最新的小麦基因组信息,通过生物信息学方法对小麦LBD基因家族的组成在全基因组水平上进行了鉴定,并进一步对其基因结构、保守结构域、染色体分布、启动子顺式作用元件、参与的调控网络和时空表达特性进行了系统地分析,以期为小麦LBD基因的功能研究提供有益信息。
1 材料与方法
1.1 小麦LBD家族成员的全基因组鉴定
首先,在Ensembl Plants数据库(http://plants.ensembl.org/index.html)中下载小麦全基因组数据,将下载到的蛋白序列使用BLAST构建本地数据库,利用拟南芥中LBD家族(http://www.arabidopsis.org/browse/genefamily/lob.jsp)蛋白序列作为query序列进行BLASTP(1e-5)搜索;同时,在Pfam数据库(http://pfam.xfam.org/)中下载LBD典型结构域(PF03195)作为搜索模型,利用HMM 3.0软件筛选含有该结构域的蛋白序列。将利用上述两种方法筛选到的候选蛋白序列合并,然后利用DNAMAN 5.0软件进行多重比对,手工去除不完整读码框序列和冗余序列。利用Pfam及NCBI-CDD工具检测候选蛋白结构域,去掉保守结构域不完整的序列,最终得到小麦LBD基因。利用ExPASy(http://web.expasy.org/protparam/)在线软件对小麦LBD蛋白的分子量、氨基酸长度和等电点进行预测;利用cello软件进行亚细胞定位[17]。
1.2 系统发育树构建、基因结构分析和蛋白结构域序列比对分析
首先,从拟南芥基因组数据库(http://www.arabidopsis.org/browse/genefamily/lob.jsp)和水稻基因组数据库(http://rice.plantbiology.msu.edu/)中检索并下载其LBD蛋白,然后利用Clustal_W工具将小麦、水稻和拟南芥LBD蛋白序列进行多重比对;将比对结果,利用MEGA 7.0软件,采用邻接法(NJ)构建系统发育树[18],Bootstrap参数设置为1 000。根据小麦基因组注释信息,获得各小麦候选LBD基因的外显子-内含子结构信息,并利用在线软件GSDS 2.0(http://gsds.cbi.pku.edu.cn/)进行图像显示。采用MEME工具(http://meme-suite.org/)预测各小麦LBD蛋白序列中的保守结构域,并利用DNAMAN 5.0软件进行结构域序列多重比对,比对参数为默认值。
1.3 染色体定位和顺式作用元件分析
根据小麦基因组注释信息(http://plants.ensembl.org/index.html)及BLASTN比对结果,获得小麦LBD基因的染色体位置信息。利用Circos 0.67软件展示LBD基因在染色体上的物理位置[19]。利用perl程序截取各个小麦LBD基因上游1.5 kb的基因组序列,然后递交到启动子预测数据库Plant Care(http://bioinformatice.psb.ugent.be/webtools/plantcare/html/)进行启动子顺式作用元件地预测并手工整理。
1.4 小麦LBD基因的组织表达模式分析、逆境表达分析和互作网络分析
在WHEAT URGI数据库(http://urgi.versailles.inra.fr/files/RNASeqWheat/)中下载小麦5个组织(根、茎、叶、穗和籽粒)的转录组数据,从NCBI Sequence Read Archive(SRA)数据库下载低温(SRR1460552、SRR1460549)、干旱(SRR1542407、SRR1542409)和热(SRR1542411、SRR1542413)胁迫下转录组数据;利用TopHat和Cufflinks软件进行转录组reads的全基因组mapping,计算各个LBD基因的FPKM值,并鉴定差异表达基因,利用R软件绘制表达谱热图[20]。最后,基于小麦和拟南芥中的同源基因,利用STRING 工具(http://string-db.org/cgi) 和AraNetV2工具 (http://www.inetbio.org/aranet/) 分析小麦LBD基因参与的互作调控网络。
2 结果与分析
2.1 小麦LBD基因家族成员鉴定
利用BLASTP比对和HMM比对两种方法,从小麦基因组中共鉴定出80个LBD转录因子候选基因,进一步的保守域和基因结构验证发现,其中5个基因的LBD保守结构域不完整,剔除后,最终得到了75个包含有完整特征结构域的小麦LBD基因,根据其在染色体上的位置,将其命名。小麦LBD基因的蛋白序列长度为175~384 aa,分子量为18.7~41.9 kDa,等电点介于4.75~9.66之间,表明LBD基因存在较大的组成变异。同时,亚细胞定位发现,有33个小麦LBD基因定位在叶绿体,6个在线粒体,另外的36个在细胞核中。
2.2 小麦LBD基因的系统进化、保守结构域和基因结构分析
为明确小麦LBD基因的分类和进化关系,将鉴定到的小麦LBD基因与已报道的水稻和拟南芥LBD基因进行了系统进化分析。结果(图1)发现,所有基因聚为6大类,而且大类中均包含有小麦、水稻和拟南芥的LBD基因,暗示LBD基因的分化发生在单子叶和双子叶植物分化之前;根据系统进化树及水稻和拟南芥LBD基因家族的分类信息,可将75个小麦LBD基因分为两大类,即ClassⅠ和ClassⅡ亚家族,ClassⅠ亚家族又可以进一步细分为ⅠA-ⅠE[5,7],其中,小麦ClassⅠ亚家族包含60个成员,ClassⅡ包含15个成员(图2a)。
利用MEME工具对小麦LBD基因的保守结构域组成和数目进行了分析,结果(图2b)发现,75个小麦LBD基因中共有15个保守的蛋白基序。其中,基序1和基序3最为保守,在所有小麦LBD基因中均被鉴定到,而其他保守结构域只在部分基因中鉴定到。进一步的分析发现,所有的ClassⅠLBD基因都含有保守基序1、2和3,而ClassⅡ均含有基序1、3和5,表明同一亚家族成员间具有相似的保守结构域组成,而不同亚家族成员间具有各自特异的保守结构域,这可能与其具体的生物学功能相关。
基因的结构是决定基因表达和功能的重要因素。最后,对小麦LBD基因家族的基因结构进行了分析。结果(图2c)发现,小麦LBD家族的基因结构相对简单,其外显子数目在1~4之间,其中28个LBD基因只含有一个外显子,不包含内含子,其余的包括了1~3个内含子。从亚家族来看,整体上,每个亚家族成员间的基因结构基本一致,各个亚家族之间存在一定差异,其中,ⅠC亚家族基因与其他亚家族基因相比,内含子多,基因结构复杂一些。
2.3 小麦LBD基因的染色体定位和顺式作用元件分析
根据BLASTN和基因组注释信息,将鉴定得到的小麦LBD进行染色体定位。结果(图3)发现,除了 Ta-U-LBD67、 Ta-U-LBD68、 Ta-U-LBD69和 Ta-U-LBD70外,另外的71个小麦LBD基因均可以定位到小麦染色体的scaffold序列上。在小麦的A、B和D三个同源染色体组中,分别含有24、24和23个LBD基因,暗示小麦LBD基因的含量在A、B和D亚基因组中没有显著变化,在小麦两次自然杂交并加倍的过程中,同源染色体的保留和丢失在亚基因组间没有明显偏好。进一步根据染色体定位结果和序列相似性,可将71个小麦LBD基因分为30个同源基因群,其中,17个同源基因群包含A、B、D三个同源拷贝,7个只包含A、B、D三个同源基因中的两个拷贝,而6个只包含A、B、D同源拷贝中的一个。这表明在小麦多倍体化过程中,LBD同源基因也发生了部分丢失的情况,进一步弄清同源基因保留和丢失的规律将为揭示小麦多倍化进化提供重要信息。

图1 小麦、拟南芥和水稻LBD基因家族的系统进化树Fig.1 Phylogenetic tree of LBD genes in wheat,Arabidopsis and rice
顺式作用元件在调节基因转录和表达方面发挥重要作用。本研究对鉴定的75个小麦LBD候选基因启动子区域的顺式作用元件进行了分析,结果共鉴定到了42个顺式作用元件,主要包括生长发育相关、响应逆境和光调节三类。其中,脱落酸响应元件ABRE在大多数(2/3)小麦LBD基因中被检测到,特别是 Ta-3B-LBD17和 Ta-6A-LBD60,分别含有8个和10个ABRE元件,表明其可能参与了小麦ABA代谢调控过程。另外,小麦LBD基因的顺式作用元件中还含有丰富的光调节因子,如sp1和G-box。所有的小麦LBD基因均含有sp1,平均每个基因含有4.1个,暗示小麦LBD基因的表达可能受光调节。
2.4 小麦LBD基因参与的互作调控网络分析
本研究基于同源基因预测方法,参考已构建好的拟南芥基因互作网络(http://www.inetbio.org/aranet/),构建了小麦LBD基因与其他基因的调控网络(图4)。结果发现,15个小麦LBD基因与其他小麦基因存在互作关系,形成了152个互作分支。LBD调控的基因主要是与生长发育相关,表明小麦LBD基因广泛地参与调控了小麦生长发育过程。 Ta-2B-LBD73和 Ta-2D-LBD74与大量的基因存在互作关系,包括生长发育、逆境胁迫、激素响应、光调节等方面的基因,如 IAA4、 IAA9、 MYB3、 MYB5、 ERF8和 SPL10等,表明这两个基因可能在小麦生长发育过程中起到重要作用;而 Ta-3A-LBD11与 KAN1、 KAN2基因存在互作关系,根据前人的研究, KAN1和 KAN2参与了植物横轴依赖型侧生器官发育[21],暗示 Ta-3A-LBD11可能与小麦侧根发育有关。
2.5 小麦LBD基因的表达模式分析
为探究LBD基因在小麦生长发育过程中的潜在生物学功能,利用RNA-Seq数据对小麦LBD基因在5个不同组织(根、茎、叶、种子、穗)的表达情况进行了研究。结果(图5)发现,小麦LBD基因在不同组织的表达模式有明显差异,部分LBD基因在5个组织中表达量均较低。 Ta-4A-LBD34、 Ta-4B-LBD43和 Ta-4D-LBD54在根中的表达量明显高于其他4个组织,前人研究发现其水稻同源基因 Os-LBD3参与了根冠的形成,表明这些基因可能在小麦根部的形态建成过程中发挥重要作用[22]。 Ta-2D-LBD74、 Ta-2A-LBD72和 Ta-2D-LBD75在根和穗中的表达量较高,在茎中无表达,表明这3个基因在小麦根和穗的形态建成中可能具有重要作用。

图2 小麦LBD基因家族的系统进化(a)、保守结构域(b)和基因结构(c)Fig.2 Phylogenetic relationships (a),conserved motifs (b),gene structure (c) of LBD genes in wheat


进一步,利用转录组数据分析了小麦LBD家族基因在冷冻、高温和干旱胁迫下的表达情况。结果(图6、图7)发现, Ta-4A-LBD34、 Ta-4B-LBD43和 Ta-4D-LBD54在4 ℃处理下的表达量低于23 ℃,而 Ta-2B-LBD73表现出明显的上调表达;在高温和干旱胁迫下, Ta-2A-LBD72、 Ta-2B-LBD73和 Ta-2D-LBD75三个同源基因的表达模式相同,均为上调表达,表明它们在小麦逆境响应过程发挥了重要作用。
3 讨 论
随着测序技术的不断发展和成熟,越来越多的植物基因组被解析,使得从全基因组水平鉴定植物基因家族成为了可能。植物基因家族的全基因组鉴定及其结构、进化和表达特性分析不仅为进一步的基因功能研究提供重要参考,也将为植物基因组进化等研究提供了有益信息。LBD家族是一类植物所特有的转录因子基因家族,参与调控了植物众多生长发育过程[6-12]。本研究利用最新的小麦基因组信息对小麦LBD基因家族进行了鉴定,结果从小麦基因组中鉴定到了75个小麦LBD基因,其数量上远多于拟南芥(43)、大麦(34)和水稻(35)[3,5,23],这可能是小麦是异源六倍体,在进化过程中经历了3个二倍体祖先种的两轮自然加倍,使得其基因组也经历了2次扩张,造成LBD基因数目加倍。同时,系统进化分析也发现部分小麦LBD基因在长期的进化过程中出现了基因复制事件。
顺式作用元件通过响应不同外界环境信号来调节基因转录过程,进而影响植物的生长发育[24]。本研究发现,小麦LBD基因启动子区域共有42类不同顺式作用元件,主要包括ABA响应元件ABRE和光响应元件sp1和G-box等,暗示小麦LBD基因在调节组织生长和发育过程中可能受到ABA和光的影响,这与前人的研究一致[25]。
LBD基因广泛参与基因互作。在拟南芥中, AS1 和 AS2 基因能够通过抑制 KNOX 基因的表达来形成对称叶片[6]; AtLBD16 和 AtLBD18 调控了侧根最初的形成,并且能够下调 ARF7 和 ARF9 的表达[7]。 本研究发现共有15个小麦LBD基因参与了其他基因的表达调控,其中, Ta-3A-LBD11 参与WOX和KAN基因的调控,表明 Ta-3A-LBD11 很可能具有调节小麦侧生器官生长发育的作用。另外, Ta-2B-LBD73 、 Ta-2D-LBD74 和大量的基因存在互作关系,包括生长发育、逆境胁迫、激素响应、光调节等方面的基因,如 IAA4 、 IAA9 、 MYB3 、 MYB5 、 ERF8 和 SPL10 等。Jung等[26]研究表明,IAA在水稻中能够响应干旱胁迫和调节分蘖。表明以上两个基因在响应干旱胁迫和分蘖过程中可能具有重要作用。
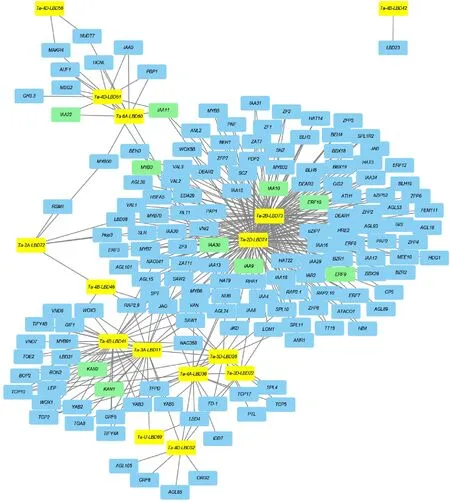
图4 基于拟南芥同源基因构建的小麦LBD基因互作网络Fig.4 Interaction network of LBD genes in wheat according to the orthologs in Arabidopsis

红色表示基因的表达较强,绿色表示没有表达信号。下同。
The red color represents the higher expression of relative gene,and green color indicates no expression signal. The same in figure 6 and 7.
图5 小麦LBD基因在不同组织中的表达
Fig.5 Expression profiles ofTaLBDgenes in different organs or tissues

图6 小麦LBD基因在冷胁迫下的表达Fig.6 Expression profiles of TaLBD genes under cold stress

1和2:热胁迫处理1 h和6 h;3和4:干旱胁迫处理1 h和6 h。
1 and 2:Treatment for 1 h and 6 h under heat stress,respectively;3 and 4:Treatment for 1 h and 6 h under drought strees,respectively.
图7 小麦LBD基因在热及干旱胁迫下的表达
Fig.7 Expression profiles ofTaLBDgenes under heat and drought stress
拟南芥和水稻等作物中的研究表明,LBD中的ClassⅠ亚家族基因成员主要参与生长发育调控,而ClassⅡ类亚家族成员除了参与生长发育调控,还可能参与了响应各种逆境胁迫过程[5]。本研究利用转录组数据对小麦LBD基因在不同组织、不同胁迫下的表达特性进行了分析,结果显示, ClassⅠ亚家族基因成员 Ta-4A-LBD33 、 Ta-4B-LBD39 和 Ta-4D-LBD50 在根中表达量较高,ClassⅡ亚家族基因成员 Ta-4A-LBD34 、 Ta-4B-LBD43 和 Ta-4D-LBD54 在根、茎和叶中表达,在种子和穗中无表达,暗示这些基因在小麦生长发育过程中可能主要参与了营养生长阶段的调控;ClassⅡ亚家族的 Ta-4A-LBD34 、 Ta-4B-LBD43 和 Ta-4D-LBD54 在冷胁迫下差异表达,表明它们在逆境响应方面具有重要调控作用, Ta-2A-LBD72 、 Ta-2B-LBD73 和 Ta-2D-LBD75 在高温和干旱胁迫下表达量上调,表明其可能在热胁迫和高温胁迫响应方面发挥作用。
[1]MAJER C,HOCHHOLDINGER F.Defining the boundaries:structure and function of LOB domain proteins [J].TrendsinPlantScience,2011,16(1):47.
[2]SHUAI B,REYNAGA-PENA C G,SPRINGER P S.The lateral organ boundaries gene defines a novel,plant-specific gene family [J].PlantPhysiology,2002,129(2):747.
[3]GUO B J,WANG J,LIN S,etal.A genome-wide analysis of the ASYMMETRIC LEAVES2/LATERAL ORGAN BOUNDARIES (AS2/LOB) gene family in barley(HordeumvulgareL.) [J].JournalofZhejiangUniversity-ScienceB,2016,17(10):763.
[4]ZHANG Y M,ZHANG S Z,ZHENG C C.Genomewide analysis of LATERAL ORGAN BOUNDARIES Domain gene family inZeamays[J].JournalofGenetics,2014,93(1):79.
[5]YANG Y,YU X,WU P.Comparison and evolution analysis of two rice subspeciesLATERALORGANBOUNDARIESdomain gene family and their evolutionary characterization fromArabidopsis[J].MolecularPhylogeneticsandEvolution,2006,39(1):248.
[6]SEMIARTI E,UENO Y,TSUKAYA H,etal.TheASYMMETRICLEAVES2 gene ofArabidopsisthalianaregulates formation of a symmetric lamina,establishment of venation and repression of meristem-related homeobox genes in leaves [J].Development,2001,128(10):1771.
[7]LEE H W,KIM N Y,LEE D J,etal. LBD18/ASL20 regulates lateral root formation in combination with LBD16/ASL18 downstream of ARF7 and ARF19 inArabidopsis[J].PlantPhysiology,2009,151(3):1377.
[8]NAITO T,YAMASHINO T,KOIZUMI N,etal.A link between cytokinin and ASL9 (ASYMMETRIC LEAVES 2 LIKE 9) that belongs to the AS2/LOB(LATERAL ORGAN BOUNDARIES) family genes inArabidopsisthaliana[J].Bioscience,Biotechnology,andBiochemistry,2007,71(5):1269.
[9]LIU H J,WANG S F,YU X B,etal.ARL1,a LOB-domain protein required for adventitious root formation in rice [J].ThePlantJournal,2005,43(1):47.
[10]MA Y,WANG F,GUO J,etal.Rice OsAS2 gene,a member of LOB domain family,functions in the regulation of shoot differentiation and leaf development [J].JournalofPlantBiology,2009,52(5):374.
[11]LI C,ZOU X H,ZHANG C Y,etal. OsLBD3-7 overexpression induced adaxially rolled leaves in rice [J].PloSOne,2016,11(6):e0156413.
[12]YANG H,SHI G X,DU H Y,etal.Genome-wide analysis of soybean-containing genes:A functional investigation ofLATERALORGANBOUNDARIESDomainGmLBD12 [J].ThePlantGenome,2017,10(1):1.
[13]GILL B S,APPELS R,BOTHA-OBERHOLSTER A M,etal.A workshop report on wheat genome sequencing:International genome research on wheat consortium [J].Genetics,2004,168(2):1087.
[14]WICKER T,MAYER K F,GUNDLACH H,etal.Frequent gene movement and pseudogene evolution is common to the large and complex genomes of wheat,barley,and their relatives [J].ThePlantCell,2011,23(5):1706.
[15]BERKMAN P J,VISENDL P,LEE H C,etal.Dispersion and domestication shaped the genome of bread wheat [J].PlantBiotechnologyJournal,2013,11(5):564.
[16]International Wheat Genome Sequencing C.A chromosome-based draft sequence of the hexaploid bread wheat (Triticumaestivum) genome [J].Science,2014,345(6194):1251788.
[17]YU C S,CHEN Y C,LU C H,etal.Prediction of protein subcellular localization [J].Proteins:Structure,Function,andBioinformatics,2006,64(3):643.
[18]KUMAR S,STECHER G,TAMURA K.MEGA 7:Molecular evolutionary genetics analysis version 7.0 for bigger datasets [J].MolecularBiologyandEvolution,2016,33:1870.
[19]KRZYWINSKI M,SCHEIN J,BIROL I,etal.Circos:an information aesthetic for comparative genomics [J].GenomeResearch,2009,19(9):1639.
[20]TRAPNELL C,ROBERTS A,GOFF L,etal.Differential gene and transcript expression analysis of RNA-seq experiments with TopHat and Cufflinks [J].NatureProtocols,2012,7:562.
[21]IWAKAWA H,IWASAKI M,KOJIMA S,etal.Expression of the ASYMMETRIC LEAVES2 gene in the adaxial domain ofArabidopsisleaves represses cell proliferation in this domain and is critical for the development of properly expanded leaves [J].ThePlantJournal,2007,51:173.
[22]INUKAI Y,SAKAMOTO T,UEGUCHI-TANAKA M,etal. Crown rootless1,which is essential for crown root formation in rice,is a target of an AUXIN RESPONSE FACTOR in auxin signaling [J].ThePlantCell,2005,17(5):1387.
[23]YOKO M,HIDEKAZU L,YASUNORI M,etal.Characterization of genes in the ASYMMETRIC LEAVES2/LATERAL ORGAN BOUNDARIES (AS2/LOB) family inArabidopsisthalina,and functional and molecular comparisons between AS2 and other family members [J].ThePlantJournal,2009,58(3):525.
[24]KONG F,WANG J,CHENG L,etal.Genome-wide analysis of the mitogen-activated protein kinase gene family inSolanumlycopersicum[J].Gene,2012,499(1):108.
[25]KUMAR G M,MAMIDALA P,PODILE A R.Regulation of polygalacturonase-inhibitory proteins in plants is highly dependent on stress and light responsive elements[J].PlantOmics,2009,2(6):238.
[26]JUNG H,LEE D K,DO CHOI Y,etal.OsIAA6,a member of the rice Aux/IAA gene family,is involved in drought tolerance and tiller outgrowth[J].PlantScience,2015,236:304.
Genome-Wide Analysis,Expression Characteristics and Regulatory Network ofLBDGene Family in Bread Wheat(TriticumaestivumL.)
XING Guangwei1,WANG Mengxing1,MA Xiaofei2,ZHAO Xian1,ZHANG Ting1,NIE Xiaojun1,SONG Weining1
(1.College of Agronomy,Northwest A&F University,Yangling,Shaanxi 712100,China;2.Wheat Research Institute,Shanxi Academy of Agriculture Sciences,Linfen,Shanxi 041000,China)
In order to explore the function of wheatLBDgenes,theLBDgene family in wheat was identified by bioinformatics,using the latest genome data of wheat. A total of 75 wheatLBDgenes were identified. According to the phylogenetic analysis,they could be divided into chass Ⅰ and class Ⅱ subfamilies. Chromosome mapping results showed that,except for 5D and 7D,the other chromosomes contained theLBDgenes. Among them,a further analysis of the co-expression regulation network found that 15 wheatLBDgenes were involved in the regulation of wheat functional genes. Finally,the RNA-seq data was used to analyze the expression ofLBDgenes in different tissues and under different stresses.The results showed that theLBDgenes of wheat were differentially expressed in different tissues and under different stresses,and some tissue-specific and stress-relatedLBDgenes were identified and could be used as candidate genes for subsequent functional studies.
TriticumaestivumL.;LBDgene family; Abiotic stress; Co-expression network; Expression profiles
时间:2017-07-07
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170707.1815.002.html
2017-03-04
2017-06-22
国家自然科学基金项目(31571647;31401373)
E-mail:1512643107@qq.com
宋卫宁(E-mail:sweining2002@yahoo.com)
S512.1;S330
A
1009-1041(2017)07-0855-09

