辣椒矮秆突变体的表型及其对外源激素的响应
杨博智,周书栋,杨莉颖,马艳青,邹学校*
辣椒矮秆突变体的表型及其对外源激素的响应
杨博智1,2,周书栋1,2,杨莉颖1,2,马艳青1,2,邹学校1,2*
(1.中南大学隆平分院,湖南长沙 410100;2.湖南省农业科学院蔬菜研究所,湖南长沙 410125)
于EMS诱变辣椒自交系6421种子所构建的突变体库获得1份矮秆突变体(命名为E29),观察E29的表型和细胞学特征,研究E29突变性状的遗传规律和赤霉素(GA3)、24–表油菜素内酯(24–eBR)及生长素(IAA)对E29种子萌发和幼苗生长的影响。结果表明:与自交系6421相比,E29表现出植株矮化,叶片变大、变厚,叶色变深等特征;显微观察结果显示,E29变矮是由于其茎秆伸长区细胞长度缩短,叶片变大、变厚是由于其叶肉细胞变大及细胞数增加;遗传分析结果表明,突变性状由单隐性基因控制;外施不同质量浓度的激素,发现4.0 mg/L GA3处理显著促进E29的根与下胚轴伸长,1.0 ~ 4.0 mg/L的IAA处理显著抑制E29的根与下胚轴伸长,0.5 ~ 2.0 mg/L的 24–eBR处理对E29的根和下胚轴伸长影响不明显,各激素处理均不能使之恢复至野生型6421的根与下胚轴长度,表明E29为BR不敏感型突变体,其突变性状与GA3、IAA调控无关。
辣椒;矮秆突变体;表型;外源激素
株高是辣椒遗传育种的主要目标性状之一,与辣椒植株抗倒伏性状和产量性状密切相关[1]。研究辣椒株高遗传基础与激素调控的关系,有助于人工调控植株株型,在辣椒育种生产实践中具有积极意义。矮秆突变体是研究激素调控植株生长的最佳材料。大多数植株矮化突变与赤霉素(GAs)[2–4]和油菜类固醇(BRs)[5–7]调控密切相关,少数矮化突变与生长素(IAA)调控有关[8]。根据突变体对外源激素的敏感程度,可以把矮秆突变体分为激素缺失型和激素不敏感型两类。激素缺失型突变体因为其激素的生物合成途径被抑制或被阻断而导致内源激素缺乏或痕量存在,外施相应激素后其表型可恢复至野生型;激素不敏感型突变体的激素代谢途径正常,其内源激素水平变化不大,甚至比野生型还高,由于激素信号传导或应答出现障碍,外施相应的激素后其表型不能恢复至野生型。关于GA3缺失型和不敏感型矮秆突变体的研究主要是针对拟南芥、水稻和小麦[4, 9–10],BR和IAA缺失型和不敏感型矮秆突变体在豌豆、番茄、大麦和水稻上也均有发现[11–14]。目前,对辣椒株高的研究仅限于株高性状遗传分析[15–16]及少量株高QTLs位点的定位[17–18],关于辣椒激素敏感性研究尚少见报道。笔者于EMS诱变辣椒自交系6421种子所构建的突变体库[19]中获得1份矮秆突变体,观察其表型、细胞学特征,分析突变性状的遗传规律,并研究GA3、24–eBR和IAA对突变体种子萌发和幼苗生长的影响,旨在探明该突变体的突变性状与哪种激素调控相关,为后续通过该突变体来了解辣椒株高的遗传性状提供参考依据。
1 材料与方法
1.1 材料
于EMS诱变辣椒自交系6421种子所构建的突变体库中获得矮秆突变体E29。2015年6月将E29和6421杂交得到F1群体;2016年6月将F1群体自花授粉得到F2群体。所有植株均种植于湖南省农业科学院蔬菜研究所大棚内。
1.2 方法
1.2.1表型分析
分别种植6421和E29,从出苗期到收获期进行全生育期观察。于成株期随机选取6421和E29各20株,参考李锡香[20]的方法调查株高、株幅、主茎长、主茎粗和主茎节位数等主要农艺性状,用YMJ–C型便携式叶面积仪测量6421和E29植株第8片叶的叶面积;于红果期调查6421和E29的单株结果数。
1.2.2细胞学观察
于植株幼苗期取6421和E29茎秆顶端第4节茎段,用解剖刀切茎段,每段约0.4 cm,同时取6421和E29的第4片真叶,用石蜡切片法[20]制片。选取染色效果良好的切片,在Olympus BX43显微镜下观察并拍照。
1.2.3突变性状遗传分析
以E29为母本与6421杂交,获得F1群体。调查F1植株的株高。F1自交,构建F2群体,再调查F2分离群体的株高。统计F2群体中植株的株高分离比,进行卡方检验。
1.2.4外源激素(GA3、24–eBR和IAA)处理
取E29和6421的种子各120粒,用75%乙酸对其表面消毒30 s,再用5%次氯酸钠消毒种子10 min,最后用无菌蒸馏水冲洗种子3次。将种子分别接种于添加了不同浓度激素(GA3、24–eBR、IAA)的1/2MS培养基上,以不添加激素的培养基(CK)为对照,接种后将培养瓶置入光照培养室中培养。培养温度为(26±1) ℃,每天光照16 h。培养至第8天分别测量6421和E29的幼根根长,第15 天分别测量6421和E29的幼苗根长与下胚轴长,结果取其算术平均值。试验重复3次。
2 结果与分析
2.1 突变体形态分析结果
由图1可知,与6421相比,E29全生育期表现出植株矮化,叶片变大、变宽、变厚,叶色深绿,侧枝退化,株幅变窄等特征。成株期6421和E29植株表型特征调查结果表明,与6421相比,E29的株高、株幅、主茎长和单株结果数均显著低于6421的,分别比6421低63.33%、36.63%、49.41%和74.73%;E29的主茎粗和叶面积均显著高于6421的,分别比6421高15.04%和41.36%。二者的主茎节位数均为12节(表1)。

1 子叶期植株(左为6421,右为E29);2 苗期植株(左为6421,右为E29);3 成株期植株(左为6421,右为E29)。

表1 成株期6421和E29的表型
同列数字后英文字母示<0.05水平差异。
2.2 细胞学特征
对6421和E29相同部位的茎段和叶片进行细胞学观察,发现6421和E29茎秆分生区细胞排列整齐,均能形成纵向细胞列。E29茎秆分生区细胞纵向长度缩短,其细胞平均大小为6421分生区细胞平均大小的45.62%,表明E29高度降低是由其茎秆节间细胞缩短所致(图2–1,图2–2)。与6421相比,E29的叶片栅栏组织细胞排列较疏松,海绵组织细胞体积较大,细胞数目较多,其叶片横切面厚度为6421叶片横切面厚度的1.46~1.92倍,表明E29叶片变大、变厚是由其叶肉细胞体积和数目发生变化引起的(图2–3,图2–4)。

1 6421茎秆纵切面切片;2 E29茎秆纵切面切片;3 6421叶片横切面切片;4 E29叶片横切面切片。
2.3 突变性状遗传分析
以E29和6421为亲本构建的F1群体性状不分离,F2群体正常植株和矮秆植株比例符合3∶1的分离比,说明该突变性状由单隐性基因控制(表2)。
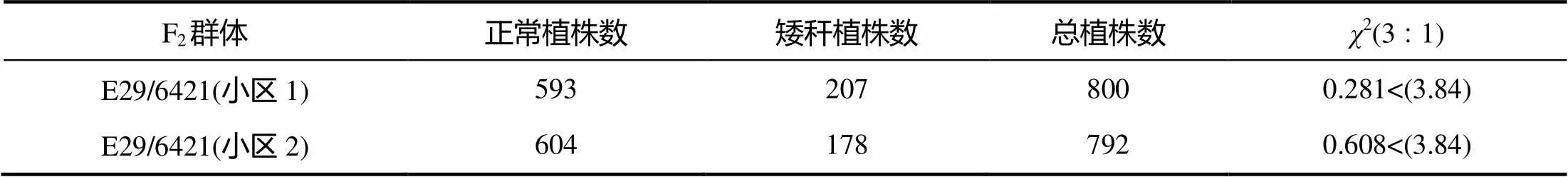
表2 E29×6421 F2群体株高的分离情况
2.4 各激素处理6421和E29萌芽期幼根的伸长情况
培养7 d后,GA3处理促进6421和E29的根伸长,IAA处理抑制6421和E29的根伸长,24–eBR处理抑制6421的根伸长,但对E29根伸长的影响不明显(图3–1~6)。由表3可知,1.0、2.0、3.0、4.0 mg/L GA3处理E29的根长显著高于其对照E29的,分别比对照E29高38.51%、37.27%、39.75%和52.80%;1.0、2.0、3.0、4.0 mg/L IAA处理E29的根长显著低于其对照E29的,分别比对照E29低86.34%、87.58%、86.96%和87.58%,0.5 ~ 2.0 mg/L 24–eBR处理E29的根长与其对照E29根长的差异无统计学意义,各激素处理E29的根长均没有恢复至与对照6421的根长一致,初步判断,E29既不属于GA3或IAA不敏感型突变体,也不属于GA3或IAA缺失型突变体,而是属于BR不敏感型突变体。

2.5 各激素处理6421和E29的子叶期幼苗根和下胚轴生长情况
培养15 d后,GA3处理促进6421和E29的根和下胚轴伸长,IAA处理抑制6421和E29的根和下胚轴伸长,24–eBR处理抑制6421的根和下胚轴伸长,但对E29根和下胚轴伸长的影响不明显(图3–7~12)。由表3可知,3.0 ~ 4.0 mg/L GA3处理E29的根长显著高于其对照E29的,比对照E29低14.37% ~24.46%;4.0 mg/L GA3处理E29的下胚轴长显著高于其对照E29的,比对照E29低7.80%;1.0 ~ 4.0 mg/L IAA处理E29的根长和下胚轴长均显著低于其对照E29的,分别比对照低56.57%~88.69%和12.77 %~ 29.08%,0.5~2.0 mg/L 24–eBR处理E29的根长和下胚轴长与其对照E29的差异无统计学意义,各激素处理E29的根长与下胚轴长均没有恢复至与对照E29的一致,进一步证实E29的突变性状仅与BR调控相关,属于BR不敏感型突变体。

表3 各激素处理6421和E29的幼苗根长及下胚轴长
同列数据后小写英文字母示<0.05水平差异。
3 结论与讨论
油菜素内酯属于植物甾醇类生长促进激素,从种子萌发到开花结实的各发育时期油菜素内酯均发挥着重要作用。模式植物拟南芥BR突变体在正常光照条件下生长表现出下胚轴生长受抑制、植株严重矮化、叶深绿、开花延迟、育性下降等多种生长发育缺陷。切片结果显示BR突变体变矮的原因是由于是细胞伸长受阻[21]。本试验中突变体E29表现出植株矮化,叶片变大、变厚,叶色变深,单株结果数减少等特点。显微观察结果表明,E29茎秆伸长区细胞缩短、叶肉细胞变大及细胞数增加,这些特征与从拟南芥中鉴定出的BR突变体表型的特征类似。激素处理试验结果表明,3种激素中仅24–eBR处理对E29的根和下胚轴伸长影响不明显,证明E29属于BR不敏感型矮秆突变体。
激素不敏感突变体的产生通常是由植物体内感知该激素的受体发生突变而不能接受到相应的信号而引起的。第一个BR不敏感突变体在拟南芥中被发现,并被命名为bri1。外源BR处理不能恢复bri1的表型[22]。之后,采用分子遗传学、生物化学和蛋白组学等技术手段,拟南芥BR信号转导级联反应途径被逐渐发现[23–26]。辣椒属于茄科蔬菜作物,目前还少见关于其BR突变体的报道。以BR不敏感突变体E29为试验材料,研究辣椒中BR信号转导网络对了解植物中BR信号途径的进化过程具有重要意义。后续试验中将对突变体E29进行全基因组重测序,克隆与突变性状相关的基因,并对其进行功能分析,为进一步解析BR调控植物生长发育的分子机制提供依据。
[1] 李玉华,闫立英.辣椒主要农艺性状的相关分析[J].北京农学院学报,2003,18(1): 10–12.DOI:10.3969/j.issn. 1002–3186.2003.01.003.
[2] MITSUNAGA S,TASHIRO T,YAMAGUCHI J. Identification and characterization of gibberellin–insensitive mutants selected from among dwarf mutants of rice[J].Theor Appl Genet,1994,87(6): 705–712.DOI:10.1007/BF00222896.
[3] CHEN L,HAO L,CONDON A G,et al.Exogenous GA3application can compensate the morphogenetic effects of the GA–responsive dwarfing gene Rht12 in bread wheat[J].PLoS ONE,2014,9(1): e86431.DOI:10.1371/journal.pone.0086431.
[4] RAMCHANDER S,PILLAI M A.Semi–dwarf narrow rolled leaf mutant in rice: photosynthetic efficiency and physiological response to gibberellic acid (GA3)[J]. Journal of Applied and Natural Science,2016,8(3): 1312–1316.
[5] KOKA C V,CERNY R E,GARDNER R G,et al.A putative role for the tomato genes DUMPY and CURL–3 in brassinosteroid biosynthesis and response[J].Plant Physiol,2000,122(1):85–98.
[6] SUZUKI Y,SASO K,FUJIOKA S,et al.A dwarf mutant strain of,Uzukobito (kobito),has defective brassinosteroid biosynthesis[J].Plant J,2003,36(3): 401–410.
[7] SHANG Y,LEE M M,LI J,et al.Characterization of cp3 reveals a new bri1 allele,bri1–120,and the importance of the LRR domain of BRI1 mediating BR signaling[J]. BMC Plant Biol,2011,11:8.DOI:10.1186/ 1471–2229– 11–8.
[8] ROUSE D,MACKAY P,STIRNBERG P,et al.Changes in auxin response from mutations in an AUX/IAA gene[J].Science,1998,279(5355): 1371–1373.
[9] LINCOLN C,BRITTON J H,ESTELLE M.Growth and development of the axr1 mutants of[J].Plant Cell,1990,2(11): 1071–1080.DOI:10.1105/tpc.2.11. 1071.
[10] CHEN L,HAO L,CONDON A G,et al.Exogenous GA3application can compensate the morphogenetic effects of the GA–responsive dwarfing gene Rht12 in bread wheat[J].PLoS ONE,2014,9(1): e86431.DOI:10.1371/journal.pone.0086431.
[11] NOMURA T,KITASAKA Y,TAKATSUTO S,et al. Brassinosteroid/Sterol synthesis and plant growth as affected by l ka and l kb mutations of Pea[J].Plant Physiol,1999,119(4): 1517–1526.
[12] LI X J,GUO X,ZHOU Y H,et al.Overexpression of a brassinosteroid biosynthetic gene dwarf enhances photosynthetic capacity through activation of Calvin cycle enzymes in tomato[J].BMC Plant Biology,2016,16(1): 33.DOI:10.1186/s12870–016–0715–6.
[13] YE Y J,LIU Y,CAI M,et al.Screening of molecular markers linked to dwarf trait in crape myrtle by bulked segregant analysis[J].Genet Mol Res,2015,14(2): 4369–4380.DOI:10.4238/2015.April.30.10.
[14] KALIH R,MAURER H P,HACKAUF B,et al.Effect of a rye dwarfing gene on plant height,heading stage,and Fusarium head blight in triticale (×)[J].Theor Appl Genet,2014,127(7): 1527– 1536.DOI:10.1007/s00122–014–2316–9.
[15] INOUHE M,SAKURAI N,KURAISHI S.Growth regulation of dark–grown dwarf barley coleoptile by the endogenous IAA content[J].Plant and Cell Physiology,1982,23(4):689–698.
[16] SAZUKA T,KAMIYA N,NISHIMURA T,et al.A rice tryptophan deficient dwarf mutant,tdd1,contains a reduced level of indole acetic acid and develops abnormal flowers and organless embryos[J].Plant J,2009,60(2): 227–241.DOI:10.1111/j.1365–313X.2009.03952.x.
[17] 蒋向辉,佘朝文,曾洪波,等.辣椒矮化及果皮皱缩突变体鉴定RAPD初步分析[J].武汉植物学研究,2008,26(5):524–527.
[18] 段蒙蒙,王宁,毛胜利,等.辣椒种内遗传图谱的构建及主要农艺性状的QTL分析[J].园艺学报,2014,41(12):2497–2506.
[19] 周书栋,杨博智,欧立军,等.辣椒突变体库的构建及突变群体表型变异分析[J].湖南农业大学学报(自然科学版),2017,43(1):31–36.DOI:10.13331/j.cnki.jhau. 2017.01.006.
[20] 李锡香,张宝玺,沈镝,等.辣椒种质资源描述规范和数据标准[M].北京:中国农业出版社,2006.
[21] JI H S,CHU S H,JIANG W,et al.Characterization and mapping of a shattering mutant in rice that corresponds to a block of domestication genes[J].Genetics,2006,173(2): 995–1005.DOI:10.1534/genetics.105.054031.
[22] LI J,NAGPAL P,VITART V,et al.A role for brassinosteroids in light–dependent development of Arabidopsis[J].Science,1996,272(5260): 398.
[23] CLOUSE S D,LANGFORD M,MCMORRIS T C.A brassinosteroid–insensitive mutant inexhibits multiple defects in growth and development[J]. Plant physiology,1996,111(3): 671– 678.
[24] WANG X,LI X,MEISENHELDER J,et al. Autoregulation and homodimerization are involved in the activation of the plant steroid receptor BRI1[J].Dev Cell,2005,8(6):855–865.DOI:10.1016/j.devcel.2005. 05.001.
[25] WANG X,KOTA U,HE K,et al.Sequential transphosphorylation of the BRI1/BAK1 receptor kinase complex impacts early events in brassinosteroid signaling[J].Dev Cell,2008,15(2): 220–235.DOI:10.1016/j.devcel.2008.06.011.
[26] KIM T W,GUAN S,SUN Y,et al.Brassinosteroid signal transduction from cell–surface receptor kinases to nuclear transcription factors[J].Nat Cell Biol,2009,11(10): 1254–1260.DOI:10.1038/ncb1970.
责任编辑:王赛群
英文编辑:王库
Phenotypic characteristic of a dwarf mutant in pepper and its response to exogenous hormones
YANG Bozhi1,2, ZHOU Shudong1,2, YANG Liying1,2, MA Yanqing1,2,ZOU Xuexiao1,2*
(1.Longping Branch of Central South University, Changsha 410100, China; 2.Vegetable Institution of Hunan Academy of Agricultural Science, Changsha 410125, China)
We have identified a dwarf mutant line, E29, through a screen from inbred line 6421 of ethyl methanesulfonate (EMS) mutagenized population in the pepper. In this paper, E29 was studied from its phenotypes, stem and leaf morphology by means of light microscope, genetic characteristics, and also including its physiological responses to GA3, 24–eBR and IAA. The results showed that E29 and 6421 had similar phenotypes, which showed severe dwarf accompanied with wide, thick leaf blades and dark green leaves. The mutation phenotype was controlled by a single recessive gene. It was proved from the longitudinal sections of the stems that the length of mutant cell reduced, which resulted in the short stature. Transverse sections of leaf blades also revealed that mesophyll mutant cells became larger and the number of mesophyll mutant cell was more than their wild counterparts, which explained its wide and thick leaves. It was further showed that GA3(1.0 mg/L) promoted root and hypocotyl elongation of E29, while IAA (1.0 – 4.0 mg/L) gave rise to the opposite effects, and 24–eBR(0.5–2.0 mg/L) had no effects on inhibiting or promoting root and hypocotyl elongation. Exogenous GA3, IAA or 24–eBR was failed to recover the mutant of E29 to its wild phenotype, which indicated that the dwarf phenotype was not sensitive to BR.
L.; dwarf mutant; phenotype; exogenous hormone
TS201.1
A
1007-1032(2017)05-0518-06
2017–06–11
2017–08–11
国家自然科学基金(31601757);湖南省自然科学基金(2016JJ2076)
杨博智(1983—),女,湖南益阳人,博士研究生,主要从事生物技术辅助辣椒育种研究,yangy_1223@163.com;*通信作者,邹学校,研究员,主要从事辣椒新品种选育工作,zouxuexiao428@163.com
投稿网址:http://xb.hunau.edu.cn

