小檗碱对酒精性肝炎小鼠“肠漏”的保护作用*
王洪岩,迟 程,徐有青,李 鑫
·实验性肝炎·
小檗碱对酒精性肝炎小鼠“肠漏”的保护作用*
王洪岩,迟 程,徐有青,李 鑫
目的探讨小檗碱(BBR)对酒精性肝炎小鼠“肠漏”的保护作用。方法将40只雄性C57BL/6小鼠随机分为对照组、酒精组、BBR组和酒精联合BBR组,饲养8 w。采用ELISA法检测血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)和内毒素(LPS)水平。常规行组织病理学和透射电镜检查肝组织学改变和肠上皮细胞间紧密连接(TJ)超微结构。体外培养肠上皮细胞Caco-2,采用免疫荧光法检测经酒精和BBR处理后的细胞间紧密连接主要结构蛋白occludin表达。结果酒精处理组小鼠血清ALT、AST和LPS水平分别为(46.5±5.9)U/L、(57.0±6.1)U/L和(0.40±0.05)ng/ml,显著高于对照组(P<0.01);酒精联合BBR组血清ALT、AST和LPS水平分别为(27.6±4.2)U/L、(31.8±4.1)U/L 和(0.24±0.03)ng/ml,均显著低于酒精组(P<0.05),而与对照组无显著性差异(P>0.05);酒精联合BBR组肝组织细胞变性和炎细胞浸润较酒精干预组明显改善;电镜下,可见酒精处理组小鼠肠上皮细胞间紧密连接结构模糊、缝隙明显增宽,酒精联合BBR组以上改变明显减轻;酒精处理组Caco-2细胞膜occludin分布减少、中断,部分进入胞浆内,酒精联合BBR组分布虽也减少,但仍连续,无中断。结论小檗碱能改善慢性乙醇摄入诱导的细胞膜occludin减少和上皮细胞间紧密连接结构破坏,改善“肠漏”而具有保护肝脏作用。
酒精性肝炎;小檗碱;肠漏;紧密连接;Occludin蛋白;小鼠
近年来,多项动物和临床试验研究均证实肠道高通透性,即“肠漏”导致的肠源性内毒素血症在酒精性肝病的发生及进展过程中起重要作用[1,2]。到目前为止,临床上还缺乏疗效明确、安全性好和价格低廉的肠粘膜保护剂。小檗碱(berberine,BBR)具有抗炎、抑制肠上皮细胞凋亡的生物学功能,从理论上讲有减轻“肠漏”的可能,且该药作为治疗感染性肠道疾病的常用药物,已应用于临床多年,安全性好。国内外关于小檗碱对酒精性肝炎个体“肠漏”的保护作用的研究报道仍然很少。本实验检测了酒精性肝炎小鼠肠上皮细胞紧密连接蛋白复合体(tight junction complex,TJ)和复合体主要构成蛋白occludin的变化,探讨了BBR对酒精性肝炎小鼠的保护作用。
1 材料与方法
1.1 动物、细胞、主要试剂及仪器 无特殊病原体(SPF)级雄性C57BL/6野生型小鼠40只,7~8周龄,体质量24±2 g,购自北京维通利华实验动物技术有限公司。Caco-2细胞购自北京协和医学院基础学院细胞库。Lieber-Decarli饲料购自北京华阜康生物科技公司。BBR购自Sigma公司。检测血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)和脂多糖(lipopolysaccharide,LPS)的 ELISA 试剂盒购自美国R&D公司,兔抗occludin单克隆抗体购自英国Abcam公司,多聚甲醛、石蜡、柠檬酸缓冲液和苏木素等染色试剂及细胞免疫荧光试剂购自北京中杉金桥生物技术公司。酶标仪购自芬兰Themo公司,使用北京天坛医院神经外科研究所TM-1000型透射电镜(日本日立公司)和DMLI型倒置荧光显微镜(Leica公司)。
1.2 酒精性肝炎小鼠模型的建立 将40只小鼠经适应性喂养1 w,采用随机数字表法分为对照组、酒精组、BBR组和酒精联合BBR组,每组10只,分别给予Lieber-DeCarli无酒精液体饲料、含5%酒精的Lieber-DeCarli液体饲料、小檗碱 25 mg·kg-1·d-1灌胃和酒精饲料中加入BBR喂养,连续8 w。在SPF级动物实验室,饲养条件为室温24±2℃、湿度40%~70%,人工日夜循环照明(照明时间为8:00 am~5:00 pm)。小鼠经 2%戊巴比妥钠(50 mg·kg-1)腹腔注射麻醉,经心脏采血,在真空管(美国BD公司)中充分混匀,3000 r/m离心 5 min,-20℃保存。取肝组织,经4%多聚甲醛固定,常规石蜡包埋、切片,HE染色,光学显微镜下观察。取结肠组织,经2.5%戊二醛固定2 h,4℃;PBS缓冲液冲洗,10 min×3次;1%锇酸固定2 h,4℃;双蒸水冲洗,10 min×3次;50%、70%、90%酒精梯度脱水,各10 min,100%、100%酒精各 15 min。环氧丙烷置换 2 次,各 15 min,环氧丙烷:树脂(1:1)室温1 h,环氧丙烷:树脂(1:4)室温 1 h,纯树脂浸透室温2 h。纯树脂包埋(EPON812)聚合35℃,16 h;45℃,8 h;55℃,14 h;60℃,48 h。修块后半薄切片,天青-美兰染色,光镜下定位观察。超薄切片,醋酸双氧铀-枸橼酸铅染色,透射电镜下观察、照相。
1.3 细胞培养及细胞Occludin表达检测 取20~30代Caco-2细胞,用含有10 g/L非必需氨基酸、10 g/L谷氨酰胺、1 g/L丙酮酸钠的DMEM培养液,加入体积分数10%胎牛血清、青霉素-链霉素常规培养。每7 d按1∶2传代,传代7 d后待细胞达融合状态,分为4组,即对照组(磷酸盐缓冲液)、乙醇组、BBR组和酒精联合BBR组,分别给予以下四种条件培养48 h:磷酸盐缓冲液、加入100 mmol/L酒精、BBR 2 μg/ml、BBR 2 μg/ml加入 100 mmol/L酒精。实验重复3次。制备Caco-2细胞爬片,模拟肠上皮屏障:将玻片置于24孔细胞培养板孔底,将Caco-2细胞悬液滴加到爬片上,混匀,在37℃、5%CO2培养箱中培养,隔日换液,在倒置显微镜下观察,待细胞连接形成后用于后续实验。将处理好的细胞爬片取出,用PBS缓冲液洗3次,×5 min;4%多聚甲醛固定30 min,PBS缓冲液洗 3次,×5 min;0.3%Triton X100破膜15 min,PBS缓冲液洗3次,×5 min;3%BSA封闭液封闭;将BSA吸干,将经PBS缓冲液稀释的兔抗occludin(1:200)滴加到爬片上,放入湿盒,4℃冰箱过夜;次日,经PBS缓冲液洗3次,×5 min,将FITC荧光标记的羊抗兔IgG用PBS缓冲液稀释后滴加到爬片上,避光室温孵育1 h,PBS缓冲液洗3次,×5min;最后,用含有DAPI的封片剂封片,避光4℃保存,在荧光显微镜下观察、照相。
1.4 血清ALT、AST和LPS测定 采用相关试剂盒检测。
1.5 统计学方法 应用SPSS 17.0软件进行统计学分析,所有数据呈正态分布,计量资料以(±s)表示,采用成组资料的t检验,多组间比较采用LSD法单因素方差分析,以P<0.05认为差异有统计学意义。
2 结果
2.1 酒精性肝炎小鼠模型的建立情况 在动物造模8 w末,对照组、酒精组、BBR组和酒精联合BBR组小鼠体质量分别为 (24.7±1.7)g、(28.0±1.9)g、(27.5±1.7)g、(26.9±1.6)g。对照组和 BBR 组小鼠灵活好动,皮毛整洁,体质量逐渐增加;乙醇组小鼠皮毛凌乱,无光泽,体质量增加缓慢,易激惹;酒精联合BBR组动物毛发、体质量和易激惹行为较酒精组改善。
2.2 血清学指标比较 在8 w末,酒精组小鼠血清ALT、AST和LPS水平比对照组显著升高(P<0.01),BBR组与对照组小鼠血清学指标无明显差别,酒精联合BBR组血清ALT和LPS水平与对照组无显著性差别,血清ALT、AST和LPS水平较酒精组显著降低(P<0.05,表 1)。
表1 各组小鼠血清ALT、AST和LPS水平(±s)比较

表1 各组小鼠血清ALT、AST和LPS水平(±s)比较
与对照组比,①P<0.01;与酒精组比,②P<0.05
只数 ALT(U/L) AST(U/L) LPS(ng/ml)对照组 10 22.9±2.4 24.3±3.3 0.21±0.03酒精组 10 46.5±5.9① 57.0±6.1① 0.40±0.05①BBR 组 10 21.0±2.7 25.2±3.6 0.20±0.04酒精联合BBR 10 27.6±4.2② 31.8±4.1② 0.24±0.03②
2.3 肝组织学表现情况 酒精组动物肝组织内可见肝细胞索排列紊乱,细胞脂肪变性,炎性细胞浸润,可见细胞气球样变;对照组和BBR组动物肝组织肝小叶形态正常;酒精联合BBR组动物肝组织可见部分肝细胞脂肪变性及少量炎细胞浸润,但未见细胞气球样变,肝细胞排列尚整齐,其肝细胞变性及炎细胞浸润程度较酒精组明显改善(图1)。
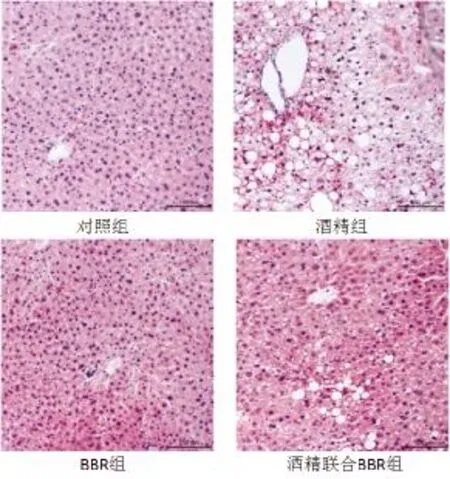
图1 四组小鼠肝组织病理学表现(HE,40×)
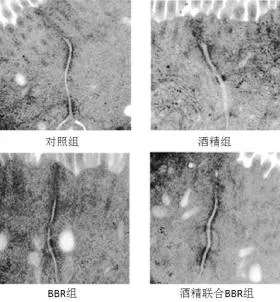
图2 四组小鼠结肠上皮细胞间紧密连接超微结构的变化(6000×)
2.4 结肠组织超微结构的变化 酒精组动物结肠上皮细胞间TJ结构模糊,缝隙明显增宽;对照组和BBR组动物结肠上皮细胞间TJ结构清晰,缝隙紧密;酒精联合BBR组TJ略模糊,缝隙稍宽,但增宽程度较酒精组明显减轻(图2)。
2.5 Caco-2细胞Occludin表达情况 经免疫荧光染色,在荧光显微镜下观察,可见对照组和BBR组Caco-2细胞Occludin绿色荧光呈线性分布,清晰连续无中断;酒精组Occludin绿色荧光分布紊乱,堆积成点片状,部分从细胞膜进入胞浆内;酒精联合BBR组绿色荧光可见点状堆积,部分进入细胞胞浆内,但TJ处绿色荧光分布连续无中断(图 3)。
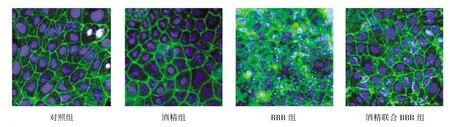
图3 四组Caco-2细胞紧密连接处Occludin表达情况 Occludin蛋白呈绿色荧光,细胞核呈蓝色荧光
3 讨论
本研究采用Liber-Decarli喂养方法构建酒精性肝炎小鼠模型,造模8周后,酒精组小鼠血清丙氨酸氨基转移酶水平明显升高,肝组织符合酒精性肝炎表现,说明模型构建成功。
酒精性肝病发病机制较为复杂,慢性酒精摄入是发病基础,乙醇代谢产物对肝细胞的直接损伤、氧化应激、脂质过氧化、营养失调、铁沉积、锌缺乏等因素均参与了其发病过程[3-6]。近年来,国内外研究均显示:肠上皮细胞间高通透性导致的“肠漏”可使肠道LPS经血入门静脉到达肝脏,进而引起肝脏炎性表现[7,8]。肠上皮屏障是由肠上皮细胞和细胞间紧密连接组成的,而Occludin蛋白定位于肠上皮细胞膜表面,是细胞间TJ的主要结构蛋白,其结构破坏或构型改变均可导致其在细胞膜分布减少。有研究发现在小鼠模型中,Occludin缺乏可引起酒精相关性肠道屏障功能失调及肝脏受损[9]。我们既往研究已发现慢性乙醇刺激诱发了肠上皮细胞TLR4大量表达,进而引起细胞间TJ主要构成蛋白occludin构型改变,在细胞膜分布减少,细胞间通透性增加[10,11]。本研究亦发现酒精处理组动物血清LPS水平显著高于对照组。扫描电镜下发现酒精组小鼠肠上皮细胞间TJ被破坏,边界不清、宽度增加。为进一步观察TJ处Occludin的表达情况,我们在Caco-2细胞培养基中加入低浓度酒精共培养48小时,结果见Occludin绿色荧光分布紊乱、细胞间分布减少,部分进入胞浆内,说明慢性酒精刺激通过减少Occludin的表达,破坏细胞间TJ结构,导致细胞间通透性增加。
BBR又名黄连素,是从植物黄连的根茎中提取出的主要成分,是一种异喹啉类生物碱[12,13]。从上世纪初,BBR被分离纯化以后,在临床广泛应用于治疗感染性腹泻、细菌性痢疾等感染性肠道疾病。近期研究发现,其具有抗炎、调脂和抗肿瘤作用而对炎症性肠病、非酒精性脂肪性肝病和结直肠癌等均有保护作用[14-16]。长期临床应用实践表明,BBR是一种无细胞毒、无致突变作用的药物,具有不良反应小、价格低廉等优点。
BBR的抗炎、抑制肠道腺体分泌的药理作用已很明确。最新的动物研究结果显示,小檗碱经口服吸收,能缓解肠粘膜炎性反应,减轻内质网应激引起的肠上皮细胞凋亡,从而减轻放疗、短期内酗酒和葡聚糖硫酸钠引起的肠黏膜损伤[17,18]。Chu M et al[19]还发现BBR作为LPS的拮抗剂能阻断LPS/TLR4信号通路。为了研究BBR对慢性饮酒相关性“肠漏”是否有保护作用,本实验检测了BBR对酒精性肝炎小鼠肠上皮细胞间TJ、Occludin和肝脏形态学的影响,结果发现,酒精联合BBR组小鼠肝组织形态学改变明显改善。酒精联合BBR组小鼠血清LPS水平较酒精组降低,提示BBR能改善肠道通透性。在电镜下,可见酒精联合BBR组小肠粘膜紧密连接较对照组略显松散,宽度增加,但损伤程度较酒精组明显减轻。酒精处理Caco-2细胞经加入BBR共培养后,细胞膜表面Occludin表达较单纯酒精组增加。以上结果提示小檗碱可通过增加TJ主要结构蛋白Occludin的表达稳定细胞间紧密连接,从而改善慢性酒精摄入引起的肠上皮细胞间高通透性。
综上所述,酒精性肝炎伴发“肠漏”和LPS血症。慢性乙醇刺激减弱了肠上皮细胞Occludin蛋白的表达,使细胞间TJ结构破坏,进而导致“肠漏”。BBR通过增加细胞膜Occludin表达稳定TJ结构,起到保护肠粘膜屏障、减轻肝损伤的作用。有研究发现小檗碱口服生物利用度低[20],因此,如何提高其吸收,以便用于酒精性肝病患者肝肠损害的预防或治疗。
[1]Malaguarnera G,Giordano M,Malaguarnera M,et al.Gut microbiota in alcoholic liver disease:pathogenetic role and therapeutic perspectives.World J Gastroenterol,2014,20(44):16639-48.
[2]Liang R,Liu A,Ahmed A,et al.Advances in alcoholic liver disease:An update on alcoholic hepatitis.World J Gastroenterol,2015,21(42):11893-11903.
[3]Zhong W,McClain CJ,Zhou Z,et al.The role of zink deficiency in alcohol-induced intestinalbarrierdysfunction.Am J Physiol Gastrointest Liver Physiol,2010,298(5):G625-33.
[4]Smathers RL,Galligan JJ,Shearn CT,et al.Susceptibility of LFABP-/-mice to oxidative stress in early-stage alcoholic liver.J Lipid Res,2013,54:1335-1345.
[5]Ahmed U,Latham PS,Oates PS.Interactions between hepatic iron and lipid metabolism with possible relevance to steatohepatitis.World J Gastroenterol,2012,18:4651-4658.
[6]Kirpich IA,Petrosino J,McClain CJ.et al.Saturated and unsaturated dietary fats differentially modulate ethanol-induced changes in gut microbiome and metabolome in a mouse model of alcoholic liver disease.Am J Pathol,2016,186(4):765-76.
[7]Keshavarzian A,FarhadiA,Forsyth CB,etal.Evidence that chronic alcohol exposure promotes intestinal oxidative stress,intestinal hyperpermeability and endotoxemia prior to development ofalcoholic steatohepatitisin rats.J Hepatol,2009,50(3):538-547.
[8]Orman ES,Odena G,Bataller R.Alcoholic liver disease:pathogenesis,management,and novel targets for therapy.J Gastroenterol Hepatol,2013,28(Suppl 1):77-84.
[9]Mir H,Meena AS,Rao R,et al.Occludin deficiencypromotes ethanol-in duced disruption of colonic epithelial junctions,gut barrier dysfunction and liver damage in mice.Biochim Biophys Acta,2016,1860(4):765-774.
[10]Li X,Chen W,Xu YQ,et al.Toll-like receptor 4 increases intestinal permeability through up-regulation of membrane PKC activity in alcoholic steatohepatitis. Alcohol,2013,47 (6):459-465.
[11]李鑫,王晨,徐有青,等.Toll样受体4参与了酒精性肝病肠道高通透性.中华肝脏病杂志,2014,22(2):61-64.
[12]Imenshahidi M,Hosseinzadeh H.Berberis vulgaris and berberine:An update review.Phytother Res,2016,30(11):1745-1764.
[13]宋淑莉,曹海龙,王邦茂.小檗碱治疗消化系统疾病的作用机制研究进展. 国际消化病杂志,2013,33(1):47-49.
[14]Habtemariam S.Berberine and inflammatory bowel disease:A concise review.Pharmacol Res,2016,113(Pt A):592-599.
[15]Zhu X,Bian H,Gao X.The potential mechanisms of Berberine in the treatment of nonalcoholic fatty liver disease.Molecules,2016,14:21(10):312-316.
[16]Ortiz LM,Lombardi P,Scovassi AI,et al.Berberine,an epiphany against cancer.Molecules,2014,19(8):12349-12367.
[17]Yan F,Wang LH,Polk DB,et al.Berberine promotes recovery of colitis and inhibits inflammatory responses in colonic macrophages and epithelial cells in DSS-treated mice.Am J Physiol Gastrointest Liver Physiol,2012,302(5):G504-G514.
[18]Wang XP,Lei F,Du LJ,et al.Protection of gastrointestinal mucosa from acute heavy alcohol consumption:The effect of Berberine and its correlation with TLR2,4/IL1β-TNFα signaling.PLoS One,2015,10(7):e0134044.
[19]Chu M,Ding R,Wang YD,et al.Role of berberine in anti-bacterial as a high-affinity LPS antagonist binding to TLR4/MD-2 receptor.BMC Complement Altern Med,2014,14:89.
[20]Liu CS,Zheng YR,Long XY,et al.Research progress on berberine with a special focus on its oral bioavailability.Fitoterapia,2016,109:274-282.
(收稿:2016-11-30)
(本文编辑:陈从新)
Protective effect of berberine on intestinal leak in mice with alcoholic hepatitis
Wang Hongyan,Chi Cheng,Xu Youqing,et al.Medical Examination Center,Second Affiliated Hospital,Harbin Medical University,Harbin 150086,Heilongjiang Province,China
Alcoholic hepatitis;Berberine;Intestinal leak;Tight junction;Occludin;Mice
10.3969/j.issn.1672-5069.2017.06.007
北京市自然科学基金资助项目(编号:7154194);国家自然科学基金资助项目(编号:81570536)
150086哈尔滨市 哈尔滨医科大学附属第二医院体检中心(王洪岩);北京市首都医科大学附属北京天坛医院消化内科(李鑫,迟程,徐有青)
王洪岩,女,31岁,医学博士,住院医师。主要从事酒精性肝病的防治研究。E-mail:xinglin_freedom@126.com
李鑫,E-mail:lixinqingzhou@163.com
【Abstrat】ObjectiveTo explore the protective effect of berberine on intestinal leak in mice with alcoholic hepatitis.MethodsForty male C57BL/6 mice were randomly divided into control,alcohol,berberine and alcohol plus berberine group with 10 animals in each.Mice were fed with alcohol or vehicle for 8 weeks and all were sacrificed.Serum alanine aminotransferas (ALT),aspartate aminotransferase(AST) and lipopolysaccharide(LPS)were detected by enzyme-linked immunosorbent assay(ELISA).The pathologic changes of liver tissues were assessed by HE staining,and the ultrastructures of tight junction (TJ) complex was observed by transmission electron microscope. In vitro,occludin,the main structural protein of intercellular TJ,was detected by immunofluorescence in intestinal epithelial Caco-2 cells,which were cultured with ethanol(EtOH),BBR and EtOH plus BBR respectively.ResultsSerum ALT,AST and LPS levels in alcohol group were(46.5±5.9)U/L,(57.0±6.1)U/L and(0.40±0.05)ng/ml,respectively,significantly higher than those in control group (P<0.01);There was no significant difference between alcohol plus BBR group and control group;Serum ALT,AST and LPS levels in alcohol plus BBR group were (27.6±4.2) U/L,(31.8±4.1) U/L and (0.24±0.03) ng/ml,respectively,significantly lower than those in alcohol group (P<0.05);The histopathologic examination of liver tissues showed alcoholic hepatitis in alcohol group,and it was alleviated as respect to steatosis and inflammatory cell infiltration in alcohol plus BBR group;Electron micrographs showed that the TJ structures between intestinal epithelial cells were fuzzy and the gaps were expanded obviously in alcohol group,and all of these were improved obviously in alcohol plus BBR group;Immunofluorescence indicated thatthe occludin on Caco-2 cellmembraneswere decreased,interrupted and partly entered into cytoplasm in alcohol group,while in alcohol plus BBR group,the distribution of occludin was decreased,though,butwas continuous.ConclusionBerberine improves the decrease in occludin expression on cell membranes and the disruption of TJ structures between intestinal epithelial cells induced by chronic ethanol intake and alleviates intestinal leak.

