莲草直胸跳甲化学感受蛋白CSPs的生物信息学分析
王亚茹,王苑馨,胡军,贾栋,高玲玲,马瑞燕*
(1.山西农业大学 生命科学学院,山西 太谷 030801;2.山西农业大学 农学院,山西 太谷 030801;3.澳大利亚联邦科学与工业研究组织,文布利 WA6913)
复杂的化学感受机制对于昆虫的生存和行为至关重要[1]。化学感受过程主要包括:嗅觉感知和味觉感知[2]。昆虫通过嗅觉系统感知周围环境中挥发性的化学信息物质并随之产生相应的行为反应,例如寻找寄主植物、配偶,选择产卵场所,躲避天敌等[3]。触角是重要的嗅觉感受器官,将周围环境中的化学信号转变成电信号传导到触角叶中[4]。挥发性或脂溶性的化学信息物质首先通过触角的微孔进入亲水性的感器淋巴液,然后由相应的载体蛋白运输到感觉神经元树突膜上的嗅觉受体 (olfactory receptors,ORs)[5]。这些载体蛋白主要包括两类:化学感受蛋白(chemsensory proteins,CSPs)和气味结合蛋白(odorant-binding proteins,OBPs)[6]。化学感受蛋白CSPs也称嗅觉特异性D蛋白(Olfactory specific-D,OS-D)或感觉附属蛋白(sensory appendage proteins,SAPs),高浓度存在于在触角感器淋巴液中[7]。目前CSPs已经在多种昆虫中被发现,包括鳞翅目、膜翅目、直翅目、蜚蠊目等[8]。
CSPs属于小分子水溶性蛋白,分子量在13 kD左右,由100~115个氨基酸组成[9]。CSPs包含4个保守的半胱氨酸残基,相邻两个半胱氨酸残基形成二硫键[6]。这些二硫键各自成环,一个由8个氨基酸残基环绕组成,另一个由4个半胱氨酸残基环绕组成[10]。CSPs的N端特异性序列为YTTKYDN[-VI][ND][LV]DEIL、中部DGKELKXX(I/L)PDAL和C端KYDP。二级结构主要由α螺旋组成。昆虫CSPs的初级结构和二级结构均高度保守[11]。这些保守的结构允许CSPs和长链的线性的化合物相互作用,例如油酰胺是蝗虫CSPs的一种内源性配体[12]。CSPs的结构与功能具有密切联系。目前仅有少数CSPs的三维结构被解析,包括甘蓝夜蛾MamestrabrassicaeMbraCSP-A6、沙漠蝗SchistocercagregariaSgrCSP4、家蚕BombyxmoriBmorCSP1。CSPs是昆虫识别环境中植物散发化学信息物质的重要嗅觉相关蛋白,如棉铃虫HelicoverpaarmigeraHarmCSP4对植物挥发物ß-胡萝卜素(ß-carotene)具有高亲和力[13]。
喜旱莲子草Alternantheraphiloxeroides是全球性恶性杂草。由于其具有较强的生态适应、繁殖和传播能力,20世纪30年代传至我国后迅速蔓延,严重影响了我国农业、渔业、旅游业的发展,危害人畜健康[14]。从原产地引进专食性天敌莲草直胸跳甲Agasicleshygrophila是治理入侵物种喜旱莲子草的有效手段之一[15]。国内外安全性评估表明:该天敌专一性强,是良好的专食性模式昆虫[15~18]。本课题组前期研究表明:该跳甲通过嗅觉感知两种植物挥发物DMNT((E)-4,8-dimethyl-1,3,7-nonatriene)和顺-3-己烯醇((Z)-3-hexenol)的特殊比例来实现对寄主植物的识别和定位[19]。本研究拟通过生物信息学的方法对A.hygrophilaCSPs的理化性质、信号肽、亚细胞定位、跨膜结构、二级结构、高级结构、多序列比对及系统发育进行分析,以期为进一步研究其嗅觉反应的功能及分子机制提供理论依据,对于解析专食性天敌莲草直胸跳甲对入侵性杂草喜旱莲子草的识别和定位及外来物种的生态安全具有重要意义。
1 材料和方法
1.1 供试昆虫
莲草直胸跳甲(A.hygrophila)引种于华南农业大学,由山西农业大学生物安全与生物防治研究基地种植的喜旱莲子草(A.philoxeroides)进行饲养。饲养条件为温度(25±1) ℃、相对湿度(75±5)%、光周期12 L∶12D的人工气候箱。
1.2 方法
本研究利用第三代高通量测序技术对莲草直胸跳甲进行了转录组测序,从莲草直胸跳甲的转录组数据中筛出CSPs的核酸序列。
采用ORFfinder (https://www.ncbi.nlm.nih.gov/orffinder/)筛选出具有完整ORF的核酸序列,再用NCBI blastp对具有完整ORF的蛋白序列进行比对。利用ExPASy-ProtParam tool(http://web.expasy.org/protparam/)对蛋白质的分子量、理论pI、氨基酸组成、原子组成、消光系数、估计的半衰期、不稳定指数、脂肪指数和总平均亲水性参数进行计算。采用SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)分析信号肽[20]。采用WOLF PSORT (https://wolfpsort.hgc.jp/)进行蛋白质的亚细胞定位[21]。采用TMpred server (http://www.ch.embnet.org/software/TMPRED_form.html)进行蛋白质的跨膜区域预测。采用ProtScale (http://web.expasy.org/protscale/)进行蛋白质的亲疏水性预测。采用NetAcet 1.0 Server (http://www.cbs.dtu.dk/services/NetAcet/)进行蛋白质的乙酰化位点预测。YinOYang 1.2 (http://www.cbs.dtu.dk/services/YinOYang/)进行蛋白质的O型糖基化位点预测。采用NetPhos 3.1 Server (http://www.cbs.dtu.dk/services/NetPhos-3.1/)进行蛋白质的磷酸化位点预测。
采用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)进行蛋白质的二级结构预测;SWISS-MODEL(https://www.swissmodel.expasy.org/)进行蛋白质的三级结构模拟。采用DNAMAN软件进行氨基酸的多序列比对。采用MEGA 5.0进行氨基酸序列的系统进化分析,用Neighbor-Joining方法构建进化树。
2 结果与分析
2.1 莲草直胸跳甲CSPs基因的NCBI BLAST结果
经ORFfinder与NCBI blastp后,莲草直胸跳甲的转录组数据中19个CSPs被筛选出来(表1)。与莲草直胸跳甲CSPs一致性较高的物种包括:榆黄毛萤叶甲Pyrrhalta.maculicollis、大猿叶虫Colaphellus.bowringi、中欧山松大小蠹Dendroctonus.ponderosae、榆蓝叶甲Pyrrhalta.aenescens、光肩星天牛Anoplophora.glabripennis、小蜂甲Aethina.tumida、黄曲条跳甲Phyllotreta.striolata、家蝇Musca.domestica和天蚕蛾Lonomia.oblique。由于CSPs的保守性较高,在目之间也具有很高的相似性。莲草直胸跳甲19个CSPs中有17个与鞘翅目昆虫的CSPs一致性最高,其余2个分别与双翅目的家蝇和鳞翅目的天蚕蛾CSPs一致性最高。经blastp比对一致性较高的7种鞘翅目昆虫中,与光肩星天牛CSPs的一致性最高(81%)。由于光肩星天牛与莲草直胸跳甲同属于鞘翅目叶甲科,因此一致性最高。莲草直胸跳甲19个CSPs经blastp后发现有8个CSPs与小蜂甲、中欧山松大小蠹、家蝇、光肩星天牛的ejbp (Ejaculatory bulb-specific protein)一致性最高。

表1 莲草直胸跳甲CSPs基因blastp比对Table 1 The best blastp match of Agasicles hygrophila CSPs
2.2 莲草直胸跳甲CSPs基因编码的蛋白一级结构及理化性质分析
经ExPASy-ProtParam tool预测后显示(表2),莲草直胸跳甲19个CSPs氨基酸残基数在69~144 aa,相对分子量8~13 kD。其中莲草直胸跳甲CSP16氨基酸残基数为335aa,昆虫的CSPs一般由100个左右氨基酸组成,此蛋白可能为二聚体。莲草直胸跳甲19个CSPs蛋白理论等电点位于7附近,表明这些蛋白属于中性或偏酸偏碱性蛋白。莲草直胸跳甲19个CSPs带负电荷残基总数与带正电荷残基总数基本相同。莲草直胸跳甲CSPs中有12个不稳定系数大于40,表明这些蛋白为不稳定蛋白。脂肪系数反应蛋白的热稳定性,莲草直胸跳甲19个CSPs均为热稳定性蛋白。莲草直胸跳甲19个CSPs总平均疏水性均为负值,表明其CSPs均为亲水性蛋白。

表2 莲草直胸跳甲CSPs蛋白理化性质Table 2 The physicochemical properties of Agasicles hygrophila CSPs
2.3 莲草直胸跳甲CSPs的信号肽分析
采用SignalP 4.1 Server进行信号肽预测后,给出C、Y、S计测结果(表3),综合这5个分值可判断蛋白质是否含有信号肽。莲草直胸跳甲19个CSPs中有15个含有信号肽,4个CSPs的D平均值在0.1附近,不具有信号肽剪切位点,因此不含有信号肽。昆虫的CSPs高浓度存在于感器淋巴液中,为分泌型蛋白,一般含有信号肽。信号肽对于引导蛋白质前体到达正确的位置并发展为成熟的蛋白质进而发挥相应的功能具有重要作用。
2.4 莲草直胸跳甲CSPs的亚细胞定位
采用WOLF PSORT对莲草直胸跳甲CSPs进行蛋白质的亚细胞定位(表4),结果显示莲草直胸跳甲19个CSPs除AhygCSP16可能位于细胞核和细胞质外,其余CSPs均可能位于胞外(Extracellular),即为分泌型蛋白(Secreted protein),这与昆虫CSPs高浓度存在于感器淋巴液中相符合。
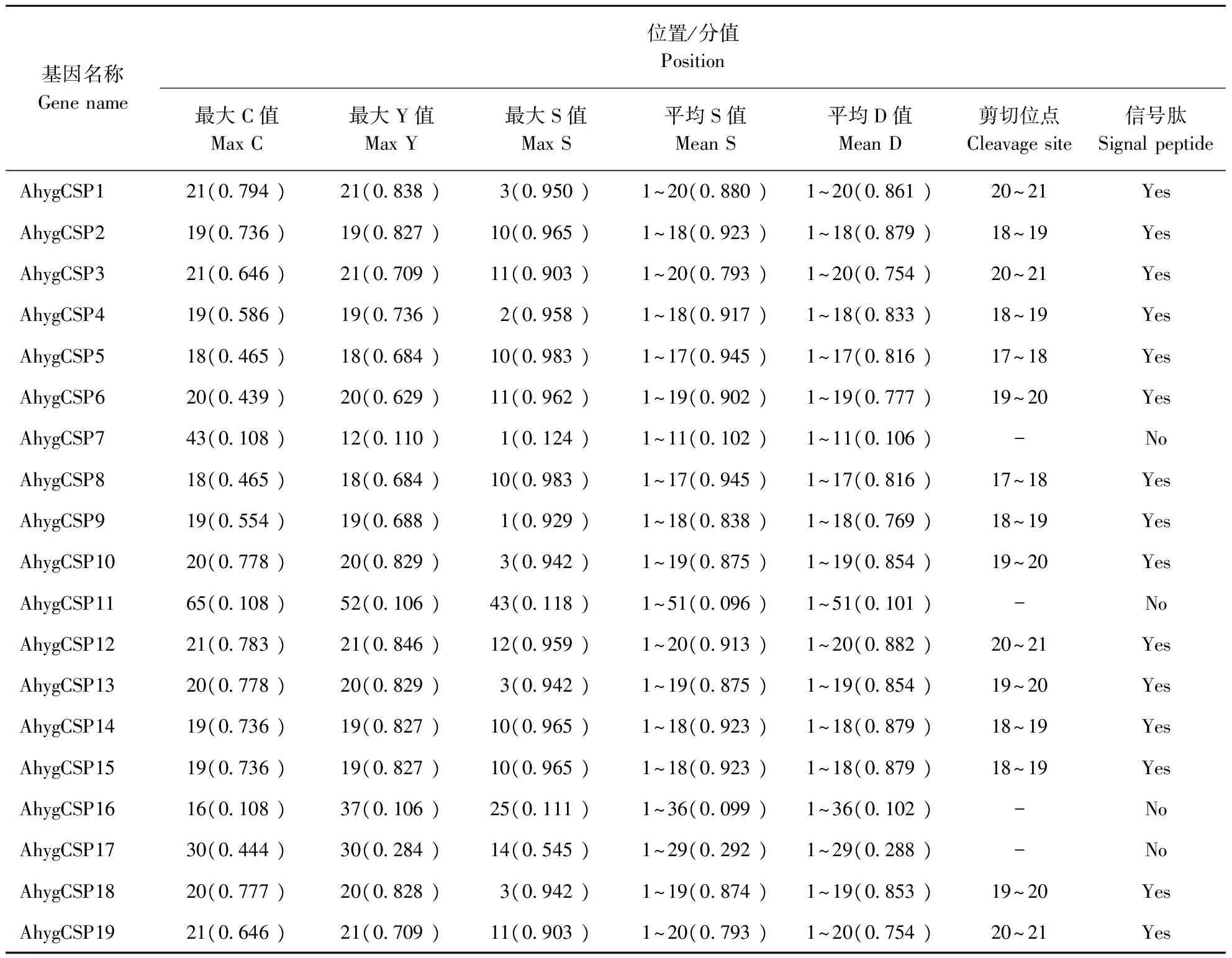
表3 莲草直胸跳甲的CSPs信号肽Table 3 The signal peptide of Agasicles hygrophila CSPs
2.5 莲草直胸跳甲CSPs的跨膜区域
采用TMpred进行蛋白质的跨膜区域预测(图1),19个莲草直胸跳甲CSPs除AhygCSP16含有约25个氨基酸左右的跨膜区域外,其余18个莲草直胸跳甲CSPs均不含跨膜区域。AhygCSP16的跨膜区域可能为α螺旋(Alpha helix)。

图1 莲草直胸跳甲CSP16的跨膜区域Fig.1 The transmembrane region of Agasicles hygrophila CSP16
2.6 莲草直胸跳甲CSPs的二级结构及结构域分析
采用SOPMA进行蛋白质的二级结构预测(图2)。莲草直胸跳甲的CSPs的二级结构主要由α螺旋(Alpha helix)和无规卷曲(Random coil)组成,蛋白质的二级结构是由残基之间的氢键来调节相互作用的。莲草直胸跳甲CSPs二级结构以α螺旋和无规卷曲为主,形成疏水性的结合腔。相邻两个保守半胱氨酸残基之间的二硫键导致α螺旋的形成并维持稳定的结构。CSPs的一级和二级结构在不同种昆虫之间高度保守。蛋白质的一级结构所具有的理化性质和二级结构的特征与空间结构的形成有密切关系。
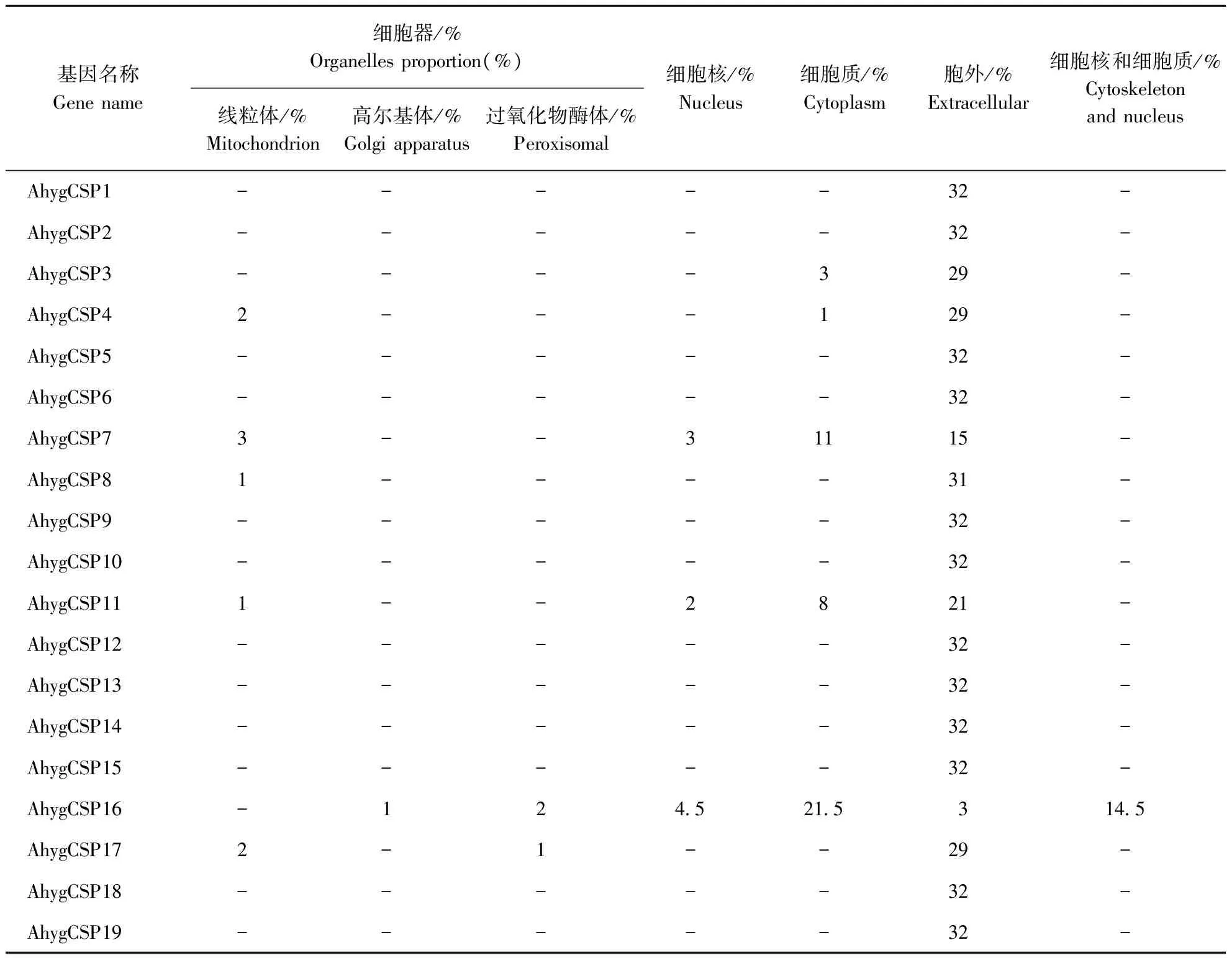
表4 莲草直胸跳甲的CSPs亚细胞定位Table 4 The subcellular localization of Agasicles hygrophila CSPs

图2 莲草直胸跳甲CSPs的二级结构Fig.2 The secondary structure of Agasicles hygrophila CSPs注:竖线颜色及对应二级结构:蓝色竖线为α螺旋、绿色竖线为β折叠、紫色竖线为无规卷曲、红色竖线为延伸链Note:The vertical line color and the corresponding secondary structure:The blue line is Alpha helix、The green line is Beta turn、The purple line is Random coil、The red line is Eetended strand
2.7 莲草直胸跳甲CSPs的蛋白亲疏水区域
采用Protscale进行蛋白质的亲疏水性预测(附图1),结果显示19个莲草直胸跳甲CSPs均属于亲水性蛋白。每个莲草直胸跳甲CSPs只有一小部分氨基酸序列是疏水性序列,其余氨基酸序列均为亲水性序列。莲草直胸跳甲CSPs亲疏水性氨基酸的含量和分布与高级结构的形成有密切关系。莲草直胸跳甲CSPs的高级结构与其在昆虫体内所处的微环境以及发挥相应的功能具有密切联系。
2.8 莲草直胸跳甲CSPs蛋白的多序列比对
采用DNAMAN进行蛋白质的多序列比对(图3),莲草直胸跳甲16个CSPs均由4个保守的半胱氨酸残基组成,且第1个和第2个半胱氨酸残基间隔6个氨基酸残基,两个半胱氨酸残基通过二硫键形成8个氨基酸的环。第3个和第4个半胱氨酸残基间隔2个氨基酸残基,两半胱氨酸残基通过二硫键形成4个氨基酸的环。莲草直胸跳甲CSPs基本符合昆虫CSPs的3个高度保守的结构域:N端YTTKYDN(V/l)(N/D)(L/V)DEIL、中部DGKELKXX(I/L)PDAL和C端KYDP。CSPs通过这3个高度保守的结构域来维持折叠形成疏水性的结合腔保证其稳定性。
2.9 莲草直胸跳甲CSPs的三级结构预测
采用SWISS-MODEL进行蛋白质的同源建模。昆虫的CSPs拓扑结构和保守结构均有明显的特点,CSPs的氨基酸序列折叠形成疏水性的结合腔在种和属之间都是高度保守的,CSPs种内也具有很高的保守性。莲草直胸跳甲CSPs同源建模结果(图4),AhygCSP2、AhygCSP3、AhygCSP4、AhygCSP5、AhygCSP8、AhygCSP9、AhygCSP10、AhygCSP12、AhygCSP13、AhygCSP14、AhygCSP15、AhygCSP18、AhygCSP19经SWISS-MODEL建模后三维结构相似。AhygCSP1、AhygCSP16经SWISS-MODEL建模后三维结构相似。AhygCSP6、AhygCSP7、AhygCSP11、AhygCSP17与其他莲草直胸跳甲CSPs差异较大。莲草直胸跳甲CSPs三维结构形成一个亲水的表面和一个疏水的空腔,疏水空腔与其识别、结合运载脂溶性配体相契合。三维结构相似的CSPs可能具有相同或相似的功能。
2.10 莲草直胸跳甲CSPs蛋白的磷酸化、糖基化、乙酰化位点
采用NetAcet 1.0 Server、YinOYang 1.2和NetPhos 3.1 Server对莲草直胸跳甲CSPs进行磷酸化、乙酰化、糖基化位点分析后可知(表4),莲草直胸跳甲CSPs具有丝氨酸、苏氨酸、酪氨酸的磷酸化位点;具有丝氨酸、苏氨酸的糖基化位点;具有丝氨酸、苏氨酸、丙氨酸的乙酰化位点。莲草直胸跳甲CSPs的磷酸化位点相对于糖基化、乙酰化位点来说数目较多。莲草直胸跳甲CSPs丝氨酸的乙酰化位点数目较少,除AhygCSP12、AhygCSP16分别有1个丝氨酸的乙酰化位点外,其余莲草直胸跳甲CSPs均不具有丝氨酸的乙酰化位点。莲草直胸跳甲CSPs有机体需要糖分子/糖链与其他分子相互作用发挥生物学作用。磷酸化多具有功能开关作用,具体功能蛋白被磷酸化后才具备调控功能代谢的作用。
2.11 莲草直胸跳甲CSPs的聚类分析
采用MEGA 5.0对7个目16种昆虫的99个CSPs氨基酸序列进行系统进化分析,用Neighbor-Joining法构建进化树,Bootstrap进行1000次重复(图5)。图中所示进化树同源性均大于50%。昆虫的CSPs因目而聚类的情况比较明显,鳞翅目、鞘翅目、膜翅目、双翅目、直翅目、蜚蠊目、竹节虫目7个目的昆虫分别在进化树上聚于不同的分支。鞘翅目的莲草直胸跳甲A.hygrophila的CSPs与赤拟谷盗Triboliumcastaneum在进化树上聚于同一分支;鳞翅目的家蚕Bombyxmori、甘蓝夜蛾Mamestrabrassicae、烟芽夜蛾Heliothisvirescens、烟草天蛾Manducasexta、云杉色卷蛾Choristoneurafumiferana的CSPs在进化树上聚于同一分支;膜翅目的意蜂Apismellifera、欧洲马蜂Polistesdominula、阿根廷蚂蚁Linepithemahumile的CSPs在进化树上聚于同一分支;直翅目的东亚飞蝗Locustamigratoria、沙漠蝗Schistocercagregaria在进化树上聚于同一分支。莲草直胸跳甲19个CSPs中有9个与鞘翅目的赤拟谷盗CSPs在进化树上聚于同一分支,亲缘关系较近。昆虫的CSPs保守性比较高,在不同种之间也有40%~50%的同源性。莲草直胸跳甲的AhygCSP3、AhygCSP19与鞘翅目的赤拟谷盗TcasCSP1、膜翅目的意蜂AmelCSP2、鳞翅目的家蚕BmorCSP16在进化树上聚于同一分支;AhygCSP6、AhygCSP7与鳞翅目的家蚕BmorCSP12在进化树上聚于同一分支;AhygCSP810、AhygCSP13、AhygCSP18与BmorCSP1、BmorCSP6在进化树上聚于同一分支;AhygCSP4与鳞翅目的BmorCSP11、BmorCSP13、CfumCSP1在进化树上聚于同一分支;AhygCSP17与直翅目的沙漠蝗SgreCSP6在进化树上聚于同一分支,亲缘关系较近。在进化树上聚于不同支的CSPs一般具有不同的功能,这与昆虫长期适应复杂的环境从而进化出多样的功能有关。

图3 莲草直胸跳甲CSPs的多序列比对Fig.3 The multiple sequence alignment of Agasicles hygrophila CSPs注:CSPs氨基酸序列及GenBank登录号:苜蓿盲蝽(ACZ58023.1);颜色及对应一致性:红色表示一致性≥75%;绿色表示 一致性≥50%。Note:The sequence of CSPs and their GenBank accession number:Adelphocoris lineolatus (ACZ58023.1);Color and corresponding identity:The red indicate identity≥75%;The green indicate identity≥50%.
3 讨论与结论
经ORFfinder和NCBI blastp从莲草直胸跳甲的转录组数据中筛出19个莲草直胸跳甲CSPs。莲草直胸跳甲CSPs是一种外分泌亲水性蛋白,分子量在8~13kD,由69~144个氨基酸组成,理论等电点位于7附近,大部分是不稳定蛋白。脂肪系数比较高,热稳定性较强。CSPs一般具有信号肽,这对蛋白质前体正确跨膜、转运、定位并发挥相应的功能具有重要的作用。莲草直胸跳甲CSPs一般不具有跨膜结构,这与CSPs为分泌蛋白有关。莲草直胸跳甲CSPs主要由4个保守的半胱氨酸残基组成,第1个和第2个半胱氨酸残间隔6个氨基酸残基,第3个和第4个半胱氨酸残基间隔2个氨基酸残基。4个半胱氨酸残基通过两个互不连锁的二硫键分别形成两个氨基酸环。莲草直胸跳甲的CSPs符合一般昆虫CSPs具有的3个高度保守的结构域:N端YTTKYDN(V/l)(N/D)(L/V)DEIL、中部DGKELKXX(I/L)PDAL和C端KYDP。莲草直胸跳甲CSPs亲疏水性氨基酸的含量和分布与高级结构的形成有密切关系。莲草直胸跳甲CSPs的二级结构主要由α螺旋(Alpha helix)和无规卷曲(Random coil)组成。CSPs的三级结构形成亲水表面和疏水空腔,这与CSPs适应周围微环境识别结合脂溶性配体有关。莲草直胸跳甲的CSPs形成后要经过磷酸化、乙酰化、糖基化等翻译后修饰才能发展为成熟蛋白质并发挥相应的功能。莲草直胸跳甲CSPs保守性较高,在目之间具有很高的相似性,与其他鞘翅目昆虫的CSPs具有较高的同源性。
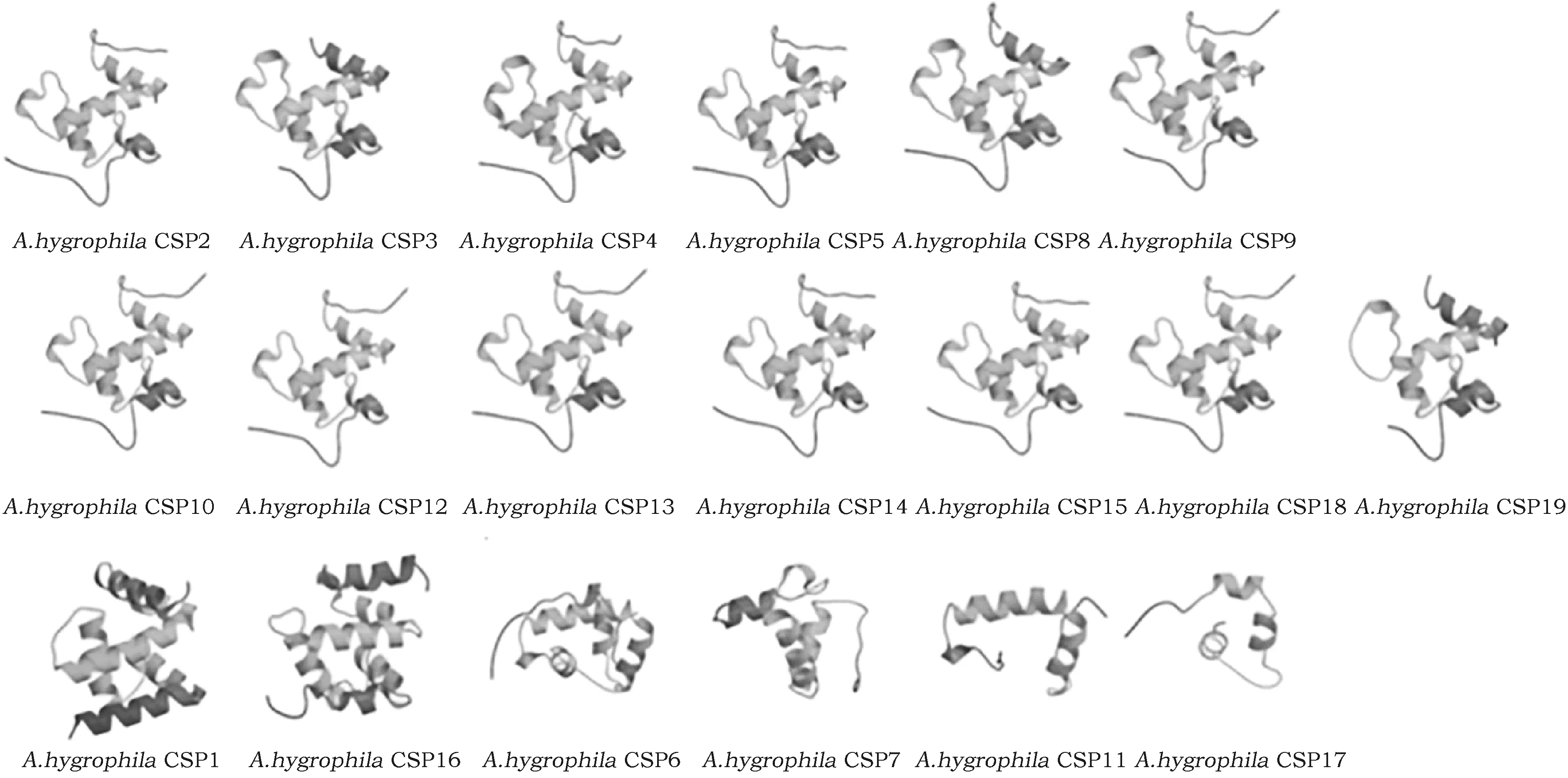
图4 莲草直胸跳甲CSPs三级结构Fig.4 The tertiary structure of Agasicles hygrophila CSPs

表4 莲草直胸跳甲CSPs蛋白的磷酸化、糖基化、乙酰化位点数目Table 4 The number of phosphorylation,glycosylation and acetylation sites of Agasicles hygrophila CSPs
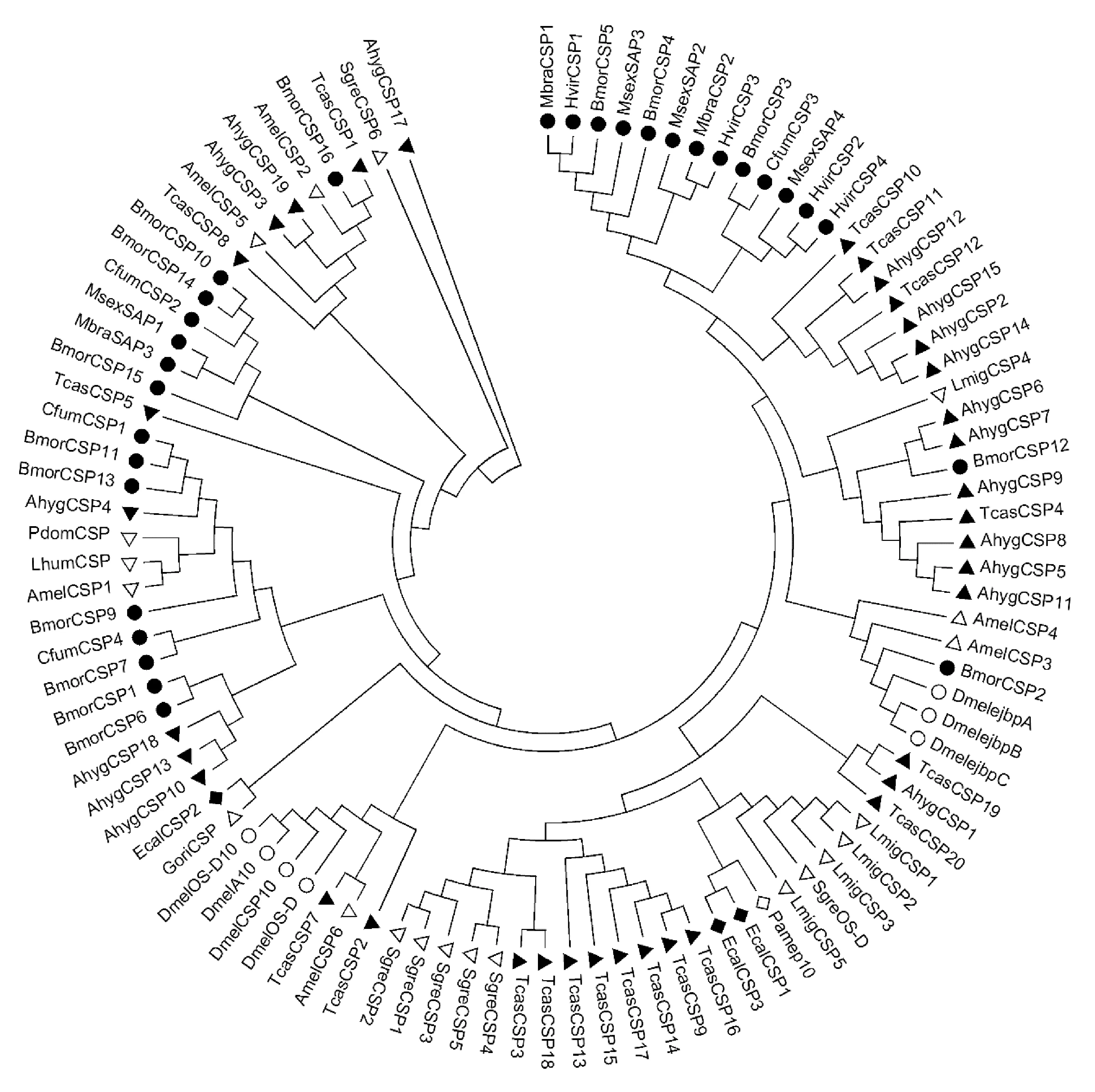
图5 基于NJ法构建的莲草直胸跳甲CSPs和其他昆虫CSPs的进化树Fig.5 The neighbor-joining(NJ) tree of Agasicles hygrophila CSPs with homologous proteins from other insect species based on the amino acid sequences注:符号及对应目Symbols and corresponding orders:○:鳞翅目Lepidoptera;●:鞘翅目Coleoptera;△:膜翅目Hymenoptera;▽:双翅目Diptera;◇:直翅目Orthoptera;◆:蜚蠊目Blattaria;▲:竹节虫目Phasmida.;物种名简称及对应全称Species abbreviation and corresponding universal names:莲草直胸跳甲Ahyg:A.hygrophila;黑腹果蝇 Dmel:D.melanogaster;家蚕 Bmor:Bombyx mori;甘蓝夜蛾 Mbra:M.Brassicae:烟芽夜蛾 Hvir:H.virescens;烟草天蛾 Msex:M.sexta;云杉色卷蛾 Cfum:C.fumiferana;意蜂 Amel:A.mellifera;欧洲马蜂 Pdom:P.dominula;阿根廷蚂蚁 Lhum:L.humile;东亚飞蝗 Lmig:L.migratoria;沙漠蝗 Sgre:S.gregaria;东方蝼蛄 Gori:G.orientalis;美洲大蠊 Pame:P.Americana;竹节虫 Ecal:E.calcarata;赤拟谷盗 Tcas:T.castaneum.CSPs氨基酸序列及GenBank登录号 The sequence of CSPs and their GenBank accession number:DmelOS-D10(aAAA21 358.1);DmelA10(AAC46 473.1);DmelCSP10(AAF49 381.1);DmelOS-D(AAC46 473.1);DmelejbpA(NP_524 966.1);DmelejbpB(NP_001 286 808.1);DmelejbpC(NP_001 286 809.1);BmorCSP1(ABH88 194.1);BmorCSP2(ABH88 195.1);BmorCSP3(BAF34 351.1);BmorCSP4(BAF34 352.1);BmorCSP5(BAF34 353.1);BmorCSP7(BAF34 355.1);BmorCSP9(BAF34 357.1);BmorCSP10(BAF34 358.1);BmorCSP11(BAF34 359.1);BmorCSP12(ABH88 205.1);BmorCSP13(ABH88 206.1);BmorCSP14(ABH88 207.1);BmorCSP15(NP_001 091 781.1);BmorCSP16(ABH88 209.1);MbraSAP3(AAK14 793.1);MbraCSP1(AAF71 290.2);MbraCSP2(AAF71 289.1);HvirCSP1(AAM77 041.1);HvirCSP2(AAM77 040.1);HvirCSP3(AAM77 042.1);HvirCSP4(ACX53 745.1);MsexSAP1(AAF16 696.1);MsexSAP2(AAF16 714.1);MsexSAP3(AAF16 707.1);MsexSAP4(AAF16 721.1);CfumCSP1(AAR84 077.1);CfumCSP2(AAR84 078.1);CfumCSP3(AAR84 079.2);CfumCSP4(AAW23 971.1);AmelCSP1(ABH88 169.1);AmelCSP2(ABH88 170.1);AmelCSP3(ABH88 171.1);AmelCSP4(ABH88 172.1);AmelCSP5(ABH88 173.1);AmelCSP6(ABH88 174.1);PdomCSP(AAP55 719.1);LhumCSP(AAN01 363.1);LmigCSP1(CAB65 181.1);LmigCSP2(CAB65 180.1);LmigCSP3(CAB65 179.1);LmigCSP4(CAB65 178.1);LmigCSP5(CAB65 177.1);SgreOS-D(AAP57 461.1);SgreCSP1(AAC25 399.1);SgreCSP2(AAC25 400.1);SgreCSP3(AAC25 401.1);SgreCSP4 (AAC25 402.1);SgreCSP5(AAC25 403.1);SgreCSP6(AAT39 531.1);Gori(AAQ85 057.1);Pame(AAB84 283.1);EcalCSP1(AAD30 550.1);EcalCSP2(AAD30 551.1);EcalCSP3(AAD30 552.1);TcasCSP1(ABH88 175.1);TcasCSP2(ABH88 176.1);TcasCSP3(EFA07 417.1);TcasCSP4(ABH88 177.1);TcasCSP5(ABH88 178.1);TcasCSP6(ABH88 179.1);TcasCSP7(ABH88 180.1);TcasCSP8(ABH88 181.1);TcasCSP9(ABH88 182.1);TcasCSP10(ABH88 183.1);TcasCSP11(ABH88 184.1);TcasCSP12(ABH88 185.1);TcasCSP13(ABH88 186.1);TcasCSP14(ABH88 187.1);TcasCSP15(ABH88 188.1);TcasCSP16(ABH88 189.1);TcasCSP17(ABH88 190.1);TcasCSP18(ABH88 191.1);TcasCSP19(ABH88 192.1);TcasCSP20(ABH88 193.1).
利用SWISS-MODEL进行同源建模是研究蛋白质三维结构的重要手段。CSPs三维结构的构象及关键氨基酸残基与昆虫的趋性行为有密切的联系[22]。研究表明苜蓿盲蝽A.lineolatusCSP5的异亮氨酸Ile67参与对3-己酮(3-Hexanone)、3,4-二甲基苯甲醛(3,4-Dinethylbenzaldehyde)的识别,而这两种小分子化学物质是棉花的主要挥发性绿叶气成分和基本的花香物质,是植物的最基本的物质,在植食性昆虫定位寄主植物的过程中发挥作用[23~25]。经多序列比对发现,AlinCSP5与AhygCSP1、AhygCSP2、AhygCSP5、AhygCSP6、AhygCSP7、AhygCSP9、AhygCSP11、AhygCSP12、AhygCSP14、AhygCSP15、AhygCSP16均具有该保守的异亮氨酸残基Ile。AlinCSP5经SWISS-MODEL进行结构模拟后发现由6个α螺旋组成,通过两个V型的结构形成结合腔。除AhygCSP6、AhygCSP7、AhygCSP11、AhygCSP17外,其余莲草直胸跳甲CSPs均具有与其相似的构象。因此AhygCSP1、AhygCSP2、AhygCSP5、AhygCSP9、AhygCSP12、AhygCSP14、AhygCSP15、AhygCSP16具有与AlinCSP5相似的构象和关键的氨基酸位点,可能参与寄主植物释放的挥发性绿叶气和花香物质的识别。
莲草直胸跳甲的NCBI blastp结果显示19个CSPs中AhygCSP1、AhygCSP2、AhygCSP3、AhygCSP6、AhygCSP12、AhygCSP14、AhygCSP15、AhygCSP19与小蜂甲、中欧山松大小蠹、家蝇、光肩星天牛的ejbp (ejaculatory bulb-specific protein)一致性最高。由于黑腹果蝇在分泌雄性性信息素醋酸酯vaccenyl acetate的射精管ejb(ejaculatoryducl bulb)中表达CSPs[26],参与储存并释放性信息素[27]。因此,AhygCSP1、AhygCSP2、AhygCSP3、AhygCSP6、AhygCSP12、AhygCSP14、AhygCSP15、AhygCSP19可能表达于化学感受器官射精管ejb中,参与结合并释放性信息素。CSPs不仅在嗅觉器官如触角中表达,而且在非嗅觉器官如胸、腹、足、翅、喙、足、上颌骨触须、唇须、下颚须及性腺中也有很高的表达量[6,28,29]。CSPs广泛表达于昆虫各种化学感受器官中,它的表达分布与功能多样性相关,CSPs可同时位于不同部位参与识别环境中的化学信号[27]。因此AhygCSP1、AhygCSP2、AhygCSP12、AhygCSP14、AhygCSP15可能同时参与识别植物释放的挥发性绿叶气成分和昆虫释放的性信息素。
由于CSP表达分布具有多样性,因此CSPs除具有嗅觉方面的功能外,还具有其他方面的功能:(1)释放化学信号:果蝇CSP EjB-III (Ejaculatory bulb protein III)在产生性信息素醋酸酯(Vaccenyl acetate)的器官——射精管(ejaculatory bulb)中参与结合和释放性腺和精液中的雄性性信息素[26]。甘蓝夜蛾(M.brassicae) CSPMbraA6和CSPMbraB1参与结合生殖腺中疏水性化学物质并释放到周围环境中[30]。东亚飞蝗(Locustamigratoria)LmigCSP91特异性表达于雄性生殖器官而在雌性生殖器官中没有表达,对性信息素有很高的亲和力,作为转运蛋白在交配时转移信息素[31]。(2)发育:沙漠蝗(Schistocercamigratoria) CSPs与其独居型向群居型转变有关[32];美洲大蠊(Periplanetaamericana) CSPs与足的再生有关[33,34]。蜜蜂CSP5特异性表达于卵巢、卵,与胚胎的发育有关[35]。红火蚁(Solenopsisinvicta) CSP9在三龄幼虫末期表达量最高,影响脂肪酸的合成和表皮的发育[36]。(3)免疫:对家蚕(Bombyxmori)施以亚致死计量的杀虫剂,肠道中的一些CSPs显著上调,CSPs参与分离和屏蔽有毒的杀虫剂分子形成复合物通过粪便排出体外[22,37]。
综上所述,AhygCSP1、AhygCSP2、AhygCSP12、AhygCSP14、AhygCSP15可能参与识别植物释放的挥发性绿叶气成分。CSPs是寄主植物识别和定位的重要嗅觉相关蛋白。本课题组研究表明莲草直胸跳甲是通过嗅觉感知两种植物挥发物DMNT ((E)-4,8-dimethyl-1,3,7-nonatriene)和顺-3-己烯醇((Z)-3-hexenol)的特殊比例来实现对喜旱莲子草的识别和定位[19]。因此我们将进一步对AhygCSP1、AhygCSP2、AhygCSP5、AhygCSP9、AhygCSP12、AhygCSP14、AhygCSP15、AhygCSP16进行嗅觉反应的功能及分子机制研究,以期解析专食性天敌莲草直胸跳甲对入侵性杂草喜旱莲子草的识别和定位,确保生态安全。
CSPs与环境中的化学信号分子结合后穿过亲水性的触角感器淋巴液到达感觉神经元树突膜上的气味受体,将化学信号转变成电信号传递到昆虫的触角叶产生相应的行为反应[38]。嗅觉信号决定植食性昆虫的寄主偏好性[19]。莲草直胸跳甲是从原产地引进用来防治入侵性杂草喜旱莲子草的专食性天敌[18]。寄主专一性和潜在的寄主转移是用来筛选和评估生防作用物的重要标准[19]。植食性甲虫莲草直胸跳甲是利用两种植物挥发物DMNT((E)-4,8-dimethyl-1,3,7-nonatriene)和顺-3-己烯醇((Z)-3-hexenol)的特殊比例来区分寄主植物喜旱莲子草和非寄主植物的[19]。虽然植食性雌性甲虫莲草直胸跳甲是通过区分许多化合物来区别寄主植物和非寄主植物的,DMNT和顺-3-己烯醇不足以改变它的取食和产卵偏好,但在寄主植物喜旱莲子草上施加顺-3-己烯醇和非寄主植物莲子草(Alternantherasessilis)上施加DMNT却可以导致植食性甲虫莲草直胸跳甲在非寄主植物莲子草上进行产卵和孵化[19]。因此通过区分嗅觉信号可导致生防作用物所不期望的寄主范围扩张,此种现象代表着重要潜在寄主转移的警告和生防作用物侵袭力的发展[19]。外来引进物种莲草直胸跳甲通过CSPs来感知环境中的嗅觉信号来识别入侵性杂草喜旱莲子草从而保证它的专食性具有重要意义。如果莲草直胸跳甲不能通过识别嗅觉信号来定位寄主植物可能会出现潜在的寄主转移(攻击非靶标植物的现象)从而引发生物安全的问题,使生态系统的稳定性和安全性受到威胁[39]。因此研究外来引进物种莲草直胸跳甲通过嗅觉相关蛋白CSPs来感知周围环境中的化学信号从而实现寄主植物的识别和定位具有重要意义。研究嗅觉编码的功能及分子机制对于确保莲草直胸跳甲的专食性从而保证生态安全具有重要作用,莲草直胸跳甲CSPs的生物信息学分析为深入研究莲草直胸跳甲CSPs的嗅觉编码的功能及分子机制提供了理论依据。
[1] Elfekih S,Chen C Y,Hsu J C,et al.Identification and preliminary characterization of chemosensory perception-associated proteins in the melon flyBactroceracucurbitaeusing RNA-seq[J].Scientific Reports,2016,6:19112.
[2] Zhang Y N,Jin J Y,Jin R,et al.Differential expression patterns in chemosensory and non-chemosensory tissues of putative chemosensory genes identified by transcriptome analysis of insect pest the purple stem borerSesamiainferens(Walker)[J].Plos One,2013,8(7):e69715.
[3] Li X M,Zhu X Y,Wang Z Q,et al.Candidate chemosensory genes identified inColaphellusbowringiby antennal transcriptome analysis[J].BMC Genomics,2015,16(1):1028.
[4] Zhang J,Wang B,Dong S,et al.Antennal transcriptome analysis and comparison of chemosensory gene families in two closely related noctuidae moths,HelicoverpaarmigeraandH.assulta[J].Plos One,2015,10(2):e0117054.
[5] Zhang J,Walker W B,Wang G.Chapter Five-Pheromone Reception in Moths:From Molecules to Behaviors[J].Progress in Molecular Biology and Translational Science,2015,130:109-128.
[6] Pelosi P,Iovinella I,Felicioli A,et al.Soluble proteins of chemical communication:an overview across arthropods[J].Frontiers in Physiology,2014,5:320.
[7] Ozaki M,Wada-Katsumata A,Fujikawa K,et al.Ant nestmate and non-nestmate discrimination by a chemosensory sensillum[J].Science,2005,309(5732):311-314.
[8] Maleszka R,Stange G.Molecular cloning,by a novel approach,of a cDNA encoding a putative olfactory protein in the labial palps of the mothCactoblastiscactorum[J].Gene,1997,202(1-2):39-43.
[9] Vieira F G,Rozas J.Comparative Genomics of the Odorant-Binding and Chemosensory Protein Gene Families across the Arthropoda:Origin and Evolutionary History of the Chemosensory System[J].Genome Biology and Evolution,2011,3(1):476-490.
[10] Picimbon J F,Dietrich K,Angeli S,et al.Purification and molecular cloning of chemosensory proteins inBombyxmori[J].Archives of Insect Biochemistry and Physiology,2000,44(3):120-129.
[11] Wanner K W,Willis L G,Theilmann D A,et al.Analysis of the insect os-d-like gene family[J].Journal of chemical ecology,2004,30(5):889-911.
[12] Picimbon J F,Leal W S.Olfactory soluble proteins of cockroaches[J].Insect Biochemistry and Molecular Biology,1999,29(11):973-978.
[13] Zhu J,Iovinella I,Dani F R,et al.Conserved chemosensory proteins in the proboscis and eyes of Lepidoptera[J].International Journal of Biological Sciences,2016,12(11):1394-1404.
[14] 田晓涵,刘玉玲,李永梅,等.两种不同生境植物棉花与雪莲 CDPK1基因的克隆及生物信息学分析[J].江苏农业学报,2016,32(5):1005-1012.
[15] 马瑞燕,王韧.喜旱莲子草在中国的入侵机理及其生物防治[J].应用与环境生物学报,2005,11(2):246-250.
[16] Buckingham G R.Biological control of Alligatorweed,Alternantheraphiloxeroides,the world’s first aquatic weed success story[J].Castanea,1996,61(3):232-243.
[17] Spencer N R,Coulson J R.The biological control of alligatorweed,Alternantheraphiloxeroides,in the United States of America[J].Aquatic Botany,1976,2(76):177-190.
[18] 马瑞燕.空心莲子草天敌-莲草直胸跳甲引进中国后的生态适应性研究[D].北京:中国农业科学院,2001:32.
[19] Li N,Li S,Ge J,et al.Manipulating two olfactory cues causes a biological control beetle to shift to non-target plant species[J].Journal of Ecology,2017,105:1534-1546.
[20] 于欣,杨震,楚元奎,et al.IL-6基因结构和功能生物信息学预测[J].国际检验医学杂志,2016,37(21):2959-2960.
[21] Zhao Z,Liu B,Rong E,et al.Bioinformatic analysis of gene encoding odorant binding protein (OBP) 1,OBP2,and chemosensory proteins inGrapholitamolesta[J].Biochemical Systematics and Ecology,2017,70:60-68.
[22] Liu G,Ma H,Xie H,et al.Biotype Characterization,Developmental Profiling,Insecticide Response and Binding Property ofBemisiatabaciChemosensory Proteins:Role of CSP in Insect Defense[J].Plos One,2016,11(5):e0154706.
[23] 马双.植物气味分子与苜蓿盲蝽化学感受蛋白识别结合特性研究[D].哈尔滨:东北农业大学,2011:53.
[24] 杜家纬.植物-昆虫间的化学通讯及其行为控制[J].分子植物,2001,27(3):193-200.
[25] Yu H L,Zhang Y J,Pan W L,et al.Identification of volatiles from field cotton plant under different induction treatments[J].Chinese Journal of Applied Ecology,2007,18(4):859-864.
[26] Dyanov H M,Dzitoeva S G.Method for attachment of microscopic preparations on glass for in situ hybridization,PRINS and in situ PCR studies[J].Biotechniques,1995,18(5):822.
[27] Pelosi P,Iovinella I,Zhu J,et al.Beyond chemoreception:diverse tasks of soluble olfactory proteins in insects[J].Biological Reviews of the Cambridge Philosophical Society,2017:doi:10.1111/brv.12339.
[28] Briand L,Swasdipan N,Nespoulous C,et al.Characterization of a chemosensory protein (ASP3c) from honeybee (Apis mellifera L.) as a brood pheromone carrier.[J].Febs Journal,2002,269(18):4586-4596.
[29] Picone D,Crescenzi O,Angeli S,et al.Bacterial expression and conformational analysis of a chemosensory protein fromSchistocercagregaria[J].European Journal of Biochemistry,2001,268(17):4794-4801.
[30] Jacquin-Joly E,Vogt R G,François M C,et al.Functional and expression pattern analysis of chemosensory proteins expressed in antennae and pheromonal gland ofMamestrabrassicae[J].Chemical Senses,2001,26(7):833-844.
[31] Zhou X H,Ban L P,Iovinella I,et al.Diversity,abundance,and sex-specific expression of chemosensory proteins in the reproductive organs of the locustLocustamigratoriamanilensis[J].Biological Chemistry,2013,394(1):43-54.
[32] Guo W,Wang X,Ma Z,et al.CSP and takeout genes modulate the switch between attraction and repulsion during behavioral phase change in themigratorylocust[J].Plos Genetics,2011,7(2):e1001291.
[33] Kitabayashi A N,Arai T,Kubo T,et al.Molecular cloning of cDNA for p10,a novel protein that increases in the regenerating legs ofPeriplanetaamericana(American cockroach)[J].Insect Biochemistry and Molecular Biology,1998,28(10):785-790.
[34] Nomura A,Kawasaki K,Kubo T,et al.Purification and localization of p10,a novel protein that increases in nymphal regenerating legs ofPeriplanetaamericana(American cockroach)[J].International Journal of Developmental Biology,1992,36(3):391.
[35] Forêt S,Wanner K W,Maleszka R.Chemosensory proteins in the honey bee:Insights from the annotated genome,comparative analyses and expressional profiling[J].Insect Biochemistry and Molecular Biology,2007,37(1):19-28.
[36] Cheng D,Lu Y,Zeng L,et al.Si-CSP9 regulates the integument and moulting process of larvae in the red imported fire ant,Solenopsisinvicta[J].Scientific Reports,2015,5:9245.
[37] Xuan N,Guo X,Xie H Y,et al.Increased expression of CSP and CYP genes in adult silkworm females exposed to avermectins[J].Insect Science,2015,22(2):203-219.
[38] Hojo M K,Ishii K,Sakura M,et al.Antennal RNA-sequencing analysis reveals evolutionary aspects of chemosensory proteins in the carpenter ant,Camponotusjaponicus[J].Scientific Reports,2015,5:13541.
[39] 胡隐昌,肖俊芳,李勇,等.生物安全及其评价[J].华中农业大学学报(社会科学版),2005(1):29-36.

