18氟-脱氧葡萄糖PET/CT对原发灶不明的骨转移瘤的诊断作用
周维风,高光健,杨继文,戴云海,程光华
皖南医学院弋矶山医院核医学科,安徽 芜湖 241001
恶性肿瘤晚期发生骨转移较常见,而原发灶不明的骨转移瘤(BMUPT)约占骨转移瘤的2.8%[1]。由于原发灶不明,给临床治疗过程中带来很多困难。肿瘤一旦发生骨转移,已属于晚期,很多患者主动放弃具有确诊意义的穿刺活检检查,此时只能通过临床随访或者影像学检查来间接诊断,使研究具有一定局限性。PET/CT为全身性检查,与常规影像学检查相比1次扫描可以同时获得解剖结构及功能代谢信息。此前有PET/CT在BMUPT患者中的应用研究,但对不同部位骨转移瘤的SUVmax值未做进一步比较。本研究收集本院原发灶不明的骨转移患者PET/CT检查及相关资料,探讨PET/CT检查在原发灶不明的骨转移瘤中诊断价值,并总结不同类型及不同部位骨转移瘤的PET/CT检查特点。
1 资料与方法
1.1 一般资料
选择从2014年11月~2017年6月在我院行PET/CT检查的原发灶不明的骨转移瘤患者49例,其中男性33例,女性16例,年龄34~87岁,平均60.7岁。38例为其他影像学检查发现骨异常而就诊,11例因不明原因骨痛而就诊。
纳入标准:(1)既往无恶性肿瘤病史;(2)经影像学检查发现骨质破坏或者因自发性骨痛就诊;(3)经详细的病史采集、体格检查、影像学及血液学检查均未发现原发灶;(4)符合骨转移瘤诊断标准[2]:手术或活体组织检查确定,影像学检查如X线平片、CT、MRI等随访观察半年骨病变进展,复查18氟-脱氧葡萄糖(18F-FDG)PET/CT或99mTc-MDP骨显像时病变进展。排除标准:(1)原发性骨肿瘤;(2)淋巴及血液系统肿瘤;(3)良性骨病。
49例骨转移瘤患者中1例通过活体组织检查证实,44例通过CT、MRI、核素骨扫描等影像学检查诊断,4例经随访观察半年以上发现骨病变进展证实。PET/CT正确检出原发灶的48例患者中经病理检查确定原发灶者28例,临床随访确定原发灶者20例。另有1例假阳性患者PET/CT诊断原发灶为食管癌,病理诊断为食管炎。
1.2 仪器与方法
受检者至少禁食6 h以上,空腹血糖<6.1 mmol/L,按3.70~5.55 MBq/kg静脉注射18F-FDG(南京江原安迪科正电子药物股份有限公司,放化纯>95%),静卧休息60 min,排尽尿液后平卧于PET/CT检查床上(德国西门子公司Biograph mCT型PET/CT)。自患者颅顶至股骨中上1/3处先行CT扫描,采集条件:电压120 kV电流160~210 mAs,层厚3 mm;再根据身高行5~7个床位PET扫描,2.5 min/床位。
1.3 图像分析
按照wilson法[3]对骨转移部位分为颅骨、脊柱、骨盆(不包括骶骨、尾骨)、胸部(不包括胸椎)、四肢5区。按照CT骨转移诊断标准[4]将转移灶分为溶骨性转移、成骨性转移及混合性转移。由2名有经验的放射专业医师和核医学专业医师采用盲法分析CT及PET/CT融合图像,对可疑病灶测量SUVmax大小,以SUVmax>2.5为阳性,SUVmax<2.5为阴性。记录原发灶、骨转移灶部位及转移性质。
1.4 统计学方法
采用SPSS 20.0统计软件,计量资料采用均数±标准差表示,对CT显示成骨性转移、溶骨性转移病例SUVmax行t检验;在成骨性转移及溶骨性转移病灶中,分别对颅骨、脊柱、骨盆、胸部、四肢5组转移灶SUVmax行方差分析,以P<0.05为差异有统计学意义。
2 结果
49例BMUPT患者接受了PET/CT检查(表1),经术后病理或临床随访证实原发灶与PET/CT结果一致者48例,不一致者1例,该患者PET/CT检查考虑原发灶为食管癌,病理显示为食管炎。原发灶检出正确率为98.0%。49例患者中42例存在淋巴结转移,26例存在远处脏器转移。远处脏器转移中肺转移16例,肝转移10例,肾上腺转移7例,肌肉转移6例,脑转移、胸膜转移各2例,乳腺及脾脏转移各1例。所有患者中存在溶骨性转移共40例,SUVmax=11.56±3.62,存在成骨性转移共16例,SUVmax=7.73±3.69,溶骨性转移SUVmax大于成骨性转移(t=3.55,P=0.001)。全身各部位骨转移发生率依次为脊柱91.8%(45/49),骨盆85.7%(42/49),胸 部77.5% (38/49),四 肢57.1% (28/49),颅 骨24.4%(12/49)。成骨性转移各部位SUVmax分别为颅骨6.57±2.82、脊 柱7.50±4.10、骨 盆6.54±2.67、胸 部6.11±3.43、四肢6.68±3.69;溶骨性转移各部位SUVmax分别为颅骨9.80±2.68,脊柱10.54±3.36,骨盆9.91±3.98,胸部8.55±3.86,四肢8.74±3.41。成骨性及溶骨性转移各部位之间SUVmax差异无统计学意义(成骨性F=0.387,P=0.817;溶骨性F=1.563,P=0.189,表2)。典型病例见图1~3。

表1 骨转移原发病灶及转移类型

表2 各部位骨转移瘤SUVmax比较

图1 混合性骨转移

图2 成骨性骨转移
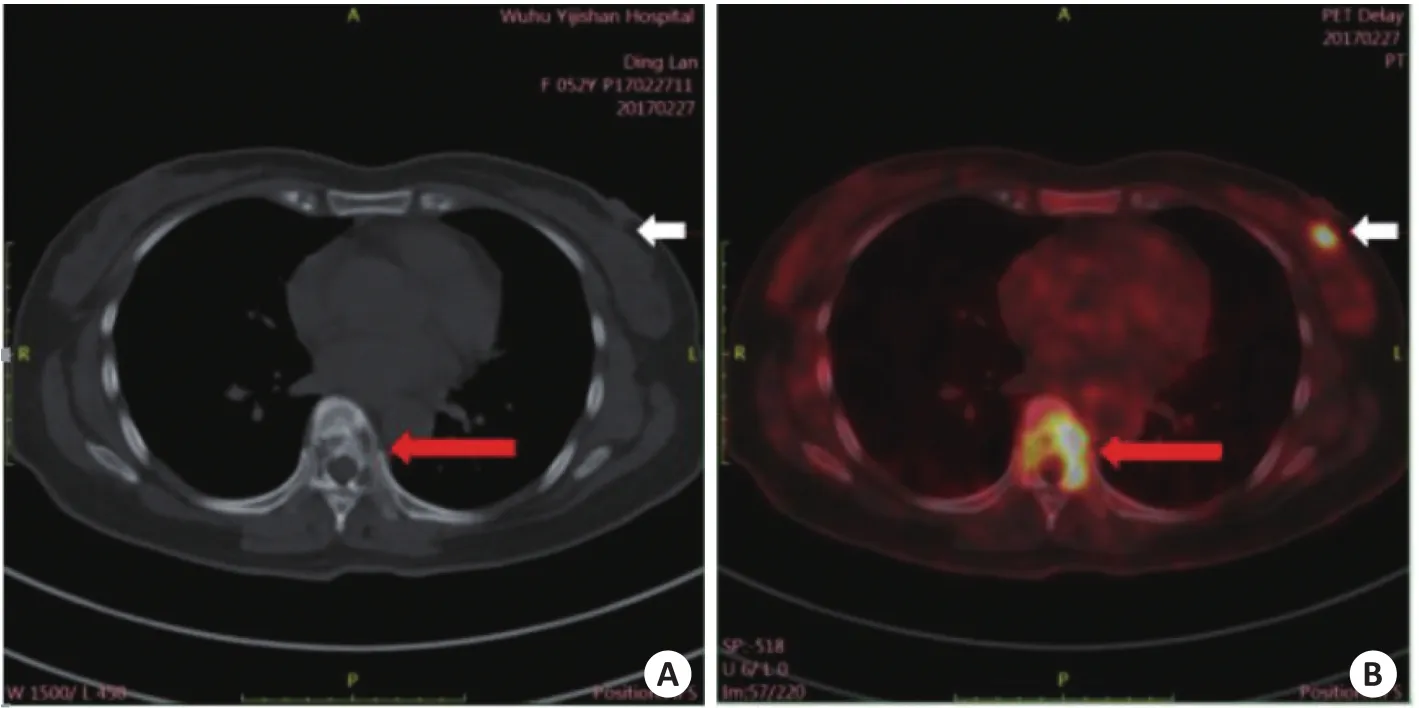
图3 溶骨性骨转移
3 讨论
恶性肿瘤的骨转移发生率国内报道约为67%[5],有25%~30%的恶性肿瘤以骨骼病变为初发表现[6-9],而常规影像学检查对不明原因的转移瘤原发灶检出率仅为10%~35%[10]。常规影像学检查均存在各种弊端:X线平片检查仅能获得局部部位重叠的影像信息;CT对溶骨性骨质破坏较为敏感,但对于尚未发生骨质结构改变的早期骨转移瘤的诊断比较困难;MRI检查耗时长,对胸部检查存在呼吸伪影,且对植入心脏起搏器的患者存在禁忌症。PET/CT为代谢性显像,1次扫描可以获得全身的解剖及功能图像,且无明显禁忌症,与常规影像学检查相比具有明显优势。对于BMUPT患者,利用其恶性肿瘤及转移灶18FFDG代谢增高的特点,PET/CT检查可以获得比其他影像学检更完善的信息。因此选择正确的影像学检查方法,在BMUPT患者的诊疗过程中有很大帮助。有研究对BMUPT检出的研究报告进行荟萃分析, 结果显示PET/CT能有效地检出常规检查未能检出的原发灶(检出率41%) 以及未发现的转移灶[11]。本研究中49例患者中PET/CT检出42例存在淋巴结转移、26例存在远处转移。这些淋巴结转移及远处转移的发现,对患者的临床分期以及进一步治疗都有很大价值。49例患者中仅有9例患者做了同期核素骨扫描,共发现骨转移灶64处,而PET/CT检查发现84处;有8例患者PET/CT检查发现了新的骨转移灶,与国内外学者研究结果[12-15]相符。说明PET/CT检查对骨转移灶的检出率高于核素骨扫描。
本研究共收集261例PET/CT发现骨转移病例,其中有49例检查前未发现原发灶,在所有骨转移病例中占18.7%。在49例BMUPT病例中,PET/CT检出48例原发灶,检出率为98.0%,高于国内相关报道(84.7%)[16]。可能由于患者对医疗知识的提高,倾向于选择全身PET/CT检查而放弃传统影像学大海捞针式的检查。这种行为导致原本可能被其他检查所发现的病灶被PET/CT检出。值得注意的是,在检出的48例原发灶中,有7例患者原发灶为胃癌。据报道,胃癌骨转移发生率为0.9%~10%[17],且一旦发生骨转移,患者预后较差[18]。因此当胃癌患者出现不明原因的骨痛时,应警惕骨转移的可能性,需要及时行核素骨扫描或者PET/CT检查明确诊断。
49例BMUPT患者中成骨性转移以前列腺癌多见;这是由于前列腺癌细胞在破骨的同时还可以分泌多种刺激骨形成的因子[19-21]。溶骨性转移以肺癌、胃癌多见,这是由于肺癌及胃癌病理类型多为腺癌。腺癌细胞脱落、趋化并迁移至骨组织,通过刺激破骨细胞分化诱导因子的表达从而激活破骨细胞的活性,大量活化的破骨细胞导致溶骨性骨质破坏,进一步释放促进肿瘤生长的各种细胞因子,形成溶骨性转移[22-23]。混合性转移依次为肺癌、胃癌、前列腺癌,可能与肿瘤细胞可以同时分泌具有破骨作用及成骨作用的因子有关。溶骨性转移病灶SUVmax大于成骨性转移。这是可能由于成骨性病灶中含肿瘤细胞成分较少,葡萄糖代谢活性较低所致[24]。成骨性转移有时骨质形态改变不明显,单纯CT诊断较困难,容易造成假阴性,且SUVmax较溶骨性转移低,PET有时难以同某些良性骨病及多发性骨髓瘤鉴别。因此PET/CT发现可疑成骨性转移灶时,应当从多个方面综合考虑,避免造成漏诊。有研究显示, MRI在一些前列腺癌中可发现较PET/CT更多的成骨性转移病变[25],有报道认为PET/MR较PET/CT对早期骨转移具有更高的诊断价值[26],因此在某些情况下可作为PET/CT的补充检查。成骨性及溶骨性转移各骨转移部位间SUVmax比较,差异均无统计学意义。可能由于转移灶虽部位不同,但来源于同一原发灶,其骨转移瘤细胞具有相似的生物学行为及葡萄糖代谢水平。
总之,全身检查及代谢显像是PET/CT的两大优势,图像扫描后经软件融合处理,可以同时获得全身解剖与代谢信息,提高病灶的检出率。在BMUPT患者中不仅可以明确原发灶,还可以而发现新的淋巴结及其他器官转移,为BMUPT患者进一步治疗提供可靠依据。
[1]吴小红, 华 东, 陈晓萍. 原发灶不明的骨转移性癌24例分析[J].肿瘤防治杂志, 2004, 11(04): 446-7.
[2]谢纪宝, 陈江涛, 宋兴华. 18F-FDG PET/CT与99mTc-MDP骨显像诊断肿瘤骨转移价值的Meta分析[J]. 中国循证医学杂志,2011, 11(06): 655-60.
[3]任 媛, 王莉莉, 郑永明. 原发灶不明的骨转移癌核素骨显像结果分析[J]. 长治医学院学报, 2007, 21(06): 453-4.
[4]曹来宾. 实用骨关节影像诊断学[M]. 济南: 山东科学技术出版社, 1998: 411-3.
[5]李鹏飞. 恶性肿瘤1000例骨扫描结果分析[J]. 中外医学研究, 2011,9(19): 22-3.
[6]Piccioli A. Breast cancer bone metastases: an orthopedic emergency[J]. Orthop Traumatol, 2014, 15(2): 143-4.
[7]Xu DL, Zhang XT, Wang GH, et al. Clinical features of pathologically confirmed metastatic bone tumors--a report of 390 cases[J]. Cancer, 2005, 24(11): 1404-7.
[8]Katagiri H, Takahashi M, Inagaki J, et al. Determining the site of the primary cancer in patients with skeletal metastasis of unknown origin: a retrospective study[J]. Cancer, 1999, 86(3): 533-7.
[9]Papagelopoulos PJ, Savvidou OD, Galanis EC, et al. Advances and challenges in diagnosis and management of skeletal metastases[J].Orthopedics, 2006, 29(7): 609-20.
[10]Chorost MI, Lee MC, Yeoh CB, et al. Unknown primary[J]. Surg Oncol, 2004, 87(10): 191-203.
[11]Sève P, Billotey C, Broussolle C, et al. The role of 2-deoxy-2-[F-18]fluoro-D-glucose positronemission tomography in disseminated carcinoma of unknown primary site[J]. Cancer, 2007, 109(2): 292-9.
[12]Yang HL, Liu T, Wang XM, et al. Diagnosis of bone metastases: a meta-analysis comparing18FDG PET, CT, MRI and bone scintigraphy[J]. Eur Radiol, 2011, 21(12): 2604-17.
[13]Chakraborty D, Bhattacharya A, Mete UK, et al. Comparison of 18F fluoride PET/CT and 99mTc-MDP bone scan in the detection of skeletal metastases in urinary bladder carcinoma[J]. Clin Nucl Med, 2013, 38(8): 616-21.
[14]Chang CY, Gill CM, Joseph SF, et al. Comparison of the diagnostic accuracy of 99mTc-MDP bone scintigraphy and 18F-FDG PET/CT for the detection of skeletal metastases[J]. Acta radiol, 2016,57(1): 58-65.
[15]Hurley C, Mccarville B, Shulkin BL, et al. Comparison of F-18-FDG-PET-CT and bone scintigraphy for evaluation of osseous metastases in newly diagnosed and recurrent osteosarcoma[J].Pediatr Blood Cancer, 2015, 33(15, S): 1381-6.
[16]李毅红, 刘春利, 卫建国, 等. 18F-FDG PET/CT对原发灶不明的骨转移瘤的诊断价值[J]. 中国医学影像学杂志, 2012, 20(11):858-61.
[17]徐 亭, 张艳桥. 胃癌骨转移的临床研究进展[J]. 中国肿瘤, 2016,25(08): 628-33.
[18]Lucia D, Antonietta SM, Caterina M, et al. Bone metastases in gastriccancer follow a RANKL-independent mechanism[J]. Oncol Rep, 2013, 29(4): 1453-8.
[19]Ricci E, Mattei E, Dumontet C, et al. Increased expression of putative cancerstem cell markers in the bone marrow of prostate cancer patients is associated with bone metastasis progression[J].Prostate, 2013, 73(16): 1738-46.
[20]Wang N, Docherty FE, Brown HK, et al. Prostate cancer cells preferentiallyhome to osteoblast-rich areas in the early stages of bone metastasis: evidence from in vivo models[J]. Bone Miner.Res, 2014, 29(12): 2688-96.
[21]Faltermeier CM, Drake JM, Clark PM, et al. Functional screen identifies kinases driving prostate cancer visceral and bone metastasis[J]. Proc Natl Acad Sci USA, 2016, 113(2): E172-81.
[22]韩 萍, 张幸平. 肺癌骨转移机制的研究进展[J]. 重庆医学, 2009,38(08): 992-4.
[23]Luo QQ, Xu ZY, Wang LF, et al. Progress in the research on the mechanism of bone metastasis in lung cancer[J]. Mol Clin Oncol,2016, 5(2): 227-35.
[24]Gj C, Houston S, Rubens R, et al. Detection of bone metastases in breast cancer by 18-FDG PET: differing metabolic activityin osterblastic and osteolytic lesions[J]. Clin Oncol, 1998, 16(10):3375-9.
[25]宋 乐, 袁慧书, 张卫方. 前列腺癌骨转移18F-FDG PET/CT临床应用分析[J]. 临床放射学杂志, 2016, 35(05): 768-71.
[26]Samarin A, Huellner M, Queiroz MA, et al. F-18-FDG-PET/Mr increases diagnostic confidence in detection of bone metastases compared with F-18-FDG-PET/CT[J]. Nucl Med Commun, 2015,36(12): 1165-73.

