心率减速力在2型糖尿病心脏自主神经病变诊断中的应用
唐文红,黄颖,田晓芬,陈晓婕,胡映玉
(广西壮族自治区人民医院,南宁530021)
心率减速力(DC)是基于动态心电图发展而来的一项新的检测指标,常用于猝死高危人群的筛选与预警,是一项最新无创性心电技术,能定量、独立地测定和分析迷走神经张力和自主神经功能,具有敏感性高、特异性强等特点[1~3]。糖尿病心脏自主神经病变(DCAN)是2型糖尿病常见的慢性并发症,被视为无痛性心肌梗死及猝死的重要原因之一[4]。糖尿病患者DC值的变化与DCAN进展相关,DC能否作为DCAN的诊断指标尚待研究证实[5]。本研究对此作了探讨。
1 资料与方法
1.1 临床资料 选取2015年5月~2016年5月本院内分泌科收治的2型糖尿病患者80例作为观察组,男38例、女42例,年龄31~60(47.28±8.3)岁。纳入标准:①符合《2010年2型糖尿病防治指南》糖尿病诊断标准[6];②对本研究知情且同意配合;③无其他重大疾病和明显器官功能障碍等。排除标准:①伴有心肌梗死、严重心律失常、心肌病等心脏病变及肝肾功能不全,恶性肿瘤或合并慢性严重性疾病;②糖尿病急性并发症,如糖尿病酮症酸中毒、高渗性昏迷、乳酸酸中毒等或感染、创伤、严重疾病等应激状态;③近2周内患者服用β受体阻滞剂、阿托品或洋地黄等影响心率的药物。同期选取体检健康者80例作为对照组,男41例、女39例,年龄32~69(48.75±9.6)岁。两组均签署知情同意书,本研究已通过本院伦理委员会认证。两组性别、年龄比较差异均无统计学意义(P均>0.05)。
1.2 DC及心率变异性(HRV)时域参数检测 两组均进行24 h动态心电图检测。将24 h动态心电图经120 Hz数字化自动处理系统转化为以心动周期RR值为纵坐标的序列图,筛选出减速周期,将心率段数值确定为30 个周期,以选定的减速点为中心,对不同心率段进行有序排列,对应有序号的周期用信号平均技术进行分析。经位相整序后,分别计算对应周期的平均值。X(0):所有中心点的RR间期的平均值;X(1):中心点右侧紧邻的第1个心动周期的平均值;X(-1):中心点左侧紧邻的第1个心动周期的平均值;X(-2):中心点左侧紧邻的第2个心动周期的平均值。通过分析软件DMS-300-4A计算DC值。DC=[X(0)+X(1)-X(-1)-X(-2)]×1/4。同时检测R-R间期标准差(SDNN)、R-R间期之差的均方根(RMSSD)、24 h 连续R-R 间期标准差≥50 ms 的百分数(pNN50)。
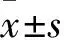
2 结果
2.1 两组DC值及HRV时域参数比较 观察组DC值及HRV时域参数均较对照组低(P均<0.05)。见表1。

表1 两组DC值及HRV时域参数比较
2.2 观察组DC值与时域参数的相关性 观察组DC 值与SDNN、RMSSD、pNN50呈正相关(r分别为0.62、0.57、0.52,P均<0.05)。
3 讨论
目前,糖尿病不仅是老年人群的常见病、高发病,而且其发病年龄逐渐年轻化,严重影响患者生活质量及生命安全。糖尿病可引起患者自主神经发生病变。此外,迷走神经节前纤维较长,对缺氧的敏感性较高、耐受性较差。因此迷走神经是受到损伤比较早且比较严重的神经之一。在糖尿病后期,患者迷走神经和交感神经均会受到不同程度的损伤[7,8]。
DCAN在糖尿病患者中发病率为17%~78%,起病隐匿,病情进展迅速,病情一般不能自行缓解,广泛累及全身各系统,并常伴有远端对称性多发性神经病变,升高致死率[9,10]。临床上,自主神经功能状态的异常参数常提示疾病预后不良,并与心血管病变的联系尤为紧密。基于多年的临床应用及科研进展,一系列定量评价自主神经功能的无创方法给临床自主神经功能状态检测带来了极大地便利[8]。包括心率震荡、HRV、心脏变时性及压力反射敏感性等方法已在临床上广泛应用。然而以上方法在临床应用受限,如一些参数的检测需要附加条件,在一定的病理生理变化时才可应用;多数检测均为间接检测,当存在参数间交互作用时,难以区别各参数反应的病变原因[9]。
2006年首次提出DC,其可通过分析24 h心率的整体趋向性,定量评估受检者迷走神经张力,及时发现心脑血管疾病的高危人群[10]。DC检测技术简便易行,并具有临床指导意义。其值可反映迷走神经的功能变化,如DC值降低则反映迷走神经的兴奋性降低,提示患者易发生猝死。目前,HRV时域常作为临床上自主神经功能的定量评价指标[11,12]。HRV的价值在于其对心源性猝死及DCAN的有效预测[13]。在HRV时域参数中,SDNN反映24 h自主神经功能的整体变化,是预测心源性猝死的重要指标;而RMSSD与pNN50则反映迷走神经张力的变化[14~16]。本研究结果显示,观察组HRV时域参数较对照组低,提示2型糖尿病患者可能存在自主神经功能损伤;观察组DC值也较对照组低。究其生理过程,原因可能为2型糖尿病患者机体长期处于高血糖状态,而高血糖内环境增强了肾上腺素系统-肾素-血管紧张素系统活性,降低交感神经阈值,并抑制副交感神经活性,最终致使迷走神经明显受损。此外,本研究相关分析显示,DC与HRV相关时域参数呈正相关。DC与迷走神经张力有关,DC值降低,提示迷走神经张力降低,对于机体的保护作用下降,从而产生猝死的危险。而SDNN反映的是自主神经功能,也是预测心源性猝死的重要指标。DC与SDNN的检测结果从不同神经功能方面相互佐证,给预测猝死提供依据。临床可采用DC值与HRV的联合检测,可多维度反映自主神经功能变化。
[1] Pan Q, Zhou G, Wang R, et al. The degree of heart rate asymmetry is crucial for the validity of the deceleration and acceleration capacity indices of heart rate: a model-based study[J]. Comput Biol Med, 2016,76:39-49.
[2] Arsenos P, Manis G, Gatzoulis KA, et al. Deceleration capacity of heart rate predicts arrhythmic and total mortality in heart failure patients [J]. Ann Noninvasive Electrocardiol, 2016,21(5):508-518.
[3] Wang YP, Kuo TB, Li JY, et al. The relationships between heart rate deceleration capacity and spectral indices of heart rate variability during different breathing frequencies[J]. Eur J Appl Physiol, 2016,116(7):1281-1287.
[4] 邵爱菊,潘华.心率减速力和心率变异性分析对糖尿病患者自主神经病变的评价功能分析[J].医学信息,2014,7(9) : 163.
[5] Rivolta MW, Stampalija T, Casati D, et al. Acceleration and deceleration capacity of fetal heart rate in an in-vivo sheep model[J]. PLoS One, 2014,9(8): e104193.
[6] 阮炳新.心率减速力及其心血管疾病中的临床应用[J].中国医学创新,2013,10(31):151.
[7] Ricca-Mallada R, Migliaro ER, Piskorski J, et al. Exercise training slows down heart rate and improves deceleration and acceleration capacity in patients with heart failure[J]. J Electrocardiol, 2012,45(3):214-219.
[8] 杨浩,姜涛,宋秀霞.胰岛素短期强化治疗对2型糖尿病患者代谢指标和心脏自主神经病变的影响[J].山东医药,2011,51(17):13-15.
[9] 张妍,徐桂芳,程雯.2型糖尿病合并抑郁症患者心率变异性分析[J].临床荟萃,2012,27(12):1036.
[10] Schaeffer BN, Rybczynski M, Sheikhzadeh S, et al. Heart rate turbulence and deceleration capacity for risk prediction of serious arrhythmic events in Marfan syndrome[J]. Clin Res Cardiol, 2015,104(12):1054-1063.
[11] Birkhofer A, Geissendoerfer J, Alger P, et al. The deceleration capacity- a new measure of heart rate variability evaluated in patients with schizophrenia and antipsychotic treatment[J]. Eur Psychiatry, 2013,28(2):81-86.
[12] Graatsma EM, Mulder EJ, Vasak B, et al. Average acceleration and deceleration capacity of fetal heart rate in normal pregnancy and in pregnancies complicated by fetal growth restriction[J]. J Matemetal Neonatal Med, 2012,25(12):2517-2522.
[13] Kreuz J, Lickfett LM, Schwab JO. Modern noninvasive risk stratification in primary prevention of sudden cardiac death[J]. J Interv Card Electrophysiol, 2008,23(1):23-28.
[14] Ottaviani G, Buja LM. Anatomopathological changes ofthe cardiac conduction system in sudden cardiac death,particularly in infants: advances over the last 25 years[J]. Cardiovasc Pathol, 2016,25(6):489-499.
[15] 曹晓晓,文红霞,张京杨,等.学龄前儿童病毒性心肌炎心率变异性与心率减速力分析[J].临床儿科杂志,2012,30(7):619-621.
[16] Birkhofer A, Alger P, Schmid G. The cardiovascular risk of schizophrenic patients[J]. Neuropsychiatr, 2007,21(4):261-226.

