血液透析患者颈动脉内中膜厚度与血栓调节蛋白、炎症因子及心血管疾病的关联
赵俊丽 朱君君 邵 霞 顾秀清 顾 敏
心血管疾病(CVD)是维持性血液透析(MHD)患者的主要并发症及死亡原因,有将近50%的患者死于CVD,所以早期发现、及时预防和治疗非常重要[1]。颈动脉内中膜厚度(carotid artery intima-media thickness,cIMT)是冠心病及脑卒中的重要危险因素,是早期动脉硬化(AS)的标志,可直接反映全身动脉硬化程度,是CVD事件的有效预测因子[2]。血管内皮损伤或功能紊乱是动脉硬化重要的始动环节,并贯穿于AS的始终。血栓调节蛋白(thrombomodulin,Tm) 是一种存在于细胞膜表面的跨膜单链糖蛋白[3],血浆中Tm 主要是损伤的血管内皮细胞Tm的降解片段,其水平反映了血管内皮损伤的程度,可作为判断血管内皮损伤的标准[4-5]。目前已知血管内皮损伤、微炎性反应等因素参与AS的形成,是MHD患者CVD高发的重要原因[6],但这些危险因素之间的相互关系尚未见报道。本研究通过对MHD患者检测cIMT、血浆Tm及炎症因子等指标,探讨颈动脉粥样硬化与Tm和炎症因子之间的关系,及对MHD患者CVD发生的影响。
对象和方法
研究对象本研究选取2014年6月至2015年12月在上海市浦东新区周浦医院血液净化中心进行MHD,且透析龄≥3个月的患者。排除标准:乙型和丙型肝炎及其他严重肝脏疾病、严重感染、慢性阻塞性肺疾病、慢性风湿性心脏病和先天性心脏病,恶性肿瘤、活动性自身免疫性疾病、活动性结核、腹膜透析/肾移植转为HD者、不同意行相关检查者。本研究符合医学伦理学标准,并经医院伦理委员会批准,研究对象均知情同意。
所有患者均使用贝朗Dialog+(710200T)血液透析机、聚砜膜透析器(膜面积1.6m2,一次性使用),血流量200~300 ml/min,碳酸氢盐透析液,透析液流量500 ml/min,低分子肝素抗凝,透析3次/周,4h/次。
临床资料收集及实验室指标测定对符合入选标准的患者,收集患者的年龄、身高、体重、透析龄、心血管病史、用药史、吸烟史、体质量指数(BMI)、透析前血压、超滤量、24h尿量等资料。实验室指标:血液常规分析、肝肾功能、血脂、电解质。所有入组者均在HD前当日清晨空腹采上肢静脉血,立即送本院检验科当日完成,生化指标采用德国Colab试剂盒,使用Bayer1650自动分析生化仪检测,并计算尿素清除指数(Kt/V)。
Tm及细胞因子检测Tm、白细胞介素1β(IL-1β)、IL-6及肿瘤坏死因子α(TNF-α)水平的测定均采用夹心酶联免疫吸附法(ELlSA)法,血液标本采集后,置3.8%EDTA 抗凝管中混匀,经3 500 r/min 离心15 min,分离血浆,尽量去除血小板,-80℃冰冻保存备用。所有标本在全部采集完后一次性检测。试剂盒为美国usen life公司产品,购自上海森珏公司,严格按照试剂盒说明步骤进行操作。在方法稳定后,所有标本均进行3 次ELISA检测,取平均值。
颈动脉彩超检查及分组颈动脉超声由本院超声科固定专人单盲检查,采用美国Philips Sonos 5彩色多普勒超声仪,探头频率为7~14 MHz。测量时患者取仰卧位,探头置于颈前部气管外侧,测量扫描图像中两条分别代表颈动脉腔内膜表面和外膜上层回声线前缘之间的垂直距离作为内膜中层厚度,于患者双侧颈总动脉分叉下方10 mm 处和颈总动脉的cIMT,如遇斑块则测量其下方的cIMT,计算两侧的平均值并记录。反复测量3 次,取平均值。此外依次探查颈总动脉、颈外动脉和颈内动脉斑块及数量。根据美国心脏病协会(AHA)标准,cIMT增厚定义为颈总动脉 IMT≥1.0 mm及(或)颈动脉分叉IMT≥1.2 mm;粥样斑块定义为局限性回声结构突入管腔(回声可不均匀或伴声影),厚度≥1.3 mm。
分组根据cIMT检测结果分为3组:无cIMT增厚组、轻度cIMT 增厚组、重度cIMT 增厚组。按照颈动脉斑块严重程度(颈动脉斑块平均值为1.87 mm,<1.87 mm为轻度增厚组,≥1.87 mm为重度增厚组)
新发CVD事件的定义所有患者自收集血样开始计时,随访12个月,记录随访期间所有新发生的CVD或原有CVD基础上的再发,观察3组患者的CVD事件发生率。新发CVD事件定义为[7]:充血性心力衰竭(根据临床表现判断为NYHA Ⅱ级以上)、心绞痛及心肌梗死或心源性猝死;经确诊的短暂性脑缺血发作(TIA)、脑梗塞。CVD死亡以患者的病史及死亡证明确认死亡事件及发生时间。随访12个月,期间每3个月对患者血常规及生化指标进行复查,以保证所有透析患者均达到充分透析。
统计学方法用SPSS17.0软件录入及统计数据。正态分布的计量资料采用均值±标准差描述,两组比较采用独立样本的t检验,多组比较采用方差分析,计数资料采用χ2检验;采用多元逐步回归分析cMIT与相关因素的关系。采用直线相关分析血栓调节蛋白与炎症因子、临床资料及生化指标之间的关系。用Logistic 回归分析建立心血管事件与cMIT及其他相关因素的回归方程,先进行单因素Logistic回归分析,变量引入水准设置为P<0.2,再采用前进法(基于最大似然估计)进行多因素Logistic回归,以P<0.05为差异有统计学意义。受试者工作特征(ROC)曲线分析cIMT、Tm对预测CVD的价值。
结 果
入组患者的基本资料108例MHD患者入选本研究,其中男68例,女40例,平均年龄57.28±11.38岁,平均透析龄53.58±22.15个月;原发病为:慢性肾小球肾炎57例,糖尿病肾病24例;高血压肾损害8例,尿酸性肾病4例,多囊肾3例,梗阻性肾病1例,狼疮性肾炎1例,慢性间质性肾炎4例,不明病因6例。
83例(76.9%)患者发现颈动脉AS;根据cIMT值分为:轻度cIMT增厚组(28 例)、重度cIMT增厚组(55例)、无cIMT 增厚组(25例)。三组间临床指标比较结果见表1。与无cIMT 增厚组比较,重度cIMT 增厚组Tm、C反应蛋白(CRP)、IL-1β、IL-6、TNF-α 水平较高,收缩压、年龄增高(P<0.05);与轻度cIMT 增厚组相比,重度cIMT增厚组Tm、 CRP、IL-6水平较高(P<0.05);IL-1β、TNF-α、收缩压方面无统计学差异;三组在性别构成比、吸烟、透析龄、Kt/V、血脂、血红蛋白、血清白蛋白等方面均无显著性差异。
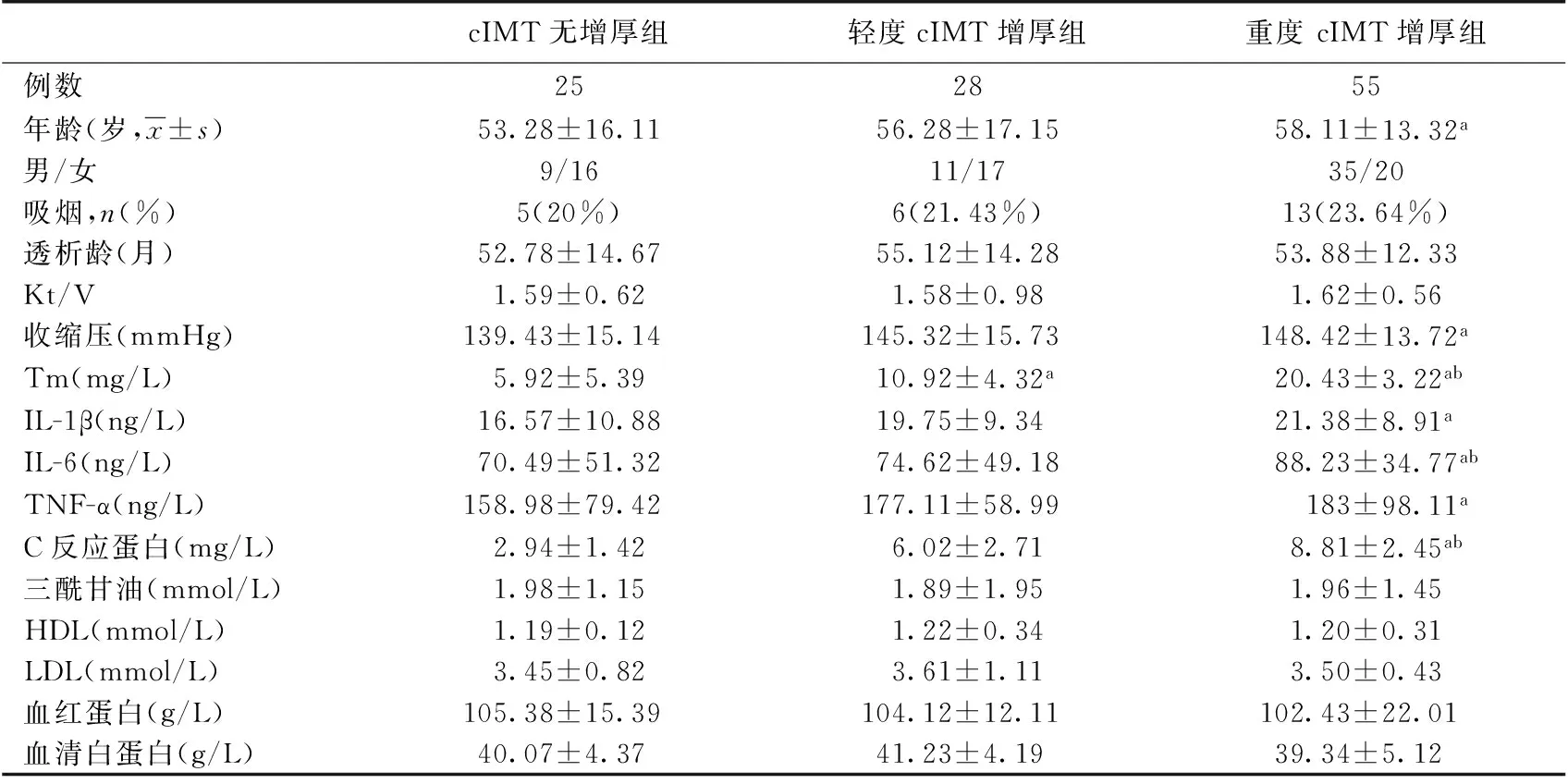
表1 三组患者的临床资料对比
cIMI:颈动脉内中膜厚度;Kt/V:尿素清除指数;Tm:血栓调节蛋白;IL:白细胞介素;TNF-α:肿瘤坏死因子α;HDL:高密度脂蛋白;LDL:低密度脂蛋白;a:与无cIMT 增厚组比较,P<0.05;b:与轻度cIMT 增厚组比较,P<0.05
cIMT相关危险因素分析根据多元逐步回归分析,将颈动脉AS的相关因素 (年龄、吸烟、收缩压、舒张压、总胆固醇、三酰甘油、低密度脂蛋白、高密度脂蛋白、Kt/V 、SCr 、Tm、CRP、IL-1β、IL-6、TNF-α)采用向前逐步法选择自变量,经混杂因素调整后,显示与cIMT 独立正相关的因素有2个,分别为Tm(β=0.620,t=5.858,P<0.001)与IL-6(β=0.25,t=2.36,P=0.022)。
Tm水平与炎症指标及血压的相关分析MHD患者的Tm水平与CRP(r=0.287,P=0.003 )、IL-1β(r=0.296,P=0.004 )、IL-6(r=0.328,P=0.001)、TNF-α(r=0.288,P=0.005)呈正相关;与收缩压(r=0.267,P=0.003)、舒张压(r=0.189,P=0.035 )呈正相关。
CVD事件的相关危险因素12个月随访期内,共发生CVD事件51例次,其中无cIMT 增厚组4例(16%),轻度cIMT增厚组9例(32.14%),均显著少于重度cIMT增厚组38例(69.09%),组间比较差异有统计学意义(P<0.01)。因心血管事件死亡重度cIMT增厚组7例(12.73%),轻度cIMT增厚组1例(3.57%),无cIMT增厚组1例(4%)。随访12个月后,与无cIMT增厚组及轻度cIMT增厚组比较,重度cIMT增厚组Tm、CRP水平仍较高,差异有统计学意义(P<0.05)。首先行单因素Logistic回归分析,变量引入水准设置为P<0.2,将年龄、收缩压、cMIT、Tm、血清白蛋白、CRP、IL-1β、IL-6列入Logistic 回归方程,再采用前进法(基于最大似然估计)进行多因素Logistic回归分析,结果显示:cIMT增厚(Wald值=7.639,OR=1.36,95%CI 1.467~9.258,P=0.019) 和Tm水平升高(Wald值=8.963,OR =1.04,95%CI 2.272~5.009,P=0.03)是CVD发生的独立危险因素。
ROC曲线分析使用 ROC 曲线分析,cIMT预测CVD的曲线下面积为(AUC)为0.866,95%CI 0.794~0.939,P=0.001,临界值为1.96 mm,灵敏度81.6%,特异度74.5%;Tm预测CVD的AUC为0.763,95%CI 0.6644~0.862,P=0.003,临界值为 18.635 mg/L,灵敏度79.6%,特异度68.2%(图1),提示cIMT及血浆Tm对CVD发生均有较高的预测价值。

图1 cIMT及血浆Tm预测CVD的ROC曲线图cIMT:颈动脉内中膜厚度;Tm:血栓调节蛋白;CVD:心血管疾病
讨 论
动脉粥样硬化性心血管病是导致MHD 患者死亡的主要原因。高血糖、高血压、高血脂等传统的危险因素并不能完全解释MHD 患者并发CVD的高发病率和死亡率。最近的研究表明血管内皮损伤或功能紊乱在AS发病过程可能起着关键作用,并贯穿于AS始终[8]。因此,检测内皮细胞功能及损伤程度对于判断AS的发展及预后至关重要。
Tm是一种结构类似于低密度脂蛋白受体的多节段跨膜糖蛋白,是凝血酶活化的受体和辅助因子,广泛分布于血管内皮上。研究证实血浆Tm浓度可作为判断血管内皮损伤的金标准[9]。相关研究显示,慢性肾脏病患者Tm水平普遍高于健康人群,Tm 水平与cIMT独立相关[10]。本研究结果亦显示,cIMT增厚组患者的血浆Tm水平显著高于无cIMT增厚组,与轻度cIMT 增厚患者相比,重度cIMT增厚患者血浆Tm水平显著升高;多元回归分析显示,在MHD患者中,血浆Tm水平与cIMT呈正相关,血浆Tm水平升高是促进cIMT增厚的危险因素。提示血管内皮损伤或功能紊乱在MHD患者AS的发病过程起着重要作用,随着血管内皮损伤加重,cIMT逐渐增厚,颈动脉斑块阳性率升高。由于颈动脉AS与心脑血管及全身周围血管AS程度平行,因此可以认为随着内皮损伤加重,全身AS程度加重。
由于透析膜和透析液的生物不相容性、透析液内毒素的污染、反复穿刺内瘘及中心静脉透析导管的留置等多种因素造成了MHD患者持续存在的多种炎症因子表达异常,主要表现为促炎症因子IL-1、IL-6、TNF-α等水平增高及抗炎症因子IL-10水平降低[11-12]。持续性的微炎症反应状态是MHD患者隐匿性存在的一种病理状态,是引起或加重内皮细胞损伤的重要原因[13]。在本研究中,重度cIMT增厚组患者的CRP、IL-1β、IL-6、TNF-α水平均高于其余两组;直线相关分析显示,血浆Tm水平与CRP、IL-1β、IL-6、TNF-α呈正相关,进一步说明了炎症与内皮细胞损伤互为因果,共同促进了AS-CVD的发生发展。此外,本研究中, MHD患者Tm水平、cIMT与收缩压正相关,说明透析患者普遍存在的高血压的血流动力学变化对靶器官的血管内皮损伤,可促进AS的发生与进展。
cIMT是反映动脉粥样硬化及血管疾病的早期而可靠的指标[14],cIMT也是一个心血管事件发生的强烈预测因子。近年来,cIMT逐渐应用于肾脏病领域,越来越多的研究显示cIMT是慢性肾脏病患者CVD的预测指标[15]。本研究入组的108例MHD患者中,cIMT增厚比例高达76.9%。12个月随访期内,共发生心血管事件51例次,无或轻度cIMT增厚组均少于重度cIMT增厚组。且本研究Logistic分析显示cIMT增厚和Tm水平升高是新发CVD事件的独立危险因素,表明发生CVD的患者动脉硬化的发生率明显较高,AS、血管内皮损伤与CVD的发生密切相关,进一步支持了上述观点。此外,本研究通过ROC 曲线分析提示cIMT对和Tm是预测CVD 敏感和特异性指标,表明cIMT及血浆Tm对CVD发生均有较好的预测价值。
综上所述, MHD患者体内微炎性反应状态与内皮细胞损伤互为因果,共同促进了AS的发生。cIMT 增厚和Tm水平升高是患者发生CVD的独立危险因素,其预测CVD的灵敏度、特异度较好,可作为MHD患者CVD的预测指标。但本研究是单中心的临床研究,随访时间相对较短,可能对患者的预后判断有一定影响,尤其Tm的水平在MHD患者中的临床意义和价值尚待更大规模的临床研究来进一步探讨。
1蒲蕾,洪大情,何强,等.维持性血液透析患者住院及死亡事件分析.中国血液净化,2013,12(2):107-109.
2Nishizawa Y,Shoji T,Maekawa K,et al.Intima-media thickness of carotid artery predicts cardiovascular mortality in hemodialysis patients.Am J Kidney Dis,2003,41(3 Suppl 1):S76-79.
3Ito T,Maruyama I.Thrombomodulin: protectorate God of the vasculature in thrombosis and inflammation.J Thromb Haemost,2011,9(Suppl 1):168-173.
4Strijbos MH,Rao C,Schmitz PI,et al.Correlation between circulating endothelial cell counts and plasma thrombomodulin levels as markers for endothelial damage.Thromb Haemost,2008,100(4):642-647.
5Chao TH,Tsai WC,Chen JY,et al.Soluble thrombomodulin is a paracrine anti-apoptotic factor for vascular endothelial protection.Int J Cardiol,2014,172(2):340-349.
6李聪.炎症在维持性血液透析患者血管内皮损伤中作用及抗炎治疗.中国血液净化,2011,10(2):100-104.
7Jespersen L,Hvelplund A,Abildstrøm SZ,et al.Stable angina pectoris with no obstructive coronary artery disease is associated with increased risks of major adverse cardiovascular events.Eur Heart J,2012,33(6):734-744.
8Landmesser U,Hornig B,Drexler H.Endothelial function: a critical determinant in atherosclerosis?.Circulation,2004,109(21 Suppl 1):1127-1133.
9Blann AD,Taberner DA.A reliable marker of endothelial cell dysfunction: does it exist?.Br J Haematol,1995,90(2):244-248.
10 李忠心,陈向东,孟娟,等.慢性肾脏病患者血栓调节蛋白与动脉粥样硬化的相关性.中华肾脏病杂志,2011,27(8):581-584.
11 Schouten WE,Grooteman MP,van Houte AJ,et al.Effects of dialyser and dialysate on the acute phase reaction in clinical bicarbonate dialysis.Nephrol Dial Transplant,2000,15(3):379-384.
12 Goldstein SL,Leung JC,Silverstein DM.Pro- and anti-inflammatory cytokines in chronic pediatric dialysis patients: effect of aspirin.Clin J Am Soc Nephrol,2006,1(5):979-986.
13 Goldberg RB.Cytokine and cytokine-like inflammation markers,endothelial dysfunction,and imbalanced coagulation in development of diabetes and its complications.J Clin Endocrinol Metab,2009,94(9):3171-3182.
14 de Groot E,van Leuven SI,Duivenvoorden R,et al.Measurement of carotid intima-media thickness to assess progression and regression of atherosclerosis.Nat Clin Pract Cardiovasc Med,2008,5(5):280-288.
15 梁剑波,区景运,王泽彬,等.腹膜透析患者颈动脉钙化与胎球蛋白A及C反应蛋白的关系及对心血管事件的影响.中华肾脏病杂志,2013,29(8):569-573.

