肾单位损伤后的再生修复机制
汤 雄 张 炯 综述 王金泉 审校
在哺乳动物中,后肾在中胚层的中部形成,通过分支尿囊的复杂相互作用,周围间充质细胞形成了成熟肾单位中所有的上皮细胞群。这些细胞群通过相互作用、诱导的过程以促进器官形成[1]。间充质细胞除了形成肾脏小管上皮细胞外,也形成周围间质(包括周细胞)和相当比例的内皮细胞群,后者将形成肾脏的脉管系统。虽然最后形成的独立肾单位是由功能类型不同的细胞构成,但是细胞示踪研究显示,这些不同类型的细胞都是来自单一的祖细胞群,即表达SIX2基因的后肾间充质细胞亚群,其细胞表面存在同源异质盒蛋白SIX2,这群细胞在出生后的肾脏中并不表达,提示正常情况下人类发育成熟的后肾不再新生肾单位[2]。与人类相似,啮齿类动物间充质细胞在最终分化完成后,新生肾单位形成在围生期一周内停止[3]。然而,目前调控肾单位形成、终止的关键分子机制仍不清楚。
肾单位祖细胞群的消失限制了后天肾脏的再生,实际上哺乳动物后天肾脏在急性肾损伤(AKI)时仍可见细胞再生修复过程。不仅如此,在人类肾组织和啮齿类动物模型中均发现肾小球内存在足细胞损伤后再生修复的现象。在过去的二十多年,研究者们持续深入地探索这种损伤反应的机制。目前认为,AKI和足细胞疾病会引发肾小管上皮细胞和足细胞损伤,并出现周围上皮细胞快速增生反应,这种增生能力来源于后肾残存的祖细胞亚群,还是来源于成熟上皮细胞对于损伤的反应,仍是一个悬而未决的问题。为此,本文回顾近年来在肾脏祖细胞和上皮细胞增殖分化方面的基础研究成果,探讨不同细胞亚群在肾单位中,尤其是肾小管上皮细胞和肾小球足细胞损伤后的再生修复过程。
肾小管上皮细胞损伤后修复过程
通过小鼠肾脏缺血再灌注模型(IRI),研究者在啮齿类动物研究中发现,与人类相似,实验动物IRI后肾功能快速下降,伴随近端小管刷状缘脱落、炎症细胞浸润及蛋白管型形成。在损伤后最初的24~48h肾小管上皮细胞出现明显增生, 5~7d后肾小管上皮细胞组织形态基本恢复正常[4]。IRI模型对损伤反应的病理改变可分为四个阶段(图1)[5]。在AKI最初的应激反应阶段,上皮细胞出现程序性凋亡(necroptosis),失巢凋亡(anoikis),细胞自噬(autophagic cell death)和细胞焦亡(pyroptosis)[6-8](图1);第二阶段以小管上皮细胞扁平化和去分化,同时合并波形蛋白(vimentin)的上调和正常小管上皮形态的消失为特征;第三阶段是上皮显著增生和生长因子的表达,包括胰岛素样生长因子1(IGF-1),肝细胞生长因子(HGF),成纤维细胞生长因子(FGF)等;第四阶段,上皮细胞正常组织学形态基本恢复。在大部分AKI动物模型中,肾小管形态正常化和炎症反应消失都是在一周内完成,但是,尚无研究能够明确哪些是损伤后残存的上皮细胞,哪些是修复后新生的细胞。

图1 急性肾损伤过程中肾小管上皮细胞修复过程[5]①:对于缺氧或者毒物相关急性肾损伤,肾小管上皮细胞发生程序性凋亡,失巢凋亡,细胞自噬和细胞焦亡;②:残存的细胞开始扁平化并展现去分化特征,表达波形蛋白,同时E钙黏蛋白阳性;③:余下的小管上皮细胞开始了快速、完全的增殖修复过程。近来,研究发现这一过程与小管上皮细胞Sox9的阳性表达有关,并出现在PAX2、Wnt信号通路及Notch信号通路激活之前;④:上皮细胞重获极性,恢复正常组织形态特征后再次进入静止期
传统观点认为,成熟肾小管上皮细胞增生能力较弱[9]。近端小管S3段是最初细胞增生反应最活跃的区域,其上皮细胞增生细胞核抗原(PCNA)阳性,也表达vimentin,证明在损伤反应中存在上皮细胞向间充质细胞去分化细胞活动[10]。但也有研究认为去分化细胞是一群祖细胞,表达祖细胞和干细胞标志物,在上皮细胞受损后去分化增生[11]。近端肾小管S3段中有约40%的上皮细胞处于G1期而非G0期,因此能够迅速由静止期重新进入细胞增殖周期[11],而通过细胞示踪分析技术,显示了只有来源于SIX2阳性的肾小管祖细胞能够参与损伤修复过程[12]。
CD133+和CD24+这两种标志物被认作是干/祖细胞群状态的指示,研究者最初正是通过发现CD133+和CD24+细胞在成人肾小管上皮细胞中证实了存在肾脏祖细胞亚群(renal progenitor cells,RPCs)[13]。RPCs属于肾脏发育过程中存在的一类细胞,尽管这些RPCs不能够重新开始完整肾单位的发育进程,但能够在AKI中上调Notch信号活性,由此可向足细胞亚群进行分化[14-15]。同时,研究人员也在RPCs细胞亚群中证实发育标志物配对盒基因2(PAX2)阳性,表明RPCs的确是后天肾脏中残存的肾小管祖细胞亚群[16]。
细胞示踪分析技术可对啮齿类动物后天肾脏中促进肾小管修复细胞亚群进行准确定位和明确细胞类型。Rinkevich等证实在肾小球及小管部分节段存在特异性祖细胞[17]。应用细胞示踪标记单个细胞,证实存在细胞亚群的克隆扩增和持续特异性、节段性的肾小管修复。由于标记单个细胞并未促进邻近区域节段小管修复,表明存在节段特异性祖细胞群。这项研究与先前的另一项研究——节段限制性肾祖细胞亚群(segment-restricted renal progenitors,SGRPs)能够原位细胞再生替代相一致,但这些研究仍不能否定成熟上皮细胞再次进入细胞周期克隆扩增完成小管修复的假说。这些研究也证明了上皮细胞的增生反应部分由经典Wnt信号通路介导,这一信号通路也介导了肾脏发育过程中上皮细胞的增殖过程[18]。一旦肾脏发育完成,Wnt和Notch信号通路均关闭[19]。
目前关于RPCs特性研究主要集中于小鼠,而人类肾小管损伤修复过程是否由肾小管中稳定存在的祖细胞亚群对损伤进行反应尚无定论。造成这一现象的原因部分由于人类与小鼠细胞标志物表型不同,小鼠品系RPCs中并没有CD24这一表面抗原。近来在正常人类肾小管上皮细胞中发现存在散在CD24+肾小管细胞亚群(scattered tubular cells,STCs)[20]。STCs与其他肾小管上皮细胞还存在形态学上的差异,STCs呈扁平细胞形态和上皮极性缺失,类似于上皮细胞对损害反应的去分化状态。因此,STCs可能代表人类RPCs,支持了在人类肾脏中存在稳定祖细胞亚群的假说,电镜扫描进一步确认在没有损伤情况下人类肾脏存在STCs[20]。
肾小球足细胞损伤后修复过程
肾小球滤过屏障由内皮细胞、肾小球基膜和足细胞组成,其任一结构的损伤和缺失都可导致蛋白尿。系膜细胞和内皮细胞的损伤可被邻近细胞增生所修复。Wharram 等[21]通过向足细胞特异性表达人白喉毒素受体的转基因大鼠腹腔注射白喉毒素构建剂量依赖性足细胞丢失的模型,发现足细胞丢失可导致肾小球硬化,当足细胞丢失<20% ,肾小球系膜增生,出现一过性的蛋白尿;足细胞丢失在20%~40%时,肾小球系膜增生、球囊黏连,出现局灶节段性硬化,产生持续性微量蛋白尿;当足细胞丢失>40%时,肾小球硬化,产生持续性大量蛋白尿,同时伴肾功能的减退。众多以细胞示踪技术为基础的研究表明,足细胞面对损伤时的可逆性修复来自壁细胞和近球复合体产生肾素的细胞[22-24]。
Ronconi等[25]通过对干细胞表面标记分子CD133和CD24的筛选发现,在成人肾脏包囊壁上精密排列着由CD133+CD24+细胞组成的肾脏前体细胞,这些细胞拥有不同的分化和再生潜能。进一步研究发现壁层上皮细胞包括三种细胞类型,位于尿极的肾脏前体细胞表达CD133和CD24,但缺乏足细胞标志PDX,简称CD133+CD24+PDX-,这群细胞可进一步分化为肾小管上皮细胞和足细胞;位于血管极的壁层上皮细胞为分化的足细胞,不表达CD133和CD24, 但表达PDX,简称CD133-CD24-PDX+;而在尿极和血管极之间的细胞为过渡细胞群,既表达前体细胞表面标志CD133和CD24,也表达足细胞标志PDX,简称CD133+CD24+PDX+。过渡细胞在免疫组化特征上具备壁层上皮细胞和足细胞的特征,研究者通过使用基因标记转基因动物模型壁层上皮细胞,发现足细胞的再生来源于壁层上皮细胞,壁层上皮细胞由尿极向血管极分化,最终形成新的足细胞。而Pippin等[26]发现,在小鼠FSGS模型,硬化肾小球的球旁器肾素分泌细胞呈增生趋势,肾素分泌细胞可迁移至肾小球毛细血管袢的足细胞及包囊的壁层上皮细胞所在位置,并表达足细胞分泌的WT-1和synaptopodin,以及壁层上皮细胞分泌蛋白PAX2和claudin 1。该研究显示,肾素分泌细胞具备分化为肾小球上皮细胞(足细胞和壁层上皮细胞)的潜在可能性,但其如何分化为足细胞的确切机制仍需要进一步研究。
肾单位修复的关键信号通路
近年来,研究者详细研究了肾脏损伤后修复过程中的Wnt和Notch信号通路。Notch信号通路在血管发育、基质成熟、集合管形成和肾单位分隔、独立中发挥了重要作用,尤其促进了近端小管和肾小球的结构成熟。Wnt信号通路则启动了间充质细胞向上皮细胞转分化继而促进了肾单位的形成[27]。Wnt和Notch信号通路在AKI中激活,缺乏Wnt共受体的Lrp5/6小鼠对AKI更加敏感,而肾小管上皮细胞β链蛋白(β-catenin)敲除后也会导致相同的结果[28]。在大鼠IRI模型中,近端肾小管上皮细胞的Wnt4的表达与细胞增生相关,Wnt4或β-catenin在小管细胞系(LLC-PK1)过表达均可促进小管上皮细胞的增生[29]。Notch在AKI发生后修复进程中的扮演的角色则并不清楚。目前有学者认为在损伤反应中Notch信号通路激活支持了修复是由干细胞/祖细胞所介导进程的结果[30],也有学者发现Notch2信号通路在IRI中激活而在γ分泌酶作用下失活,后者在延缓恢复的通路中活性上调[31]。
作为最广泛的发育因子,Sox9在大部分组织尤其是受损肾脏的肾小管上皮细胞中上调最为明显[32-33]。Kumar等[32]进一步的研究发现,Sox9上调先于目前公认的肾脏损伤标记物Lcn2(Ngal)和Kim1上调,表明Sox9在损伤反应阶段早期扮演非常重要的角色。Sox9与血清肌酐水平同样在IRI后24~48h达峰值,当血清肌酐恢复正常时,Sox9的表达上升仍会持续28d左右。细胞示踪技术显示在肾小管损伤上皮过程中,Sox9+细胞主要促进近端小管末端和髓袢的修复,也有少量Sox9+细胞存在于远端小管,而在Sox9+小管上皮中有40%表现出了增殖特性。在肾小管恢复正常上皮细胞组织形态后Sox9基因表达可持续很长时间(图2)。
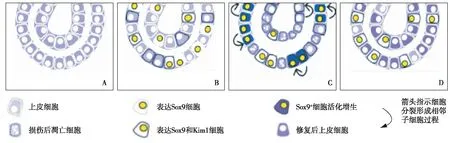
图2 肾脏损伤中Sox9+细胞修复过程[32]A:损伤发生前,肾小管上皮细胞并不表达Sox9和Kim1;B:损伤发生后(UUO或IRI模型),Sox9(黄色细胞核)表达快速上调,先于Kim1的表达(黑色细胞膜);C:Sox9表达在24~48h达顶峰,与血清肌酐水平及凋亡细胞数目达峰时间一致,接近40%的Sox9+细胞表现出了增殖特性(深蓝色细胞质);D:在血清肌酐恢复正常后,Sox9+表达水平升高仍将持续28d左右
小结:探索肾脏损伤后的修复机制,明确肾脏祖细胞的存在和增殖方式,以及固有细胞的增殖能力,对于理解肾单位损伤后修复过程,研究可调控的主要信号通路靶点具有重要意义。未来随着细胞示踪技术和分子机制的进一步研究,有助于发现肾小管上皮细胞和肾小球足细胞损伤后的不同修复机制和细胞来源,从细胞修复和组织再生角度,给急慢性肾脏病的治疗提供新的干预靶点。
1Little MH,McMahon AP.Mammalian kidney development: principles,progress,and projections.Cold Spring Harb Perspect Biol,2012,4(5): pii: a008300.
2Kobayashi A,Valerius MT,Mugford JW,et al.Six2 defines and regulates a multipotent self-renewing nephron progenitor population throughout mammalian kidney development.Cell Stem Cell,2008,3(2):169-181.
3Hinchliffe SA,Sargent PH,Howard CV,et al.Human intrauterine renal growth expressed in absolute number of glomeruli assessed by the disector method and Cavalieri principle.Lab Invest,1991,64(6):777-784.
4Wei Q,Dong Z.Mouse model of ischemic acute kidney injury: technical notes and tricks.Am J Physiol Renal Physiol,2012,303(11):F1487-1494.
5Devarajan P,Mishra J,Supavekin S,et al.Gene expression in early ischemic renal injury: clues towards pathogenesis,biomarker discovery,and novel therapeutics.Mol Genet Metab,2003,80(4):365-376.
6Linkermann A,Bräsen JH,Himmerkus N,et al.Rip1 (receptor-interacting protein kinase 1) mediates necroptosis and contributes to renal ischemia/reperfusion injury.Kidney Int,2012,81(8):751-761.
7Sancho-Martínez SM,López-Novoa JM,López-Hernández FJ.Pathophysiological role of different tubular epithelial cell death modes in acute kidney injury.Clin Kidney J,2015,8(5):548-559.
8Wang S,Zhang C,Hu L,et al.Necroptosis in acute kidney injury: a shedding light.Cell Death Dis,2016,7:e2125.
9Lombardi D,Becherucci F,Romagnani P.How much can the tubule regenerate and who does it? An open question.Nephrol Dial Transplant,2016,31(8):1243-1250.
10 Witzgall R,Brown D,Schwarz C,et al.Localization of proliferating cell nuclear antigen,vimentin,c-Fos,and clusterin in the postischemic kidney.Evidence for a heterogenous genetic response among nephron segments,and a large pool of mitotically active and dedifferentiated cells.J Clin Invest,1994,93(5):2175-2188.
11 Vogetseder A,Picard N,Gaspert A,et al.Proliferation capacity of the renal proximal tubule involves the bulk of differentiated epithelial cells.Am J Physiol Cell Physiol,2008,294(1):C22-28.
12 Humphreys BD,Czerniak S,DiRocco DP,et al.Repair of injured proximal tubule does not involve specialized progenitors.Proc Natl Acad Sci U S A,2011,108(22): 9226-9231.
13 Romagnani P.Toward the identification of a “renopoietic system”? Stem Cells,2009,27(9): 2247-2253.
14 Angelotti ML,Ronconi E,Ballerini L,et al.Characterization of renal progenitors committed toward tubular lineage and their regenerative potential in renal tubular injury.Stem Cells,2012,30(8):1714-1725.
15 Ronconi E,Sagrinati C,Angelotti ML,et al.Regeneration of glomerular podocytes by human renal progenitors.J Am Soc Nephrol,2009,20(2):322-332.
16 Romagnani P,Anders HJ.What can tubular progenitor cultures teach us about kidney regeneration? Kidney Int,2013,83(3):351-353.
17 Rinkevich Y,Montoro DT,Contreras-Trujillo H,et al.In vivo clonal analysis reveals lineage-restricted progenitor characteristics in mammalian kidney development,maintenance,and regeneration.Cell Rep,2014,7(4):1270-1283.
18 Kato H,Susztak K.Repair problems in podocytes: Wnt,Notch,and glomerulosclerosis.Semin Nephrol,2012,32(4):350-356.
19 Costantini F.Genetic controls and cellular behaviors in branching morphogenesis of the renal collecting system.Wiley Interdiscip Rev Dev Biol,2012,1(5):693-713.
20 Smeets B,Boor P,Dijkman H,et al.Proximal tubular cells contain a pheno typically distinct,scattered cell population involved in tubular regeneration.J Pathol,2013,229(5): 645-659.
21 Wharram BL,Goyal M,Wiggins JE,et al.Podocyte depletion causes glomerulosclerosis: diphtheria toxin-induced podocyte depletion in rats expressing human diphtheria toxin receptor transgene.J Am Soc Nephrol,2005,16(10):2941-2952.
22 Pippin JW,Kaverina NV,Eng DG,et al.Cells of renin lineage are adult pluripotent progenitors in experimental glomerular disease.Am J Physiol Renal Physiol,2015,309(4):F341-358.
23 Kaverina NV,Eng DG,Schneider RR,et al.Partial podocyte replenishment in experimental FSGS derives from nonpodocyte sources.Am J Physiol Renal Physiol,2016,310(11):F1397-1413.
24 Lasagni L,Angelotti ML,Ronconi E,et al.Podocyte Regeneration Driven by Renal Progenitors Determines Glomerular Disease Remission and Can Be Pharmacologically Enhanced.Stem Cell Reports,2015,5(2):248-263.
25 Ronconi E,Sagrinati C,Angelotti ML,et al.Regeneration of glomerular podocytes by human renal progenitors.J Am Soc Nephrol,2009,20(2):322-332.
26 Pippin JW,Sparks MA,Glenn ST,et al.Cells of renin lineage are progenitors of podocytes and parietal epithelial cells in experimental glomerular disease.Am J Pathol,2013,183(2):542-557.
27 Zhou T,Benda C,Dunzinger S,et al.Generation of human induced pluripotent stem cells from urine samples.Nat Protoc,2012,7(12):2080-2089.
28 Terada Y,Tanaka H,Okado T,et al.Expression and function of the developmental gene Wnt-4 during experimental acute renal failure in rats.J Am Soc Nephrol,2003,14(5):1223-1233.
29 Lasagni L,Romagnani P.Glomerular epithelial stem cells: the good,the bad,and the ugly.J Am Soc Nephrol,2010,21(10):1612-1619.
30 Sörensen-Zender I,Rong S,Susnik N,et al.Renal tubular Notch signaling triggers a prosenescent state after acute kidney injury.Am J Physiol Renal Physiol,2014,306(8):F907-915.
31 Liu J,Krautzberger AM,Sui SH,et al.Cell-specific translational profiling in acute kidney injury.J Clin Invest,2014,124(3):1242-1254.
32 Kumar S,Liu J,Pang P,et al.Sox9 Activation Highlights a Cellular Pathway of Renal Repair in the Acutely Injured Mammalian Kidney.Cell Rep,2015,12(8):1325-1338.
33 Kang HM,Huang S,Reidy K,et al.Sox9-Positive Progenitor Cells Play a Key Role in Renal Tubule Epithelial Regeneration in Mice.Cell Rep,2016,14(4):861-871.

