利妥昔单抗用于难治性狼疮性肾炎的治疗
李慧娟 陈樱花 胡伟新
病史摘要
37岁女性患者,因“水肿伴蛋白尿二十余天”,于2008-02-20收住入院。
患者于2008-02-01无明显诱因出现面部及双下肢水肿,下肢水肿呈凹陷性。当地医院查尿蛋白定量3.84 g/24h,尿红细胞阴性,血清白蛋白(Alb)15.6 g/L,血清ANA阳性,ds-DNA阴性,C3 0.84 g/L(参考值0.88~2.01 g/L),C4正常。给予泼尼松60 mg治疗一周,水肿消退,Alb升至21.6 g/L,尿蛋白仍+++。起病前患者无面部红斑、关节痛、脱发、光过敏及口腔溃疡等症状。
患者既往史、个人史、家族史无特殊。
入院检查体温36.9℃,脉搏80次/min,呼吸18次/min,血压130/85 mmHg,全身皮肤无皮疹,心肺腹部检查无异常,双下肢无水肿。
尿液检查尿蛋白10.37 g/24h,无红细胞,尿NAG酶31 U/(g·Cr),RBP 0.27 mg/L。禁水13 h尿渗量1 058 mOsm/(kg·H2O)。
血常规血红蛋白128 g/L,白细胞5.4×109/L,血小板 257×109/L,C反应蛋白<3.2 mg/L。
血生化白蛋白33.1 g/L,球蛋白28.6 g/L,谷丙转氨酶20 U/L,谷草转氨酶19 U/L,尿素氮6.68 mmol/L,血清肌酐42.43 μmol/L,尿酸242 μmol/L,胆固醇8.64 mmol/L,三酰甘油 1.02 mmol/L。
血清学ANA1∶ 1 024,ds-DNA阴性,抗SS-A+,抗SS-B++,补体C3 1.0 g/L,C4 0.2 g/L。IgG 13 g/L,IgA 2.59 g/L,IgM 1.49 g/L。外周血淋巴细胞:CD3 552个/μl,CD4 302个/μl,CD8 242 个/μl,CD19 95个/μl,CD20 94个/ul。HBsAg、HCV抗体均阴性。
辅助检查双肾B超示左肾:106 mm×45 mm×52 mm,右肾:103 mm×42 mm×48 mm,皮质回声正常。心电图示窦性心动过速。
肾活检病理
光镜30个肾小球中2个球性硬化,其余正切肾小球体积略增大,足细胞肿胀,少数节段系膜区轻度增宽(图1A),血管袢开放好,一个肾小球节段袢扭曲皱缩状,偶见内皮细胞成对,囊壁增厚分层。PASM-Masson:阴性。肾小管基本正常,见颗粒变性,少数管腔见蛋白管型,间质散在单个核细胞浸润。小动脉未见明显病变。
免疫荧光免疫球蛋白及补体染色均阴性。
电镜检查毛细血管袢开放欠佳,基膜厚约270~510 nm,足细胞胞质密度减低,有的胞膜破裂,胞质成分外溢。足细胞足突融合范围约85%,多处足突可见剥离,基膜裸露(图1B、C)。基膜无分层,系膜区、内皮下、上皮侧无电子致密物沉积。近端小管上皮细胞胞质内见致密的溶酶体。
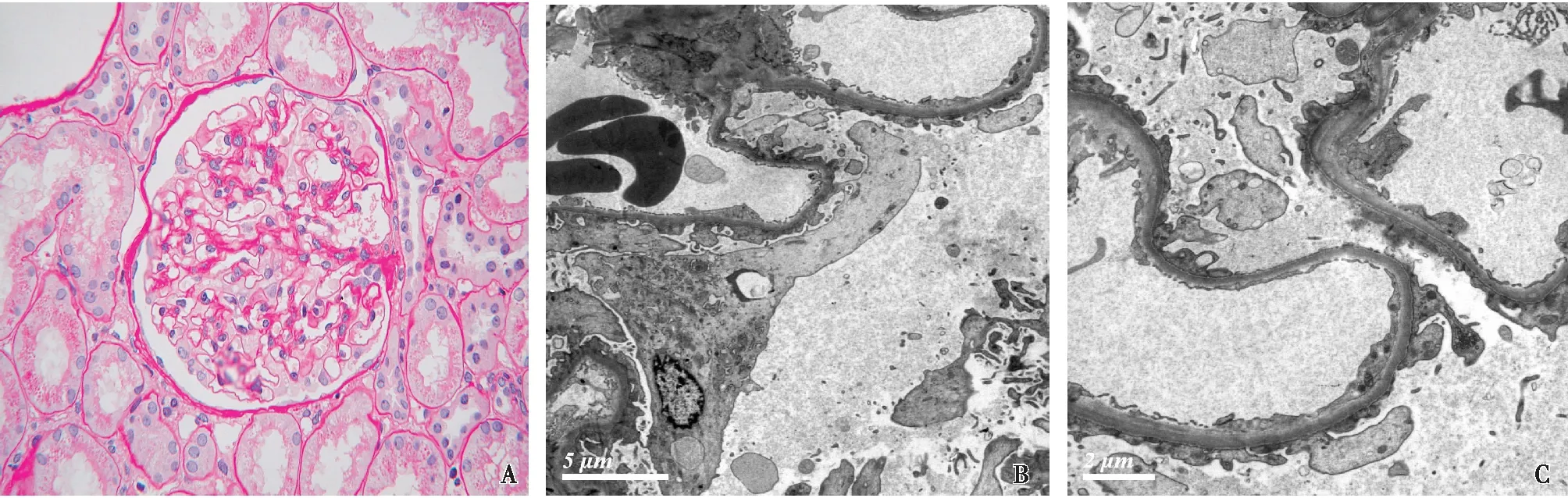
图1 患者首次肾活检病理改变A:肾小球轻度系膜增生性改变(PAS,×400);B、C:肾小球足细胞足突融合约85%,系膜区及基膜上、内皮下均未见电子致密物(EM)
治疗及随访情况自身免疫性疾病诊断依据不足,肾活检后考虑“微小病变肾病”,予足量泼尼松50 mg/d治疗1月,2008年4月尿检转阴,Alb水平正常。此后泼尼松逐渐减量,每半月减5 mg,2008年6月泼尼松减量至25 mg/d时患者再次出现水肿,蛋白尿增加至9.02 g/d,Alb降至22 g/L。泼尼松加量至60 mg/d重新诱导治疗2月,尿蛋白无减少。2008年10月泼尼松逐渐减量至30 mg/d开始联合吗替麦考酚酯(MMF)1.0 g/d治疗3月,尿蛋白有所下降,Alb 28.9 g/L。
2009年1月患者出现面部蝶形红斑,伴腕关节、肘关节疼痛。查尿蛋白升至3.15 g/24h,Alb 27 g/L,ANA 1∶ 128,A-dsDNA阴性,补体正常,诊断系统性红斑狼疮(SLE),狼疮性肾炎(LN)。重复肾活检病理示局灶节段性肾小球硬化(图2A),肾小球仍无免疫球蛋白,C3小管基膜阳性(图2B)和补体沉积,电镜示肾小球足突广泛融合,融合范围约85%(图2C),肾小球系膜区和血管袢均无电子致密物沉积。诱导方案调整为多靶点疗法[泼尼松30 mg/d、MMF(0.75~1 g/d)及他克莫司(FK506 3 mg/d)]诱导治疗,2月后尿蛋白转阴性。2009年8月泼尼松减量至15 mg/d,肾病综合征再次复发,重新泼尼松加量到30 mg/d并联合FK506(2~3 mg/d),以雷公藤多苷(TW,60 mg/d)替换MMF。治疗1月尿蛋白再次转阴。此后,患者泼尼松只要减量至10~20 mg/d,即使联合其他免疫抑制剂治疗,仍出现复发,总计复发8次(图3)。在上述治疗期间,患者出现多种合并症:2014年并发“肺结核”,予抗结核治疗9月后痊愈;2015年出现带状疱疹,予抗病毒治疗后遗留严重神经痛;同年并发“类固醇性糖尿病”和“双眼增殖性视网膜剥离”及反复肺部感染和尿路感染。
患者表现为激素依赖肾病综合征,由于并发症无法使用较大剂量激素,2015-06-17给予利妥昔单抗600 mg(RTX,375 mg/m2)静滴,RTX治疗第2天外周血CD20+淋巴细胞降至3个/μl,泼尼松减量至10 mg/d,同时联合他克莫司2 mg/d维持治疗,期间CD20+淋巴细胞控制在2~11个/μl。9个月后再次给予RTX 600 mg(375 mg/m2)静滴,并停用他克莫司,单予泼尼松5 mg/d维持。2017-05-04予以第3次RTX(100 mg)治疗。迄今随访24个月,蛋白尿持续阴性,肾功能、血浆白蛋白正常,无狼疮活动(图4)。
最后诊断系统性红斑狼疮,狼疮足细胞病。
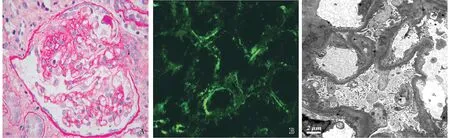
图2 患者重复肾活检病理改变A:肾小球节段硬化(PAS,×400);B:C3肾小管基膜阳性(IF,×400);C:肾小球足细胞足突融合约85%,内皮下及上皮侧未见致密物沉积(EM)
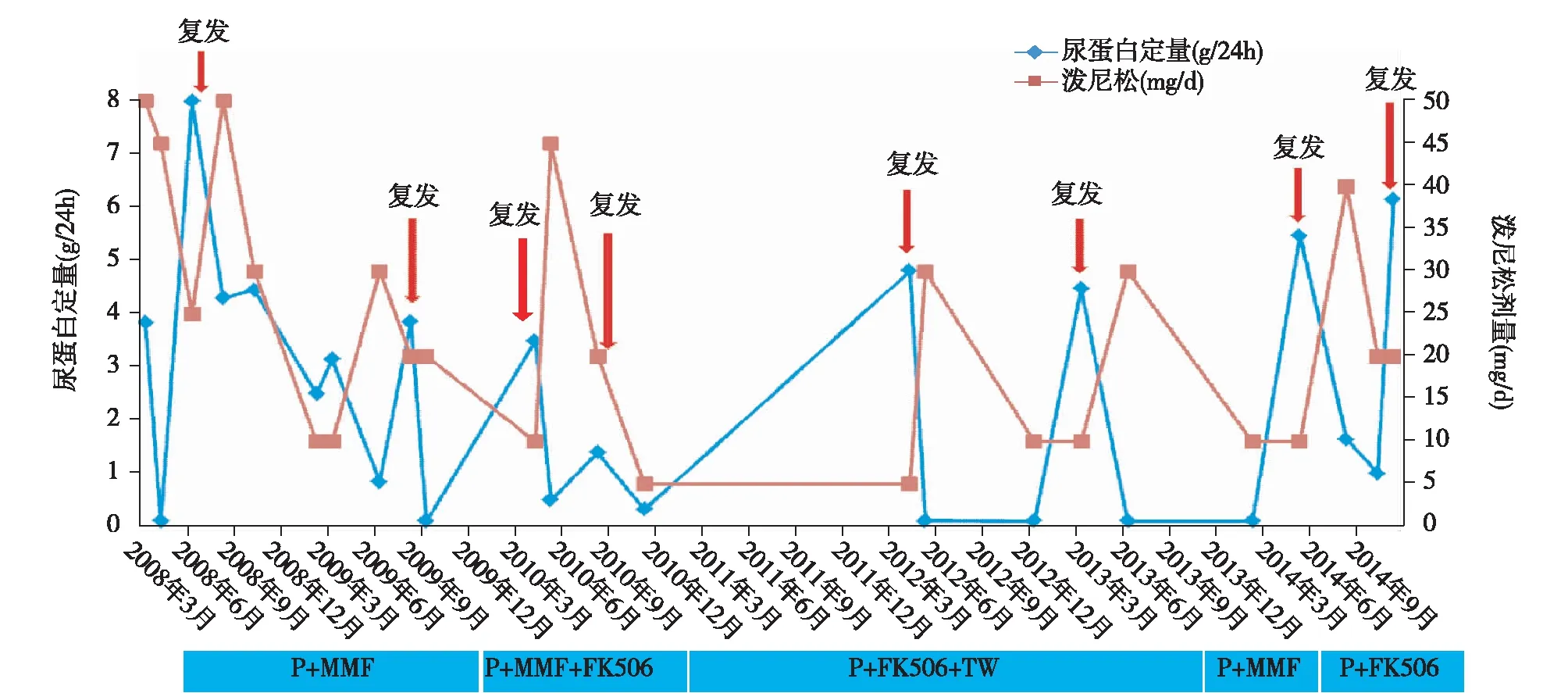
图3 随访过程中激素及免疫抑制剂使用情况(泼尼松减量至10~20 mg,复发8次)P:泼尼松;MMF:吗替麦考酚酯;FK506:他克莫司;TW:雷公藤多苷
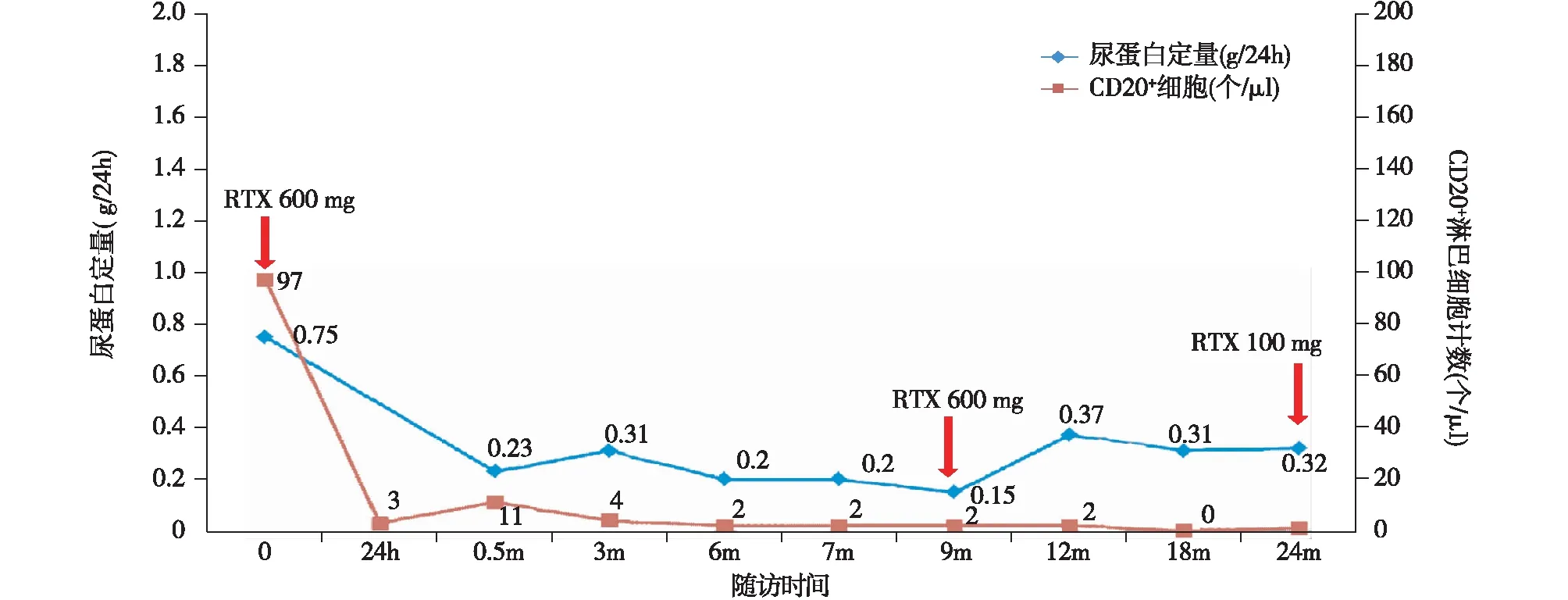
图4 利妥昔单抗(RTX)治疗后蛋白尿及外周血CD20+细胞计数变化
讨 论
狼疮足细胞的诊断青年女性患者,以肾病综合症起病,首次肾活检光镜提示肾小球轻度系膜增生,免疫荧光和电镜检查肾小球均无免疫沉积物,电镜见肾小球足细胞足突广泛融合(85%)。起初诊断为微小病变肾病,肾病综合征复发后出现面部典型蝶形红斑和多发关节炎,结合血清自身抗体阳性,最后修订诊断为“SLE,狼疮足细胞病”。
肾病综合征是狼疮足细胞病最主要的临床表现,半数以上患者以肾脏损害为首发症状就诊,极少数病例起病初可无明显肾外表现,仅出现抗核抗体(ANA)阳性,在肾脏疾病复发时才出现典型的 SLE 肾外器官损伤。本例患者早期以肾病综合症伴ANA阳性起病,无明显肾外表现,免疫荧光无免疫球蛋白及补体沉积,因早期症状不典型没有诊断为系统性红斑狼疮和狼疮足细胞病,出现漏诊。在治疗过程中出现面部红斑、关节疼痛等肾外表现才诊断为狼疮足细胞病。因此对于肾病综合症伴自身抗体阳性的年轻女性患者,应警惕不典型系统性红斑狼疮。
狼疮足细胞病肾活检光镜下肾小球形态学改变可表现为微小病变(MCD)、系膜增生性病变(MsP)或局灶节段肾小球硬化(FSGS)[1-2],绝大多数病例免疫荧光检查可见免疫球蛋白及补体沉积于肾小球系膜区,少部分可仅有免疫球蛋白沉积,或无免疫球蛋白及补体沉积。约1/3患者肾小管上皮细胞胞质可见免疫球蛋白和补体沉积,表现为 FSGS 者肾小管免疫复合物沉积的比例显著高于 MCD 或 MsP。本例患者第一次肾活检组织学形态为MsP,免疫荧光无免疫球蛋白沉积。第二次肾活检组织形态学光镜表现FSGS时,可见C3小管基膜节段阳性分布。
电镜检查是诊断狼疮足细胞病的关键。狼疮足细胞病电镜下最突出的的形态学特征为足细胞足突广泛融合,融合范围可达100%,绝大多数在70%以上,绝大多数系膜区可见电子致密物沉积,毛细血管袢内皮下及上皮侧均无明显电子致密物沉积,但可见散在孤立性电子致密物,少数患者肾小球无致密物沉积,与免疫荧光及光镜下无免疫复合物沉积一致。虽然绝大多数狼疮足细胞病存在系膜区免疫复合物,但足细胞病变的发生与系膜区免疫复合物沉积无关。因此,少数狼疮足细胞病患者肾小球系膜区可无免疫复合物沉积。本例患者两次肾活检肾小球均无免疫球蛋白和补体沉积,电镜下足细胞足突广泛融合,融合范围约85%。结合本例患者的临床和病理特点符合狼疮足细胞病的诊断。
狼疮足细胞的治疗绝大多数狼疮足细胞病激素治疗敏感,预后良好,但复发率高。Dube等[2]报道7例狼疮足细胞病患者均激素治疗敏感,其中有两例2周内达到了完全缓解。既往我们对50例狼疮足细胞病患者的研究发现单用激素或激素联合其他免疫抑制剂治疗,缓解率达94%,完全缓解率达到76%[3]。而且单用激素或激素联合其他免疫抑制剂疗效无差异,表明激素治疗敏感。但不同肾小球病变性质对激素的治疗反应不同,MCD/MsP单用激素的治疗反应较FSGS高,且达到缓解时间更短。本例患者第1次肾活检肾组织形态学表现为MsP,单用激素诱导治疗敏感,1个月即达到完全缓解。第2次肾活检肾组织形态学表现为FSGS,对单用足量激素诱导治疗反应差,且在病程中出现多种合并症,不适宜再接受足量激素诱导,后续采用激素联合多种免疫抑制剂治疗均能获得缓解。狼疮足细胞病复发率高达30.8%~42.86%[2,4]。我们报道的50例狼疮足细胞病中总体复发率高达56%,维持期单用激素的复发率高达90%,而激素联合其它免疫抑制药物的治疗方案能使复发率下降50%,但复发率仍高达40%[3]。本例患者反复复发8次,即在激素联合多种免疫抑制剂情况下,仍出现反复复发,表明传统免疫抑制方案并不是狼疮足细胞病的最佳维持治疗方案。由于肾病综合征反复复发,长期中大剂量激素治疗带来多种合并症,包括肺结核、带状疱疹病毒感染、反复肺部和尿路感染,同时还并发类固醇性糖尿病和双眼增殖性视网膜剥离。临床上迫切需要新的治疗手段降低狼疮足细胞病的复发率。
RTX治疗反复复发狼疮足细胞病激素或激素联合多种免疫抑制剂狼疮足细胞病仍高复发,因其发病率低,目前尚无针对其反复复发好的治疗方案。本例患者在反复复发8次,并发了多种合并症后,尝试RTX治疗,一共治疗3次,随访24个月,成功预防了肾病复发,并减少了激素用量。
RTX是一种人鼠嵌合性单克隆抗体,能特异性地作用于B细胞表面的CD20抗原,通过抗体依赖性、补体依赖性细胞介导的细胞毒性反应及细胞凋亡途径,启动介导耗竭B细胞的免疫反应。除广泛用于治疗淋巴瘤外,RTX也逐渐应用于自身免疫性疾病如类风湿关节炎、ANCA相关血管炎和狼疮性肾炎及原发性足细胞病如FSGS及MCD。研究显示RTX治疗难治性狼疮性肾炎包括Ⅲ、Ⅳ和Ⅴ可以获得67%~87%的缓解率[5],对临床指标包括尿蛋白和血清肌酐水平,免疫学指标包括ds-DNA抗体和补体水平均有显著改善。RTX治疗激素依赖或反复复发的原发性肾病综合征如MCD和FSGS,可有效减少肾病的复发,减少的激素剂量,从而降低不良反应[6-8]。NEMO研究纳入了激素依赖或反复复发(在激素和免疫抑制剂使用情况下,1年内肾病复发≥2次)的病理诊断为MCD、MsP或FSGS的患者,RTX使用前后各观察1年时间[9],共观察到110次肾病复发,使用RTX前88次,使用RTX后下降至22次。激素平均维持剂量由RTX治疗前的从0.27 mg/(kg·d)减少到0 mg/(kg·d),全年复发累积诱导剂量从56.8 mg/kg减少到0.5 mg/kg,单次复发累积诱导剂量从19.5 mg/kg减少到0.5 mg/kg,显示RTX显著减少了肾病复发频率,并且显著减少了治疗激素剂量。另一项多中心双盲安慰剂随机对照的试验同样显示RTX能显著减少肾病复发[7],并且延长了肾病复发时间(RTX组vs安慰剂组 267dvs101d,P<0.001)。同时,这些研究均显示RTX治疗不良反应少,安全性高。
RTX治疗狼疮足细胞病的作用机制不清,可能与RTX治疗原发性足细胞病的机制类似。原发性足细胞病的发病机制认为与T细胞功能异常有关[10]。研究表明B细胞可以促进T细胞活化,介导抗体非依赖性自身免疫损伤[11-13],提供共刺激分子以及细胞因子,使得T细胞功能持续活化。RTX可能通过诱导B细胞凋亡和B细胞耗竭,抑制B细胞对T细胞的活化作用,从而预防了肾病综合征的复发[14]。本例患者使用3次RTX期间,外周血B淋巴细胞数量持续低下,临床保持完全缓解状态。同时,有研究发现肾病复发与B细胞数量恢复有关[15]。Guigonis 等[16]评价了RTX治疗22名激素依赖及激素抵抗的肾病综合征的疗效,肾病复发者CD19+细胞数量高于无复发者,证明外周血B淋巴细胞数量与足细胞病复发有关。此外,有报道发现微小病变患者调节T细胞功能受损[17-19],增加调节T细胞功能可诱导肾病综合征缓解,而RTX能够增加调节T细胞的数目及功能从而发挥治疗作用[20]。RTX还能直接与足细胞表达的鞘磷脂磷酸二酯酶酸样3b蛋白(sphingomyelinase-like phosphodiesterase 3b,SMPDL-3b)相互作用,稳定足细胞骨架,从而减轻足细胞损伤[21]。
狼疮足细胞病的发生机制仍不明,但肯定与传统的免疫复合物沉积无关,因为毛细血管袢内皮下或上皮侧无免疫复合物沉积。系膜区的免疫复合物沉积及系膜病变并不直接导致大量蛋白尿[22-23]。最近的一项研究表明狼疮性肾炎患者产生的IgG与足细胞的Fc受体结合后钙或钙调蛋白依赖蛋白激酶IV及所涉及的基因表达增加,导致足细胞损伤和T细胞活化[24]。在狼疮肾炎当中可溶性血浆尿型纤溶酶化素激活受体水平增高可能介导了足细胞损伤[25]。
狼疮足细胞病的病理特点及对激素治疗的反应与特发性肾病综合征相似,而RTX在减少激素敏感或依赖的特发性肾病综合征已经获得了良好的效果,因此对于反复复发的狼疮足细胞病可以尝试使用RTX。目前RTX治疗狼疮足细胞病的文献为个案报道[26-27]。2例均表现反复复发的狼疮足细胞病,1例病理形态学表现为MCD,激素治疗敏感,激素减量后肾病反复复发伴肾外及免疫学活动,联合硫唑嘌呤或环磷酰胺后仍反复复发,换用MMF患者不能耐受。在给予RTX 1 000 mg/2周×2次治疗,2月后减停激素,后续羟氯喹维持治疗,随访24月,肾病持续缓解,未再复发。1例两次肾活检病理均为MsP,予以激素联合MMF及羟氯喹治疗后尿蛋白转阴、肾功能稳定,但激素减量后肾外以及免疫学指标活动,加用MTX治疗,疾病仍反复活动,行第二次肾活检后予以RTX 1 000 mg/2周×2次治疗后,临床肾病及免疫学指标均缓解,激素逐渐减停,随访14个月均未复发。本例患者在给予第一次RTX后,激素联合他克莫司维持,B细胞持续保持耗竭状态,给予第二次RTX治疗后,停用他克莫司,逐渐减少激素剂量,目前随访24个月,未见复发,亦未观察到不良反应,但RTX预防复发的疗效还需延长随访时间进一步观察。
小结:本例狼疮足细胞病采用激素联合多种免疫抑制药物治疗仍反复复发,且出现多种并发症。在RTX治疗后随访2年未复发,泼尼松能减至最小维持剂量,提示CD20单抗能有效预防狼疮足细胞病的复发,但需进一步临床研究的证实。
1Hu W,Chen Y,Wang S,et al.Clinical-Morphological Features and Outcomes of Lupus Podocytopathy.Clin J Am Soc Nephrol,2016,11(4):585-592.
2Dube GK,Markowitz GS,Radhakrishnan J,et al.Minimal change disease in systemic lupus erythematosus.Clin Nephrol,2002,57(2):120-126.
3Hu WX,Chen YH,Bao H,et al.Glucocorticoid with or without additional immunosuppressant therapy for patients with lupus podocytopathy:a retrospective single-center study.Lupus,2015,24(10):1067-1075.
4Mok CC,Cheung TT,Lo WH.Minimal mesangial lupus nephritis:a systematic review.Scand J Rheumatol,2010,39(3):181-189.
5Weidenbusch M,Römmele C,Schröttle A,et al.Beyond the LUNAR trial.Efficacy of rituximab in refractory lupus nephritis.Nephrol Dial Transplant,2013,28(1):106-111.
6Ravani P,Magnasco A,Edefonti A,et al.Short-term effects of rituximab in children with steroid- and calcineurin-dependent nephrotic syndrome:a randomized controlled trial.Clin J Am Soc Nephrol,2011,6(6):1308-1315.
7Iijima K,Sako M,Nozu K,et al.Rituximab for childhood-onset,complicated,frequently relapsing nephrotic syndrome or steroid-dependent nephrotic syndrome:a multicentre,double-blind,randomised,placebo-controlled trial.Lancet,384(9950):1273-1281.
8Ravani P,Rossi R,Bonanni A,et al.Rituximab in Children with Steroid-Dependent Nephrotic Syndrome:A Multicenter,Open-Label,Noninferiority,Randomized Controlled Trial.J Am Soc Nephrol,2015,26(9):2259-2266.
9Ruggenenti P,Ruggiero B,Cravedi P,et al.Rituximab in steroid-dependent or frequently relapsing idiopathic nephrotic syndrome.J Am Soc Nephrol,2014,25(4):850-863.
10 Shalhoub RJ.Pathogenesis of lipoid nephrosis:a disorder of T-cell function.Lancet,1974,2(7880):556-560.
11 Liu K,Mohan C.Altered B-cell signaling in lupus.Autoimmun Rev,2009,8(3):214-218.
12 Sfikakis PP,Boletis JN,Lionaki S,et al.Remission of proliferative lupus nephritis following B cell depletion therapy is preceded by down-regulation of the T cell costimulatory molecule CD40 ligand:an open-label trial.Arthritis Rheum,2005,52(2):501-513.
13 Bugatti S,Codullo V,Caporali R,et al.B cells in rheumatoid arthritis.Autoimmun Rev,2007,6(7):482-487.
14 Maloney DG.Mechanism of action of rituximab.Anticancer Drugs,2001,12 Suppl 2:S1-4.
15 Kamei K,Ito S,Nozu K,et al.Single dose of rituximab for refractory steroid-dependent nephrotic syndrome in children.Pediatr Nephrol,2009,24(7):1321-1328.
16 Guigonis V,Dallocchio A,Baudouin V,et al.Rituximab treatment for severe steroid- or cyclosporine-dependent nephrotic syndrome:a multicentric series of 22 cases.Pediatr Nephrol,2008,23(8):1269-1279.
17 Araya C,Diaz L,Wasserfall C,et al.T regulatory cell function in idiopathic minimal lesion nephrotic syndrome.Pediatr Nephrol,2009,24(9):1691-1698.
18 Hashimura Y,Nozu K,Kanegane H,et al.Minimal change nephrotic syndrome associated with immune dysregulation,polyendocrinopathy,enteropathy,X-linked syndrome.Pediatr Nephrol,2009,24(6):1181-1186.
19 Le BL,Bruneau S,Naulet J,et al.Induction of T regulatory cells attenuates idiopathic nephrotic syndrome.J Am Soc Nephrol,2009,20(1):57-67.
20 Stasi R,Cooper N,Del PG,et al.Analysis of regulatory T-cell changes in patients with idiopathic thrombocytopenic purpura receiving B cell-depleting therapy with rituximab.Blood,2008,112(4):1147-1150.
21 Fornoni A,Sageshima J,Wei C,et al.Rituximab targets podocytes in recurrent focal segmental glomerulosclerosis.Sci Transl Med,2011,3(85):85ra46.
22 Han TS,Schwartz MM,Lewis EJ.Association of glomerular podocytopathy and nephrotic proteinuria in mesangial lupus nephritis.Lupus,2006,15(2):71-75.
23 Kraft SW,Schwartz MM,Korbet SM,et al.Glomerular podocytopathy in patients with systemic lupus erythematosus.J Am Soc Nephrol,2005,16(1):175-179.
24 Ichinose K,Ushigusa T,Nishino A,et al.Lupus Nephritis IgG Induction of Calcium/Calmodulin-Dependent Protein Kinase IV Expression in Podocytes and Alteration of Their Function.Arthritis Rheumatol,2016,68(4):944-952.
25 Qin DD,Song D,Huang J,et al.Plasma-soluble urokinase-type plasminogen activator receptor levels are associated with clinical and pathological activities in lupus nephritis:a large cohort study from China.Lupus,2015,24(6):546-557.
26 Shahane A,Khasnis A,Gota C.Rituximab-responsive nephrotic syndrome due to minimal change disease in systemic lupus erythematosus.J Clin Rheumatol,2012,18(4):199-202.
27 Paramalingam S,Wong DD,Dogra GK,et al.Recurrent podocytopathy in a patient with systemic lupus erythematosus.SAGE Open Med Case Rep,2017,5:2050313X17695997.

