线粒体外膜转运蛋白70在高糖高脂诱导的心脏微血管内皮细胞损伤中的作用
侯娟妮,杜劲,李秀川,陈莎,冯健,冯娟,田玥,杨怡,裴海峰,杨大春
良好的心脏微血管功能对维持心脏的循环平衡和生理功能至关重要[1-2],心脏微血管损伤在糖尿病心血管功能障碍中发挥着非常重要的作用。大量研究表明,血脂异常是糖尿病并发症发生发展的主要因素[3-5],67.1%的糖尿病患者伴有血脂异常[6]。线粒体是细胞存活所必需的复杂细胞器,其结构和功能异常在糖尿病心血管损伤中占据重要地位。线粒体外膜转运蛋白70(translocase of the outer mitochondrial membrane 70,Tom70)是线粒体外膜转运蛋白中的一种,可将上千种线粒体外合成的蛋白转运至线粒体内发挥生理作用,决定着线粒体的形态、结构和功能[7]。Tom70在心肌肥厚、心力衰竭、心肌缺血/再灌注损伤等多种心血管疾病中均发挥一定的保护作用,而在糖尿病心脏微血管内皮细胞(cardiac microvascular endothelial cells,CMECs)损伤中的具体作用目前尚不明确。本研究初步探索高糖高脂条件下CMECs中Tom70的可能作用及机制,旨在为糖尿病心脏微血管损伤的防治提供新的治疗靶点和理论依据。
1 材料与方法
1.1 细胞及主要试剂 小鼠心脏微血管内皮细胞系(mouse cardiac microvascular endothelial cells,MCMECs)由中国医学科学院基础医学研究所细胞资源中心提供。低糖型DMEM培养基、高糖型DMEM培养基(美国HyClone公司);胎牛血清(美国Sigma公司);Trizol(美国Invitrogen公司);反转录及PCR检测试剂盒(日本TaKaRa公司);RT-qPCR引物(成都擎科梓熙生物技术有限公司);胰酶(美国Sigma公司);凋亡试剂盒(美国BD公司);二氢乙啶(dihydroethidium,DHE,中国碧云天);Lipofectamine 2000、Tom70-siRNA及Scramble siRNA(美国Invitrogen公司);范威氏因子(von villebrand factor,vWF)一抗、Tom70一抗、GAPDH一抗及山羊抗兔二抗(美国Abcam公司);活性氧ELISA试剂盒、一氧化氮ELISA试剂盒(深圳贝赛维斯);抗氧化剂N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC,中国碧云天)。
1.2 MCMECs的培养及分组 细胞在低糖培养基中生长融合至80%~90%时,用0.25%含EDTA的胰蛋白酶消化,按1:2将细胞悬液接种于培养瓶中,置于5% CO2、37℃培养箱中培养。选择生长良好的对数生长期细胞,接种于培养皿中并按分组进行实验。将油酸(0.33mmol/L)和棕榈酸(0.17mmol/L)按比例混合模拟高脂环境[8],通过前期的预实验选择最佳高脂干预浓度500μmol/L,干预时间16h。将MCMECs分为正常糖组(NG组,给予5.5mmol/L葡萄糖)、高糖组(HG组,给予25mmo1/L葡萄糖)和高糖高脂组(HG+HF组,给予25mmo1/L葡萄糖和500μmol/L混和脂肪酸)。为探索Tom70在高糖高脂诱导MCMECs损伤中的作用及机制,利用特异性siRNA技术敲低Tom70表达,进一步将HG+HF组分为对照组(control组仅转染试剂)、阴性对照siRNA组(Negative siRNAxeg组,转染试剂+非特异阴性Scramble siRNA)、Tom70-siRNA组(转染试剂+Tom70特异性siRNA)。为进一步探索Tom70是否通过氧化应激发挥作用,在高糖高脂和Tom70敲低基础上,再将细胞分为不含NAC组(仅DMSO干预)和含NAC组(5mmol/L,6h)。
1.3 细胞siRNA的转染 在siRNA转染前,将细胞接种于6孔板,在含有10% FBS的无抗生素低糖DMEM中培养,待细胞融合至40%后用于转染;将转染试剂Lipofectamine 2000(20μl/ml)和Tom70-siRNA或negative siRNA(终浓度为50nmol/L)分别用培养基稀释并孵育5min,将稀释的溶液分别混合在一起再室温孵育20min;在此期间,用PBS洗涤细胞,每孔加入DMEM 1500μl;随后,将孵育好的转染试剂加至各孔。继续培养4h后在显微镜下观察转染是否成功。将上述细胞在含有10%FBS的DMEM中继续培养,44h后提取mRNA、68h后提取蛋白质。其中构建的Tom70-siRNA包含3对独立序列,分别为:正义5'-CUAUGAACUCAGACGUUUATT-3',反义5'-UAAACGUCUGAGUUCAUAGTT-3';正义5'-CCGUGCCUAUUCCAUAGUATT-3',反义5'-UACUAUGGAAUAGGCACGGTT-3';正义5'-GUUAGCCUAUGGCUGAUAUTT-3',反义5'-AUAUCAGCCAUAGGCUAACTT-3'。
1.4 流式细胞术检测MCMECs凋亡水平 采用0.25%不含EDTA的胰酶消化收集细胞,用预冷PBS洗涤后以Binding Buffer重悬细胞,加入Annexin V-FITC混匀后,室温避光孵育15min,流式细胞术检测前5min再加入PI染液,流式细胞仪检测细胞凋亡,Flowjo软件分析数据。
1.5 ELISA测定MCMECs上清中活性氧簇(ROS)和一氧化氮(NO)含量 超声裂解MCMECs,12 000×g离心5min取细胞上清液,按说明书操作分别测定ROS和NO含量。
1.6 RT-qPCR检测MCMECs中Tom70 mRNA表达水平 采用Trizol法提取MCMECs总RNA,再反转录为cDNA,qPCR进行基因扩增,以GADPH为内参基因,用2–ΔΔCt法处理数据。扩增引物序列如下。Tom70:正义5'-GACAAGGAGGGAGAGGCTTT-3',反义5'-A AGGTGGCTCGCAGA AGTA A-3';GADPH:正义5'-GGGCTTGTCTCTGGTGTGAC-3',反义5'-GTTGCTGTTGAAGTCGCAGG-3'。
1.7 Western blotting检测MCMECs中Tom70蛋白含量 取50μg蛋白样品,按常规方法电泳、转膜、封闭后,再分别与抗Tom70抗体(1:200)、抗GAPDH抗体(1:3000)孵育,结合二抗并以化学发光法显迹,采用凝胶图像分析系统对条带进行密度扫描,用Image J软件分析灰度值。
1.8 细胞免疫荧光染色检测vWF因子及Tom70蛋白表达 细胞干预完成后弃去培养基,以4%多聚甲醛室温固定30min,0.2%Triton X-100透化2~5min,5%BSA室温封闭30min;加入vWF因子和Tom70一抗(1:200),4℃过夜;加入荧光素标记的二抗,37℃避光孵育30min;DAPI 以1:500浓度滴于培养皿,室温孵育5min;以上每步均须采用新鲜制备的PBS清洗,最后保持湿润,激光共聚焦显微镜下观察。
1.9 DHE染色观察ROS的生成 将DHE荧光探针按5μmol/L浓度用培养基稀释后加入到各组细胞中,各设3个复孔,37℃避光孵育30min,采用激光共聚焦显微镜检测DHE荧光水平。
1.10 统计学处理 采用SPSS 17.0软件对数据进行统计学分析。计量资料以表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 高糖高脂对MCMECs及Tom70表达的影响 流式细胞及ELISA检测结果显示,相比正常糖水平,高糖培养条件下,MCMECs凋亡率明显增高,NO生成减少,差异有统计学意义(P<0.05),而同时给予高脂可加剧这些损伤(P<0.05,图1A、B),表明高糖高脂可对MCMECs造成损伤。RT-qPCR及细胞免疫荧光检测结果显示,与NG组比较,HG组和HG+HF组Tom70 mRNA及蛋白表达水平均明显降低,而HG+HF组较HG组降低更为明显,差异均有统计学意义(P<0.05,图1C、D),表明Tom70在心脏微血管内皮有表达,高糖可导致Tom70表达下降,叠加高脂可加剧该效应。

图1 高糖高脂对MCMECs损伤及其Tom70表达的影响Fig.1 Effects of high glucose and high fat on MCMECs injury and Tom70 expression
2.2 高糖高脂对ROS生成的影响 DHE染色和ELISA检测结果显示,相比NG组,高糖可增加ROS的生成;而HG+HF比HG诱导ROS生成的作用更显著(P<0.05,图2),提示氧化应激反应增强是高糖高脂损伤MCMECs的原因之一。
2.3 Tom70缺失对MCMECs损伤的影响 RT-qPCR和Western blotting检测结果显示,Tom70-siRNA组Tom70的表达较对照组和阴性对照siRNA组显著降低,表明Tom70的表达已被成功抑制(P<0.01,图3A、B)。流式细胞术及ELISA检测发现,Tom70缺失的MCMECs凋亡率明显增加,NO生成明显减少(P<0.01,图3C、D)。提示Tom70是高糖高脂环境下MCMECs的保护性分子。
2.4 下调Tom70对ROS生成的影响 DHE染色和ELISA检测结果显示,Tom70-siRNA转染所致Tom70缺失明显增加了细胞内ROS的生成(P<0.01,图4A、B)。
2.5 NAC部分逆转Tom70缺失对MCMECs损伤的影响 ELISA及流式细胞检测结果显示,同样转染Tom70-siRNA的细胞,在用抗氧化剂NAC(5mmol/L)干预6h后,MCMECs中ROS及细胞凋亡水平明显降低,NO生成明显增加(P<0.05,图5),表明Tom70作用的发挥与氧化应激反应有关。

图2 高糖高脂对ROS生成的影响Fig.2 Effects of high glucose and high fat on the generation of ROS
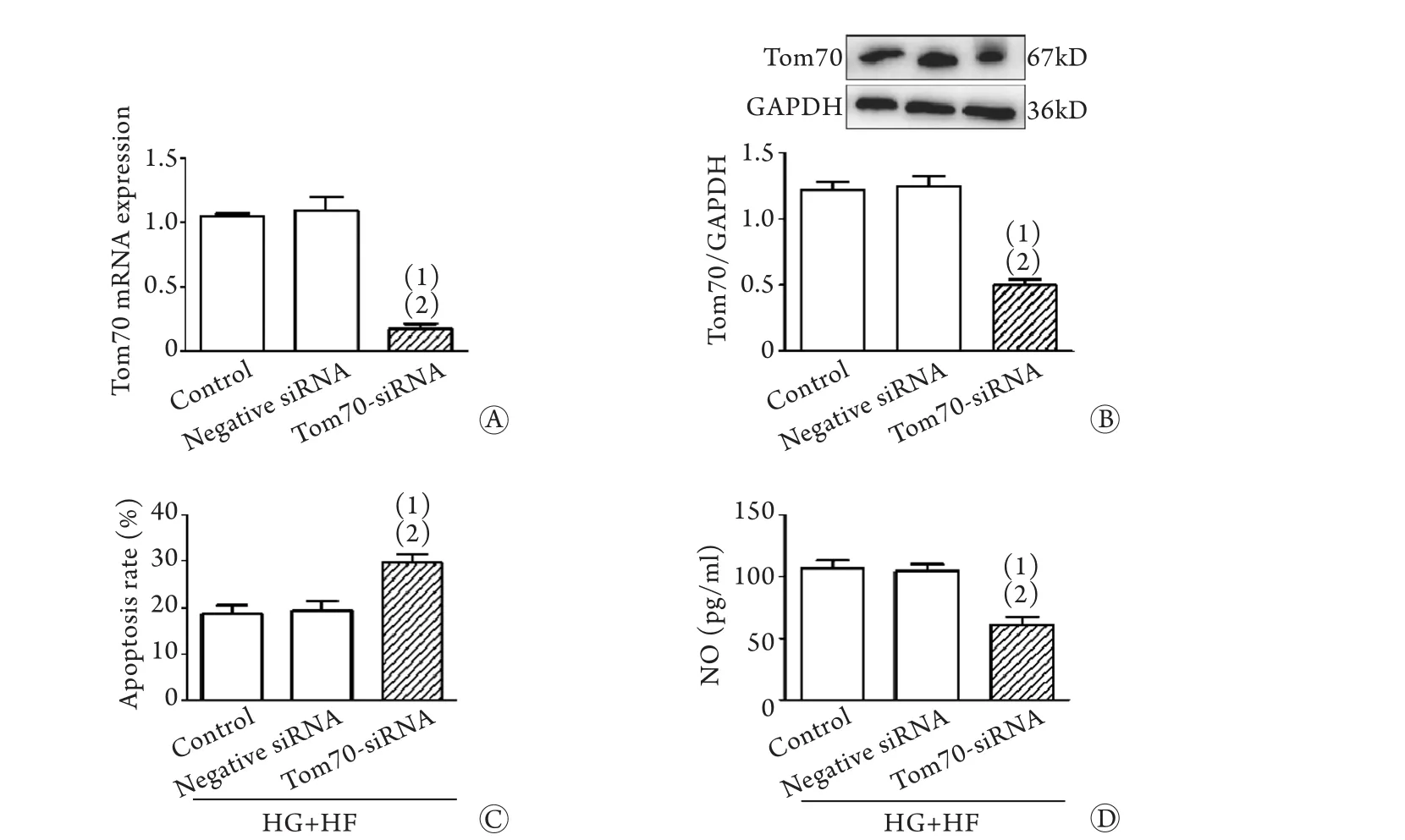
图3 Tom70缺失对MCMECs的影响Fig.3 Effect of Tom70 deletion on MCMECs
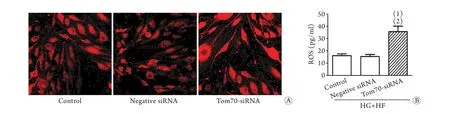
图4 Tom70缺失对ROS生成的影响Fig.4 Effects of Tom70 deletion on the generation of ROS

图5 NAC对Tom70缺失所致MCMECs损伤的影响Fig.5 Effect of NAC on MCMECs injury induced by Tom70 deletion
3 讨 论
国际糖尿病联盟2017年最新数据显示,全球有糖尿病患者4.25亿,其中中国患者1.144亿,发病率高达10.9%,居全球第一。糖尿病可导致心脏微血管病变、心肌代谢异常及心肌纤维化等多种心血管损伤,心血管并发症已成为糖尿病患者的首要死因,而CMECs受损被认为是导致糖尿病心血管并发症的主要原因[9]。糖尿病CMECs的过度凋亡可能导致微血管屏障功能障碍,造成心肌代谢异常和细胞内钙稳态受损[10];如同冠状动脉狭窄一样,心脏微血管功能障碍还可导致心肌缺氧[11]。血脂异常可能是糖尿病心血管并发症高发的原因之一[12]。研究表明,高血脂是2型糖尿病、缺血性心脏病、心力衰竭等疾病的重要的危险因素[13],而降脂药物在心血管病防治中具有较理想的作用[14]。因此,深入研究高糖高脂状态下心血管损伤的分子机制和干预靶点非常有意义。本课题组前期实验发现,高糖显著增加了MCMECs的凋亡,减少了NO的生成,而高脂会进一步影响内皮的存活和功能,提示合并高脂血症会进一步加重糖尿病CMECs损伤,故控制血糖和血脂同等重要。
线粒体是真核细胞中高度活跃的细胞器,在细胞能量转换、代谢和凋亡中发挥着重要的作用,而这些作用的发挥离不开线粒体转运蛋白。线粒体作为决定真核细胞生死存亡的“产能工厂”,其内部含有1 000余种蛋白质,约99%在线粒体外合成后经线粒体外膜上的线粒体外膜转位酶(translocase of the outer mitochondrial membrane,Tom)复合物运输,转运至线粒体内部发挥其相应的生理功能[15]。Tom复合物决定了线粒体前体蛋白的输入,对维持病理生理条件下的线粒体功能至关重要。Tom复合物主要由Tom70、Tom40和Tom22等多种亚基组成,Tom70属于其中最外侧的一种亚型。Li等[16]研究发现,下调Tom70表达可导致病理性心肌细胞肥大;Pei等[17]发现,上调Tom70表达可有效减轻缺血后心肌损伤。这些研究均提示Tom70可能在心血管疾病中发挥着重要作用。截至目前,Tom70在血管内皮中的表达情况及在糖尿病状态下的表达变化等仍未阐明。本研究发现,Tom70不仅在心脏微血管内皮中有表达,而且在高糖高脂干预后明显下降,提示Tom70可能在糖尿病CMECs损伤中也发挥一定作用。为了进一步探索Tom70的作用情况,以特异性siRNA敲低Tom70水平,结果发现,下调Tom70会进一步加重MCMECs凋亡、减少NO生成,即Tom70缺失会加重糖尿病CMECs的损伤和功能紊乱,提示Tom70可作为糖尿病心脏微血管损伤的治疗靶点来深入研究。
氧化应激是ROS生成和清除失衡的结果,越来越多的证据表明,氧化应激在糖尿病并发症的发病机制中发挥关键作用,而氧化应激是否介导了线粒体功能蛋白Tom70的内皮保护作用尚属未知。大量研究发现,糖尿病可增加血管内皮ROS生成,诱导内皮细胞凋亡,最终影响微血管屏障功能、心脏功能和心肌糖代谢等[18]。本研究发现,高糖高脂可增加ROS生成,该结果与现有的研究一致[19]。还有研究发现Tom70缺失会损伤心肌细胞的线粒体完整性,促进ROS产生,最终加重细胞损伤[17]。本研究也发现,下调Tom70会进一步加重氧化应激反应,这可能与Tom70缺失导致线粒体功能紊乱有关,值得在后续实验中继续验证;而应用抗氧化剂NAC部分逆转了Tom70缺失后内皮细胞的高氧化应激水平和不良作用,提示Tom70参与了内皮细胞氧化应激的调节过程。这些结果提示,ROS过载是糖尿病微血管内皮损伤的重要诱因,高糖高脂可能通过抑制Tom70表达加重氧化应激反应,最终导致糖尿病心脏微血管损伤。后期本课题组将引入腺病毒过表达技术继续观察Tom70与氧化应激之间的关系。
综上所述,高脂可进一步加剧糖尿病心脏微血管内皮损伤,Tom70可能通过氧化应激途径介入高糖高脂心脏微血管损伤的调控。本研究为糖尿病合并高脂血症患者的心血管防护提供了新的视角,下一步将结合动物实验进一步阐明Tom70在糖尿病心脏微血管损伤中的保护作用。
【参考文献】
[1]Ismail-Beigi F, Craven T, Banerji MA,et al. Effect of intensive treatment of hyperglycaemia on microvascular outcomes in type 2 diabetes: an analysis of the ACCORD randomised trial[J].Lancet, 2010, 376(9739): 419-430.
[2]Hao M, Li SY, Sun CK,et al. Amelioration effects of berberine on diabetic microendothelial injury model by the combination of high glucose and advanced glycation end productsin vitro[J].Eur J Pharmacol, 2011, 654(3): 320-325.
[3]Cusi K. The role of adipose tissue and lipotoxicity in the pathogenesis of type 2 diabetes[J]. Curr Diab Rep, 2010, 10(4):306-315.
[4]DeFronzo RA. Insulin resistance, lipotoxicity, type 2 diabetes and atherosclerosis: the missing links. the Claude Bernard lecture 2009[J]. Diabetologia, 2010, 53(7): 1270-1287.
[5]Du J, Hou JN, Li XC,et al. Effect of perilipin-5 on apoptosis of cardiac microvascular endothelial cells induced by high fat and high glucose in mice[J]. Med J Chin PLA, 2017, 42(12): 1045-1050. [杜劲, 侯娟妮, 李秀川, 等. 脂滴包被蛋白5对高糖高脂诱导的小鼠心脏微血管内皮细胞凋亡的影响及机制[J]. 解放军医学杂志, 2017, 42(12): 1045-1050.]
[6]Yan L, Xu MT, Yuan L,et al. Prevalence of dyslipidemia and its control in type 2 diabetes: A multicenter study in endocrinology clinics of China[J]. J Clin Lipidol, 2016, 10(1): 150-160.
[7]Liu XY, Wei B, Shi HX,et al. Tom70 mediates activation of interferon regulatory factor 3 on mitochondria[J]. Cell Res,2010, 20(9): 994-1011.
[8]Ricchi M, Odoardi MR, Carulli L,et al. Differential effect of oleic and palmitic acid on lipid accumulation and apoptosis in cultured hepatocytes[J]. J Gastroenterol Hepatol, 2009, 24(5):830-840.
[9]Avogaro A, Fadini GP, Gallo A,et al. Endothelial dysfunction in type 2 diabetes mellitus[J]. Nutr Metab Cardiovasc Dis,2006,16(Suppl 1): S39-S45.
[10]Westermeier F, Riquelme JA, Pavez M,et al. New molecular insights of insulin in diabetic cardiomyopathy[J]. Front Physiol,2016, 7: 125.
[11]Marinescu MA, Löffler AI, Ouellette M,et al. Coronary microvascular dysfunction, microvascular angina, and treatment strategies[J]. JACC Cardiovasc Imaging, 2015, 8(2): 210-220.
[12]Mazzone T. Intensive glucose lowering and cardiovascular disease prevention in diabetes: reconciling the recent clinical trial data[J]. Circulation, 2010, 122(21): 2201-2211.
[13]Goldfine AB, Beckman JA. Life and death in Denmark: lessons about diabetes and coronary heart disease[J]. Circulation, 2008,117(15): 1914-1917.
[14]Gotto AM, Moon JE. Pharmacotherapies for lipid modification:beyond the statins[J]. Nat Rev Cardiol, 2013, 10(10): 560-570.
[15]Harbauer AB, Opalinska M, Gerbeth C,et al. Mitochondria.Cell cycle-dependent regulation of mitochondrial preprotein translocase[J]. Science, 2014, 346(6213): 1109-1113.
[16]Li J, Qi M, Li C,et al. Tom70 serves as a molecular switch to determine pathological cardiac hypertrophy[J]. Cell Res, 2014,24(8): 977-993.
[17]Pei HF, Hou JN, Wei FP,et al. Melatonin attenuates postmyocardial infarction injuryviaincreasing Tom70 expression[J]. J Pineal Res, 2017, 62(1): e12371.
[18]Wang D, Luo P, Wang Y,et al. Glucagon-like peptide-1 protects against cardiac microvascular injury in diabetesviaa cAMP/PKA/Rho-dependent mechanism[J]. Diabetes, 2013, 62(5):1697-1708.
[19]Dal S, Jeandidier N, Seyfritz E,et al. Oxidative stress status and liver tissue defenses in diabetic rats during intensive subcutaneous insulin therapy[J]. Exp Biol Med, 2016, 241(2):184-192.

