异体脂肪间充质干细胞对卵巢早衰患者外周血调节性T细胞的影响
宋开静,何援利,蔡慧华,张冬梅,黄睿淳,孙冬华
卵巢早衰(premature ovarian failure,POF)是指女性在40岁前出现性腺衰竭,引起月经不规则、闭经、不孕、围绝经期综合征等表现的一种妇科内分泌疾病[1]。POF的病因复杂,已知的POF病因包括遗传、自身免疫、医源损伤及感染等因素[2]。有证据表明,约30%的POF与自身免疫失调有关[3]。近年来陆续有研究发现POF患者外周血T淋巴细胞亚群比例失调,主要表现为外周血CD4+/CD8+T淋巴细胞比值下降[4-5],另外有研究发现POF患者外周血调节性T细胞(regulatory T cells,Treg)数量减少[6],可见POF与细胞免疫密切相关。
间充质干细胞(MSCs)因具有自我更新和多向分化潜能,被广泛应用于细胞替代治疗和再生医学领域[7]。此外,MSCs还具有免疫调节能力[8]。体内外实验表明,MSCs与外周血单个核细胞或外周血T淋巴细胞共培养可明显增加Treg细胞的比例[9-10]。MSCs应用于POF的众多研究结果显示,不同来源的MSCs均能有效改善卵巢功能,可作为组织工程的种子来源细胞[11-13]。脂肪间充质干细胞(ADSCs)取材方便,来源丰富,可在体外稳定扩增,而且在多种免疫疾病的治疗研究当中均有应用[14]。本研究选取异体脂肪间充质干细胞(hADSCs)用于实验。目前关于POF的动物实验大多为MSCs应用于化疗诱导的POF模型,而MSCs应用于免疫相关的POF的研究甚少,本研究从免疫调控的角度探讨hADSCs对卵巢早衰患者外周血调节性T细胞的影响。
1 材料与方法
1.1 研究对象 选择2016年8月-2017年8月在南方医科大学珠江医院妇产科确诊为POF的患者18例,其中POF的纳入及排除标准参照课题组的前期研究[15]。本研究经南方医科大学珠江医院伦理委员会批准并获得患者知情同意。
1.2 主要试剂和仪器 外周血淋巴细胞分离液购自天津灏洋生物有限公司;Ⅰ型胶原酶购自美国Sigma公司;成脂成骨诱导分化培养基购自赛业公司;CCK-8试剂盒购自日本同仁公司;FITC-CD4抗体、APC-CD25抗体和PE-Foxp3抗体购自美国eBioscience公司;RNA提取试剂Trizol、反转录试剂盒及RT-PCR试剂盒均购自日本TaKaRa公司;Foxp3、β-actin引物均应用PrimerBank软件设计,交由上海捷瑞生物有限公司合成。
1.3 方法
1.3.1 hADSCs原代分离培养 无菌条件下采取人体脂肪组织约10ml,PBS冲洗3遍;眼科剪剪至糊状后加入等体积的0.1% Ⅰ型胶原酶,37℃水浴30~40min,其间不断摇晃;1500r/min离心10min,弃上清;加入含10% FBS、100U/ml青霉素及100U/ml链霉素的DMEM培养基重悬,置于37℃、含5%CO2孵箱中培养,每2~3d换液。当细胞生长至80%融合时进行传代,取第3代细胞用于后续实验。
1.3.2 hADSCs的表型鉴定及成脂成骨分化能力测定 用胰酶消化第3代hADSCs,制成1×106个/ml的单细胞悬液,每200μl细胞悬液中加入CD90、CD105、CD45和CD34抗体各10μl,室温避光孵育30min,PBS洗涤2次后用流式细胞仪检测细胞的表面标志。成脂成骨诱导分化根据赛业公司提供的说明进行。取第3代hADSCs接种于预先用1%明胶包被的12孔板中,每孔细胞数为5×103个,待细胞融合至80%时更换为诱导分化培养基。每3d更换1次诱导分化液,诱导培养21d后,采用油红O染色进行成脂分化鉴定,茜素红染色进行成骨分化鉴定。
1.3.3 外周血单个核细胞(PBMCs)的分离培养 月经第2~4天或闭经患者随机抽取外周血10ml,置于肝素钠抗凝管,采用密度梯度离心法分离PBMCs,将抗凝管中血液以相同体积PBS混匀,缓慢加至外周血淋巴细胞分离液中,2000r/min离心20min,收集中间层细胞,用PBS液漂洗2次,室温下1500r/min离心10min,弃上清,得到PBMCs。
1.3.4 共培养体系建立 实验分为4组,对照组为单纯植物凝集素(PHA)刺激的PBMCs,其余3组为PHA刺激的PBMCs分别与梯度浓度的hADSCs共培养。具体步骤如下:将1×104、2×104、1×105个hADSCs分别接种于24孔板;次日每孔接种1×105个PBMCs,并加入5μg/ml的PHA;置于37℃、含5%CO2孵箱中共培养72h。
1.3.5 CCK-8法检测淋巴细胞的增殖率 共培养72h后,收集上清悬浮的淋巴细胞,按照每孔1×105的密度接种于96孔板中,避光加入CCK-8,每孔10μl,置于37℃培养箱中继续孵育4h,酶标仪检测450nm波长的吸光度(A)值。
1.3.6 流式细胞术检测CD4+CD25+Foxp3+Treg细胞在CD4+细胞中所占比例 共培养72h后,收集上清悬浮的淋巴细胞,实验管和同型对照管分别加入10μl FITC标记的CD4以及APC标记的CD25单抗,4℃避光孵育30min,经固定破膜后,实验管加入10μl PE标记的Foxp3抗体,对照管中加入相应的同型对照,避光孵育30min,最后加200μl 4%多聚甲醛固定,4℃过夜,次日采用流式细胞仪检测CD4+CD25+Foxp3+Treg细胞在CD4+细胞中所占比例。
1.3.7 实时荧光定量PCR检测Foxp3 mRNA水平 共培养72h后收集上清悬浮的淋巴细胞,提取总RNA后反转录为cDNA,操作步骤按试剂盒说明书进行。实时定量PCR采用SYBR荧光法,引物序列如下。Foxp3:正义5'-CCCAGGAAAGACAGCAACCTT-3',反义5'-CAAACAGGCCGCCGTCTGGAGCC-3';β-actin:正义5'-TGGAATCCTGTGGCATCCATGAAA C-3',反义5'-TAAAACGCAGCTCAGTAACAGTCCG-3'。反应体系10μl,充分混匀。每个标本3个复孔,PCR反应在Light Cycler 480高通量实时荧光定量PCR仪上进行。
1.4 统计学处理 采用SPSS 20.0软件进行统计分析。所有实验数据以表示,组间比较采用单因素方差分析,进一步两两比较如方差齐采用LSD-t检验,方差不齐采用Dunnett-T3法。P<0.05为差异有统计学意义。
2 结 果
2.1 hADSCs的形态学观察以及免疫表型和分化能力鉴定 接种24h后大部分原代细胞贴壁,传至第3代后细胞趋于稳定,镜下观察呈长梭状或纤维状(图1A)。流式结果显示细胞高表达CD90、CD105,低表达CD34和CD45(图2)。经成脂、成骨诱导分化后,油红O和茜素红染色阳性(图1B、C)。

图1 hADSCs的形态学观察及分化能力鉴定Fig.1 Morphology and differentiation ability of hADSCs

图2 hADSCs的免疫表型鉴定Fig.2 Immune phenotypes of hADSCs
2.2 hADSCs与PBMCs共培养的镜下观察结果 在光学显微镜下观察到PHA促进了PBMCs的增殖,细胞呈团簇样聚集生长。随着ADSCs浓度的增加,增殖效果降低。提示ADSCs能够抑制PHA刺激引起的PBMCs增殖(图3)。
2.3 CD4+CD25+Foxp3+Treg细胞在CD4+细胞中所占比例 流式细胞术检测结果显示,与对照组(1.29%±0.50%)相比,加入1×104、2×104、1×103个hADSCs后CD4+CD25+Foxp3+Treg在CD4+细胞中所占比例(分别为5.91%±1.27%,7.76%±0.84%,8.17%±1.20%)均明显增高,且呈剂量依赖性,其中加入1×105个hADSCs的效果最为明显(P<0.05,图4)。
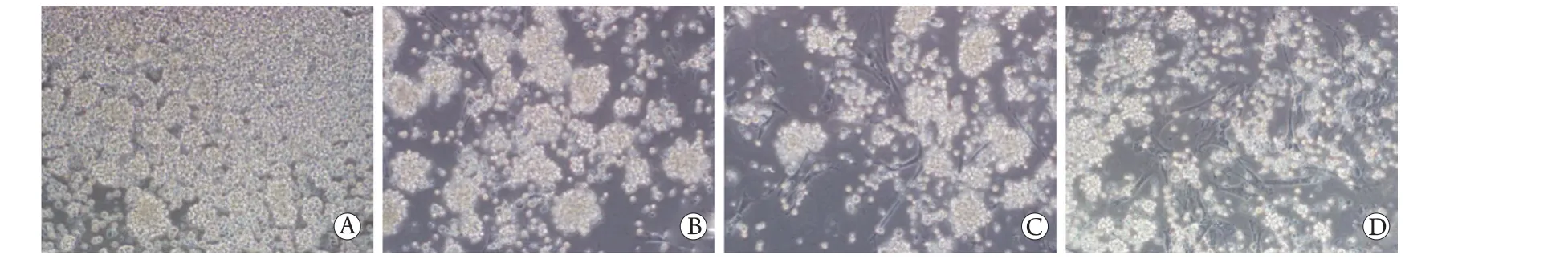
图3 hADSCs与PBMCs共培养的镜下观察Fig.3 Co-cultures of hADSCs and PBMCs (Observed under microscope)
2.4 淋巴细胞的增殖率 CCK-8法检测结果显示,与对照组(1.514±0.047)相比,不同数量级的hADSCs均能抑制淋巴细胞的增殖,且呈剂量依赖性(0.914±0.065、0.723±0.072、0.354±0.048),差异均有统计学意义(P<0.001)。
2.5 Foxp3 mRNA表达水平 实时荧光定量PCR检测结果显示,与对照组(1.000±0.000)相比,不同数量级的hADSCs均能明显上调Foxp3 mRNA的表达水平(4.100±0.826、6.315±0.437、12.879±2.028),差异均有统计学意义(P<0.001)。
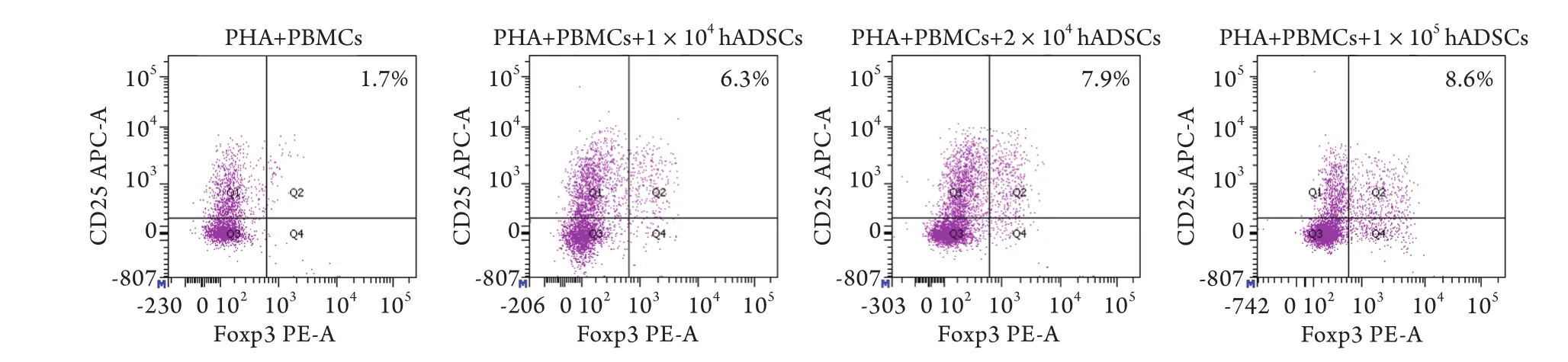
图4 流式细胞术检测CD4+ CD25+ Foxp3+ Treg细胞在CD4+细胞中所占比例Fig.4 Proportion of CD4+ CD25+ Foxp3+ Treg cells in CD4+ cells (Flow cytometry)
3 讨 论
POF是一种病因复杂的妇科内分泌疾病,目前的治疗方法主要包括激素替代治疗、赠卵移植、卵巢移植等,但尚不能达到恢复生育能力的效果,且部分治疗方法受伦理影响较大,限制了其临床应用。近年来有研究发现,POF的发病机制与自身免疫紊乱密切相关,POF患者外周血Treg细胞数量明显减少[6]。因此,寻求能够促进Treg细胞增殖的有效方法可能是成功治疗POF的关键。在本研究中,将hADSCs与POF患者的PBMCs共培养,结果证实hADSCs可以促进Treg细胞的增殖,从而发挥免疫调节功能。
Treg细胞是一类具有免疫抑制和免疫调节功能的T细胞亚型,其正常生理功能对于机体维持免疫稳态必不可少[16]。转录因子Foxp3特异性表达于Treg细胞,是Treg细胞最可靠的分子标志,对Treg细胞的发育及功能发挥起着关键作用。Foxp3功能缺失将导致Treg细胞数量减少、功能减弱,从而导致自身免疫系统疾病的发生,因此,其在一定程度上可反映Treg细胞的水平[17-18]。相关研究已经证实,输入体外扩增的Treg细胞可以治疗多种免疫性疾病[19-20],但是其在体内炎症的微环境下,发挥免疫抑制功能的效果尚不稳定[21]。另外,影响Treg细胞用于免疫治疗的因素还有很多,例如无菌性、纯度、低温冻存等问题,因而限制了其在临床的应用。
MSCs能在体内外发挥免疫抑制作用,具有极大的临床应用价值。各种不同来源的MSCs治疗卵巢早衰的动物实验都取得了一定的效果。Badawy等[11]的研究证实,在小鼠模型中,骨髓间充质干细胞(BMSCs)修复了环磷酰胺诱导的卵巢早衰,卵巢的形态学分析显示有新的原始卵泡形成,激素水平恢复至接近正常,注射了BMSCs的POF小鼠最终能够恢复受孕能力。Song等[13]将人脐带间充质干细胞(UCMSCs)通过尾静脉和卵巢原位两种方式移植入环磷酰胺诱导的卵巢早衰大鼠模型中,结果发现,移植后的UCMSCs可以存在于卵巢组织中,并能存活较长时间。人类的UCMSCs移植除了减少卵巢细胞凋亡外,还恢复了POF大鼠的激素分泌和卵泡发育。付霞霏等[22]的研究表明,UCMSCs移植可修复透明带免疫损伤的卵巢组织,从而部分改善其内分泌功能。由此可见,干细胞应用于卵巢早衰取得的成果使卵巢功能以及生育能力的恢复成为可能。
本实验所培养的细胞高表达CD90、CD105,低表达CD34和CD45,同时具备成脂、成骨分化能力,证实所获得的细胞符合干细胞特征,可用于hADSCs与Treg细胞共培养的实验研究。罗利梅等[23]将BMSCs与系统性红斑狼疮(SLE)患者来源的T淋巴细胞共培养,得出BMSCs能抑制SLE患者T细胞增殖并促进T细胞向Treg细胞转化的结论。另外,Hong等[24]将人牙髓间充质干细胞(DP-MSC)与CD4+T细胞共培养,结果显示DP-MSC可以通过促进CD4+CD25+Foxp3+Treg细胞增殖调节免疫耐受。本实验结果也显示,与对照组相比,不同数量级的hADSCs均能促进CD4+CD25+Foxp3+Treg细胞增殖并上调Foxp3 mRNA的表达,且该作用随hADSCs数量的增高而增强。因此推测hADSCs对POF患者Treg细胞的免疫调节作用可能与上调Foxp3的表达有关,Foxp3高表达可进一步促进Treg细胞数量增加,进而促进Treg细胞发挥免疫调节作用。另外,还有研究发现MSCs的免疫抑制活性可能受到炎症环境因素影响,其免疫调节功能被认为是可溶性因子分泌和细胞直接接触的结果,MSCs分泌某些细胞因子和趋化因子,可诱导Treg细胞分化,然后,这些新生成的Treg细胞能够增强MSCs的免疫耐受性和免疫调节功能[25]。因此,我们推测它们之间可能具有协同作用,共同发挥免疫调节功能,具体的机制还有待进一步研究。
综上所述,hADSCs能促进卵巢早衰患者外周血Treg细胞的增殖,从而发挥免疫调节作用,这为POF的免疫治疗供了一条崭新的途径。但本研究仅限于体外,hADSCs在体内如何发挥免疫调节作用仍有待进一步探讨。
【参考文献】
[1]Rebar RW. Premature ovarian failure[J]. Obstet Gynecol, 2009,113(6): 1355-1363.
[2]Jankowska K. Premature ovarian failure[J]. Prz Menopauzalny,2017, 16(2): 51-56.
[3]Panay N, Kalu E. Management of premature ovarian failure[J].Best Pract Res Clin Obstet Gynaecol, 2009, 23(1): 129-140.
[4]Tuohy VK, Altuntas CZ. Autoimmunity and premature ovarian failure[J]. Curr Opin Obstet Gynecol, 2007, 19(4): 366-369.
[5]Lourenco EV, La Cava A. Natural regulatory T cells in autoimmunity[J]. Autoimmunity, 2011, 44(1): 33-42.
[6]Xie JY, Dong YJ, Liang ZQ,et al. Changes and significances of CD4+CD25+T regulatory cells in patients with premature ovary failure[J]. Reprod Contracept, 2013, 33(4): 224-227. [谢江燕,东亚君, 梁志清, 等. 卵巢早衰患者外周血CD4+CD25+Treg细胞的变化及意义[J]. 生殖与避孕, 2013, 33(4): 224-227.]
[7]Wang ZY, Guo JW, Yang YX,et al. A comparative study on autologous and allogeneic adipose derived mesenchymal stem cell transplantation in treatment of acute myocardial infarction rats[J]. Med J Chin PLA, 2017, 42(9): 788-792. [汪兆艳, 郭建巍, 杨印祥, 等. 自体与异体脂肪间充质干细胞移植治疗大鼠急性心肌梗死的比较研究[J]. 解放军医学杂志, 2017,42(9): 788-792.]
[8]Ma S, Xie N, Li W,et al. Immunobiology of mesenchymal stem cells[J]. Cell Death Differ, 2014, 21(2): 216-225.
[9]Zhang L, Wang XY, Zhou PJ,et al. Use of immune modulation by human adipose-derived mesenchymal stem cells to treat experimental arthritis in mice[J]. Am J Transl Res, 2017, 9(5):2595-2607.
[10]Alunno A, Montanucci P, Bistoni O,et al.In vitroimmunomodulatory effects of microencapsulated umbilical cord Wharton jelly-derived mesenchymal stem cells in primary Sjögren's syndrome[J]. Rheumatology (Oxford), 2015, 54(1):163-168.
[11]Badawy A, Sobh M, Ahdy M,et al. Bone marrow mesenchymal stem cell repair of cyclophosphamide-induced ovarian insufficiency in a mouse model[J]. Int J Womens Health, 2017,9: 441-447.
[12]Ding C, Li H, Wang Y,et al. Different therapeutic effects of cells derived from human amniotic membrane on premature ovarian aging depend on distinct cellular biological characteristics[J].Stem Cell Res Ther, 2017, 8(1): 173.
[13]Song D, Zhong Y, Qian C,et al. Human umbilical cord mesenchymal stem cells therapy in cyclophosphamide-induced premature ovarian failure rat model[J]. Biomed Res Int, 2016,2016: 1-13.
[14]Yousefi F, Ebtekar M, Soudi S,et al.In vivoimmunomodulatory effects of adipose-derived mesenchymal stem cells conditioned medium in experimental autoimmune encephalomyelitis[J].Immunol Lett, 2016, 172: 94-105.
[15]Cai HH, He YL, Fu XF,et al. Increased serum IL-21 correlates to patients with primary ovarian insufficiency[J]. J Immunol, 2015,31(5): 458-460. [蔡慧华, 何援利, 付霞霏, 等. 卵巢早衰及卵巢功能减退患者血清IL-21的水平变化[J]. 免疫学杂志,2015, 31(5): 458-460.]
[16]Grant CR, Liberal R, Mieli-Vergani G,et al. Regulatory T-cells in autoimmune diseases: Challenges, controversies and-yetunanswered questions[J]. Autoimmun Rev, 2015, 14(2): 105-116.
[17]Li Z, Li D, Tsun A,et al. FOXP3+regulatory T cells and their functional regulation[J]. Cell Mol Immunol, 2015, 12(5): 558-565.
[18]Spence A, Klementowicz JE, Bluestone JA,et al. Targeting Treg signaling for the treatment of autoimmune diseases[J]. Curr Opin Immunol, 2015, 37: 11-20.
[19]Zhou Y, Singh AK, Hoyt RF,et al. Regulatory T cells enhance mesenchymal stem cell survival and proliferation following autologous cotransplantation in ischemic myocardium[J]. J Thoracic Cardiovasc Surg, 2014, 148(3): 1131-1137.
[20]Lim J, Park M, Im K,et al. Combination cell therapy using mesenchymal stem cells and regulatory T-cells provides a synergistic immunomodulatory effect associated with reciprocal regulation of Th1/Th2 and Th17/Treg cells in a murine acute graft-versus-host disease model[J]. Cell Transplant, 2014, 23(6):703-714.
[21]Schliesser U, Streitz M, Sawitzki B. Tregs: application for solidorgan transplantation[J]. Curr Opin Organ Transplant, 2012,17(1): 34-41.
[22]Fu XF, He YL. The effects of umbilical cord mesenchymal stem cell transplantation on immune premature ovarian failure[J].Guangdong Med J, 2013, 34(23): 3535-3538. [付霞霏, 何援利.脐带间充质干细胞移植对免疫性卵巢早衰的影响[J]. 广东医学, 2013, 34(23): 3535-3538.]
[23]Luo LM, Luo J, Zhou XQ,et al. Immunosuppressive effects of allogeneic human mesenchymal stem cells on T lymphocytes from patients with systemic lupus erythematosus[J]. J Immunol,2016, 32(8): 681-686. [罗利梅, 骆辑, 周晓泉, 等. 间充质干细胞对系统性红斑狼疮T淋巴细胞的免疫调节作用[J]. 免疫学杂志, 2016, 32(8): 681-686.]
[24]Hong JW, Lim JH, Chung CJ,et al. Immune tolerance of human dental pulp-derived mesenchymal stem cells mediated by CD4+CD25+FoxP3+regulatory T-cells and induced by TGF-β1and IL-10[J]. Yonsei Med J, 2017, 58(5): 1031.
[25]Yu Y, Zhao T, Yang D. Cotransfer of regulatory T cells improve the therapeutic effectiveness of mesenchymal stem cells in treating a colitis mouse model[J]. Exp Anim, 2017, 66(2): 167-176.

