17-AAG在氧糖剥夺后复糖复氧诱导的神经元凋亡中的作用
李建雄,李鸣明,卜玉洁,李斌,邹华,张廷华
脑缺血性损伤已成为危害人类生命健康的危重病之一,其导致的神经元不可逆死亡可以造成神经功能和行为学障碍甚至死亡[1-4]。目前唯一可用于治疗急性缺血性卒中的药物是组织型纤溶酶原激活剂(tissue plasminogen activator,tPA)。但是,tPA治疗必须在中风发作后4.5h内进行[5],一旦超过4.5h的治疗窗口,溶栓导致的颅内出血风险明显增加[6]。因此目前临床上迫切需要开发新的脑缺血性损伤保护药物或探索新的治疗思路[7]。
17-烯丙基氨基-17-甲基格尔德霉素(17-allylamino-17-demethoxygeldanamycin,17-AAG)是热休克蛋白90(heat shock protein 90,Hsp90)抑制剂。大量研究表明,17-AAG能够抑制肺腺癌、胆管癌等多种肿瘤细胞的增殖并诱导凋亡[8-10]。此外,有研究表明,在创伤性脑损伤中17-AAG可以发挥神经保护作用[11-13]。同时,我们的前期研究发现,17-AAG可以抑制短暂性全脑缺血诱导的大鼠海马神经元死亡[14]。但是,17-AAG在脑缺血过程中发挥神经保护作用的机制还未见报道。Kim等[13]研究发现在创伤性脑损伤中,17-AAG可以通过诱导小胶质细胞和神经元中HSP70的表达进而发挥神经保护作用。此外,在前期动物实验中,我们也发现17-AAG可以诱导短暂全脑缺血组织中HSP70的表达[13]。因此,我们推测17-AAG可能通过上调HSP70的表达来抑制氧糖剥夺复糖复氧模型(oxygenglucose deprivation and recovery,OGD/R)诱导的大鼠海马神经元凋亡。为验证此设想,本研究拟以大鼠海马神经元OGD/R为基础,探索17-AAG对神经元的保护作用以及HSP70在17-AAG发挥神经保护作用中的角色。
1 材料与方法
1.1 实验动物与试剂 出生1d的SD大鼠购自第三军医大学实验动物中心。DMEM培养基、无糖DMEM、胎牛血清和B27添加剂均购自美国Gibco公司,TUNEL试剂盒购自瑞士Roche公司,DAPI染色液和BCA蛋白测定试剂盒购自德国Sigma公司,兔抗大鼠HSP70和β-actin抗体以及山羊抗兔二抗均购自美国Abcam公司,大鼠HSP70干扰慢病毒购自世翱(上海)生物医药科技有限公司。
1.2 方法
1.2.1 大鼠海马神经元的培养 取出生1d内的SD大鼠,消毒后断头,用镊子分离海马区并剪碎,加入1ml胰酶(0.125%),在37℃条件下消化脑组织约20min,利用含10%血清的DMEM培养基终止消化10min,然后离心(1500r/min,3min),重悬沉淀后接种至培养皿中继续培养72h,加入终浓度为1×10-5mol/L的阿糖胞苷作用48h,此后每3d更换半量培养基。
1.2.2 OGD/R模型的建立 为在体外模拟脑缺血时神经元所处的病理条件,我们参考文献[15-16]中报道的方法建立OGD/R模型。首先将无糖DMEM放入缺氧舱(5%CO2,95%N2)内4h以上,然后将培养了12d的神经元中的培养基更换为上述已准备好的无糖DMEM培养基,最后放入缺氧舱中,置于37℃条件下分别氧糖剥夺0.5、1、2h,随后更换为正常培养基,在正常条件下继续培养24h。
1.2.3 实验分组和处理 实验一:为研究OGD/R对大鼠海马神经元凋亡的影响,将大鼠海马神经元分为对照组(Con组),即正常培养,不给任何干预;OGD/R (0.5h)组:即对细胞进行氧糖剥夺0.5h,复糖复氧培养24h;OGD/R(1h)组:即对细胞进行氧糖剥夺1h,复糖复氧24h);OGD/R (2h)组:即对细胞进行氧糖剥夺2h,复糖复氧24h。实验二:为研究17-AAG对OGD/R诱导的大鼠海马神经元凋亡的影响,将细胞分为DMSO组(对OGD/R模型细胞给予DMSO处理24h),17-AAG 0.5μmol/L组(对OGD/R模型细胞给予17-AAG 0.5μmol/L处理24h),17-AAG 1μmol/L组(对OGD/R模型细胞给予17-AAG 1μmol/L处理24h),以及17-AAG 2μmol/L组(对OGD/R模型细胞给予17-AAG 2μmol/L处理24h)。实验三:为探讨17-AAG对OGD/R处理后大鼠海马神经元中HSP70蛋白表达的影响,将细胞分成DMSO组,即正常培养,仅添加DMSO;OGD/R处理组,即对细胞氧糖剥夺1h、复糖复氧24h;OGD/R+17-AAG组,对细胞氧糖剥夺1h、复糖复氧24h,同时17-AAG 1μmol/L处理24h。实验四:为确认本研究构建的HSP70干扰对17-AAG+OGD/R联合处理条件下的大鼠海马神经元凋亡的影响,将细胞分成RNAi con组,即对细胞氧糖剥夺1h、复糖复氧24h,同时17-AAG 1μmol/L和RNAi对照联合处理24h;HSP70 RNAi组,即对细胞氧糖剥夺1h、复糖复氧24h,同时17-AAG 1μmol/L和HSP70 RNAi联合处理24h。
1.2.4 TUNEL实验 将按照分组处理的神经元先用PBS洗2次,然后通过4%的多聚甲醛固定25min,固定完毕后用PBS浸洗2次,然后利用含0.2% Triton X-100的PBS处理细胞3min,PBS浸洗,最后加入TUNEL染色液,在37℃条件下孵育1h,孵育完成后利用PBS洗4次,每次7min,再利用DAPI染核,PBS洗后加入含有抗荧光淬灭的封片液封片,荧光显微镜下观察。
1.2.5 Western blotting检测神经元中HSP70蛋白的表达 将按照分组处理的大鼠神经元细胞用PBS洗涤2次,收集细胞并离心,加入蛋白抽提裂解液处理8min;处理完毕后,用BCA蛋白浓度测定试剂盒进行蛋白定量;在蛋白样品中加入2×上样缓冲液,于沸水中变性。变性完成后,每孔上样100μg总蛋白,进行SDS-PAGE电泳、转膜;利用含5%脱脂奶粉的封闭液在室温条件下封闭1h;随后加入一抗,于4℃条件下过夜,TBST洗膜4次、每次10min;加入目的二抗,于37℃条件下孵育1h,TBST洗膜4次。最后利用ECL化学发光法进行显影,以β-actin作为内参进行蛋白相对表达量分析。
1.2.6 HSP70干扰 shRNA慢病毒载体构建从G e n B a n k中获得大鼠H S P 7 0基因序列信息(NM_031971.2),由世翱(上海)生物医药科技有限公司设计合成HSP70 shRNA序列:正向5'-CCGGG TCCTATGCCTTCAACATGAACTCGAGCATGTTG AAGGCATAGGACTCTTTTTTG-3',反向5'-AATTC AAAAAAGAGTCCTATGCCTTCAACATGCTCGAG TTCATGTTGAAGGCATAGGAC-3'。通过退火形成双链,再重组入已经线性化的载体LV-hU6-shRNACMV-EGFP中,经测序鉴定后利用293T细胞包装慢病毒颗粒,病毒经纯化、浓缩后进行滴度测定,并于–80℃冰箱中保存。
1.2.7 慢病毒感染大鼠海马神经元 将构建好的慢病毒颗粒按照不同感染复数(MOI)20、40、80感染神经元,感染12h后更换为新鲜培养基,继续培养72h后通过荧光显微镜观察细胞感染效率或进行后续的细胞处理。
1.3 统计学处理 采用SPSS 22.0软件进行分析。正态分布的计量资料以表示,两组间满足方差齐性条件下采用t检验进行分析;多组间在方差齐性基础上采用单因素方差分析(ANOVA),进一步两两比较采用Dunnettt检验。P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠海马神经元的培养情况 神经元分离后接种2h开始贴壁;12s后胞体饱满,呈锥体形、椭圆形、圆形、多边形,胞体延伸出大量突起。
2.2 OGD/R对大鼠海马神经元凋亡的影响TUNEL实验结果表明,神经元凋亡率在Con组为11.38%±4.59%,在OGD/R(0.5h)组为25.08%±2.96%,在OGD/R(1h)组为41.93%±3.90%,在OGD/R(2h)组为50.54%±4.39%。与Con组相比,氧糖剥夺1h和2h的神经元凋亡率均明显提高,且差异均有统计学意义(P<0.01,图1)。所以在后续实验中OGD/R选择氧糖剥夺1h、复糖复氧24h作为实验条件。
2.3 17-AAG对OGD/R诱导的大鼠海马神经元凋亡的影响 本研究通过TUNEL实验检测不同浓度(0.5、1、2μmol/L)的17-AAG对氧糖剥夺1h、复氧复糖24h处理后神经元凋亡的影响。结果显示,神经元凋亡率在DMSO组为46.31%±2.86%,在17-AAG 0.5μmol/L处理组为38.31%±3.02%、在17-AAG 1μmol/L处理组为22.22%±3.63%,在17-AAG 2μmol/L处理组为17.82%±1.58%。与DMSO组比较,3种浓度的17-AAG均能明显降低OGD/R诱导的大鼠海马神经元凋亡(图2),故在后续实验中选择1μmol/L作为17-AAG浓度处理神经元。
2.4 17-AAG对OGD/R诱导的大鼠海马神经元中HSP70表达的影响 Western blotting结果显示,DMSO组、OGD/R处理组和OGD/R+17-AAG组神经元中HSP70蛋白的相对表达量分别为1.33±0.09、0.22±0.03和0.46±0.05;与对照组相比,OGD/R处理组中HSP70蛋白相对表达量明显降低(P<0.01);与OGD/R组相比,OGD/R+17-AAG组神经元中HSP70蛋白相对表达量明显升高(P<0.01;图3)。
2.5 HSP70干扰慢病毒质粒测序鉴定 结果表明,测序获得的载体中干扰序列信息与设计合成的HSP70干扰慢病毒质粒靶点信息完全一致(图4)。
2.6 HSP70干扰慢病毒最佳感染复数筛选 本研究利用不同MOI值的病毒感染大鼠神经元以筛选最佳的病毒与细胞比例。荧光显微镜观察结果表明当MOI=80时,慢病毒对神经元的感染效率最高(图5)。
2.7 HSP70干扰逆转17-AAG对OGD/R诱导的大鼠海马神经元的保护作用 Western blotting结果表明,RNAi con组和HSP70 RNAi组大鼠海马神经元中HSP70的相对表达分别为0.45±0.04和0.17±0.02。与RNAi con组相比,HSP70 RNAi组HSP70的表达明显下调(P<0.01,图6)。同时,本研究通过TUNEL实验进一步检测HSP70干扰对17-AAG+OGD/R处理条件下的大鼠海马神经元凋亡的影响,结果显示,HSP70 RNAi组大鼠海马神经元凋亡率(42.64%±3.84%)明显高于RNAi con组(11.31%±1.92%,P<0.01,图7)。

图1 OGD/R诱导大鼠海马神经元凋亡(TUNEL ×200,n=3)Fig.1 OGD/R induced rat hippocampal neurons apoptosis (TUNEL ×200, n=3)

图2 17-AAG抑制OGD/R诱导的大鼠海马神经元凋亡 (TUNEL ×200,n=3)Fig.2 17-AAG suppressed rat hippocampal neurons apoptosis induced by OGD/R (TUNEL ×200, n=3)

图3 17-AAG对OGD/R诱导的大鼠海马神经元中HSP70表达的影响(Western blotting,n=3)Fig.3 The effect of 17-AAG on the expression of HSP70 protein in rat hippocampal neurons treated with OGD/R (Western blotting, n=3)

图4 测序结果Fig.4 Sequencing results

图5 慢病毒感染的大鼠海马神经元(荧光显微镜×200)Fig.5 Rat hippocampal neurons infected by lentivirus (Fluorescence microscope ×200)

图6 HSP70干扰抑制17-AAG+OGD/R处理组大鼠海马神经元中HSP70的表达(Western blotting,n=3)Fig.6 HSP70 protein was down-regulated by HSP70 RNAi in rat hippocampal neurons treated with 17-AAG and OGD/R(Western blotting, n=3)
3 讨 论
目前,脑缺血已成为严重危害我国居民生命和健康的疾病之一。缺血再灌注后引发氧化应激、炎症反应等级联反应,最终引起神经元的损伤和死亡,从而导致神经功能和行为障碍[17]。因此,抑制神经元的不可逆死亡有望改善脑缺血患者的神经功能。
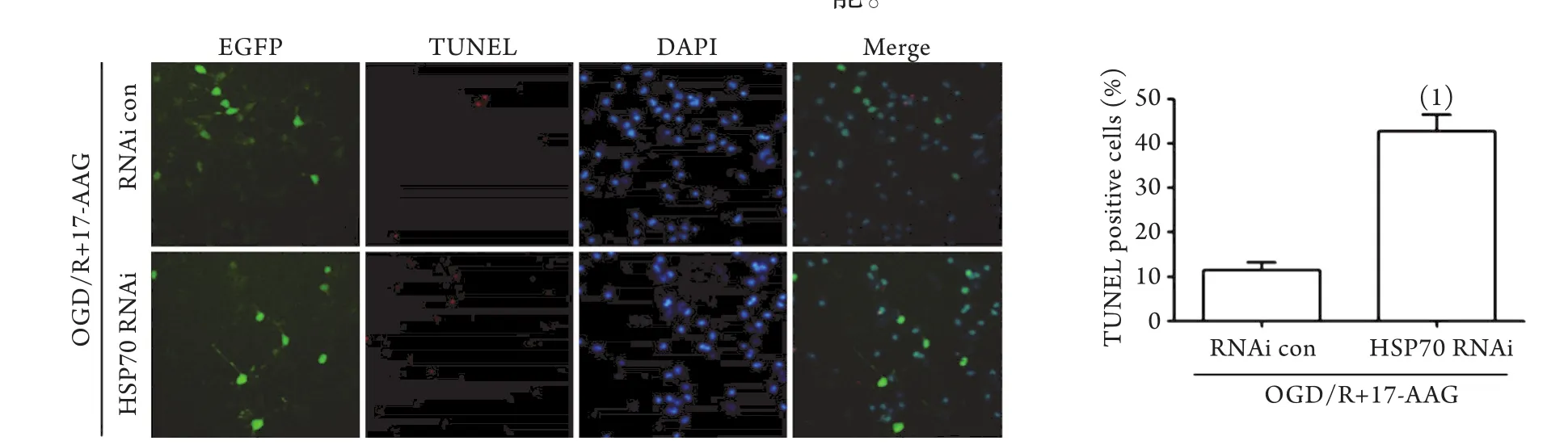
图7 HSP70干扰提高17-AAG+OGD/R处理组大鼠海马神经元的凋亡率(TUNEL ×200,n=3)Fig.7 HSP70 RNAi induced the apoptosis of rat hippocampal neurons treated with 17-AAG and OGD/R (TUNEL ×200, n=3)
在既往短暂全脑缺血动物实验中,我们发现17-AAG可以明显抑制大鼠海马神经元凋亡,减少脑梗死体积,改善大鼠的学习和记忆能力,有望成为脑缺血后抑制神经损伤的有效药物[14]。为了进一步证明17-AAG在神经保护中的作用,本研究通过体外培养大鼠海马神经元构建OGD/R模型模拟在体脑缺血再灌注损伤。首先,在实验中我们选择了3个氧糖剥夺的时间点,即0.5、1、2h,然后再灌注24h,利用TUNEL免疫荧光实验检测各组神经元的凋亡情况。结果表明,氧糖剥夺时间为1h和2h时,神经元的凋亡率均明显升高。Wang等[15,18]的研究表明,体外培养的神经元在氧糖剥夺2h后复糖复氧24h细胞凋亡明显增加,这说明本研究构建的OGD/R模型是成功的。最后,我们将后续研究采用的OGD/R参数确定为氧糖剥夺1h、复糖复氧24h。同时,我们通过TUNEL检测了不同浓度的17-AAG对OGD/R诱导的神经元凋亡的影响。结果表明,0.5、1、2μmol/L 3种浓度的17-AAG均能抑制OGD/R诱导的神经元凋亡,且浓度越高抑制效果越明显。这与本课题组前期在动物实验中发现的结果一致。因此,本研究在体外实验中获得的结果进一步证明了17-AAG在神经保护中的作用。但是,17-AAG发挥神经保护作用的机制仍不清楚,还须进一步深入研究。
既往报道HSP70可以通过调节细胞死亡信号影响细胞的存活[19-20]。在创伤性脑缺血动物模型和细胞模型中,HSP70已被证明具有神经保护作用[21-23]。在既往短暂全脑缺血动物实验中,我们也发现17-AAG可以诱导缺血区HSP70蛋白的表达[14]。同时,在本研究中,我们发现OGD/R明显抑制神经元细胞中HSP70蛋白的表达,而17-AAG可以诱导OGD/R处理的神经元细胞中HSP70蛋白的表达。因此,我们推测HSP70在17-AAG抑制OGD/R诱导的神经元凋亡中扮演重要角色。为了验证我们的推断,本研究构建了HSP70 RNA干扰慢病毒,抑制17-AAG+OGD/R处理条件下神经元中HSP70的表达。TUNEL实验结果表明,HSP70干扰逆转了17-AAG对OGD/R处理的神经元凋亡的保护作用,这说明HSP70确实在17-AAG诱导的神经保护中具有重要作用。
综上所述,本研究表明17-AAG可以通过上调HSP70的表达来抑制OGD/R诱导的神经元凋亡,为脑缺血性损伤的治疗提供了新的潜在药物和靶点。
【参考文献】
[1]Livesay SL. Clinical review and implications of the guideline for the early management of patients with acute ischemic stroke[J].Aacn Adv Crit Care, 2014, 25(2):130-141.
[2]Kim T, Vemuganti R. Mechanisms of Parkinson's disease-related proteins in mediating secondary brain damage after cerebral ischemia[J]. J Cereb Blood Flow Metab, 2017, 37(6):1910-1926.
[3]Guo MF, Yu JZ, Ma CG. Mechanisms related to neuron injury and death in cerebral hypoxic ischaemia[J]. Folia Neuropathologica, 2011, 49(2): 78-87.
[4]Li J, Tian T, Shi ZH,et al. Clinical distribution characteristics and analysis on risk factors of carotid vulnerable plaque in patients with acute ischemic stroke[J]. Med J Chin PLA, 2016,41(9): 740-745. [栗静, 田婷, 石正洪, 等. 急性缺血性卒中患者颈动脉易损性斑块的临床分布特点及危险因素分析[J].解放军医学杂志, 2016, 41(9): 740-745.]
[5]Emberson J, Lees KR, Lyden P,et al. Effect of treatment delay, age, and stroke severity on the effects of intravenous thrombolysis with alteplase for acute ischaemic stroke: a metaanalysis of individual patient data from randomised trials[J].Lancet, 2014, 384(9958):1929-1935.
[6]Lees KR, Bluhmki E, von Kummer R,et al. Time to treatment with intravenous alteplase and outcome in stroke: an updated pooled analysis of ECASS, ATLANTIS, NINDS, and EPITHET trials[J]. Lancet, 2010, 375(9727): 1695-1703.
[7]Li J, Tian T, Shi ZH,et al. Correlation of fibrinogen, C-reactive protein and homocysteine with the carotid vulnerable plaque in patients with large artery atherosclerosis stroke[J]. Med J Chin PLA, 2017, 42(1): 41-46. [栗静, 田婷, 石正洪, 等. 纤维蛋白原、C反应蛋白及同型半胱氨酸与大动脉粥样硬化型卒中患者颈动脉易损性斑块的相关性分析[J]. 解放军医学杂志,2017, 42(1): 41-46.]
[8]Zhao X, Wang J, Xiao L,et al. Effects of 17-AAG on the cell cycle and apoptosis of H446 cells and the associated mechanisms[J].Mol Med Rep, 2016, 14(2):1067-1074.
[9]Sidera K, Patsavoudi E. HSP90 inhibitors: current development and potential in cancer therapy[J]. Recent Pat Anticancer Drug Discov, 2014, 9(1): 1-20.
[10]Zhang J, Zheng Z, Zhao Y,et al. The heat shock protein 90 inhibitor 17-AAG suppresses growth and induces apoptosis in human cholangiocarcinoma cells[J]. Clin Exp Med, 2013, 13(4):323-328.
[11]Gu Y, Chen J, Wang T,et al. HSP70 inducer, 17-allylaminodemethoxygeldanamycin, provides neuroprotectionviaantiinflammatory effects in a rat model of traumatic brain injury[J].Exp Ther Med, 2016, 12(6): 3767-3772.
[12]Ma L, Li Z, Liu Z,et al. 17AAG improves histological and functional outcomes in a rat CCI model through autophagy activation and apoptosis attenuation[J]. Neurosci Lett, 2015,599:1-6.
[13]Kim N, Kim JY, Yenari MA. Pharmacological induction of the 70-kDa heat shock protein protects against brain injury[J].Neuroscience, 2015, 284: 912-919.
[14]Li J, Yang F, Guo J,et al. 17-AAG post-treatment ameliorates memory impairment and hippocampal CA1 neuronal autophagic death induced by transient global cerebral ischemia[J].Brain Res, 2015, 1610: 80-88.
[15]Wang P, Xu TY, Wei K,et al. ARRB1/β-arrestin-1 mediates neuroprotection through coordination of BECN1-dependent autophagy in cerebral ischemia[J]. Autophagy, 2014, 10(9):1535-1548.
[16]Gong G, Yuan L, Cai L,et al. Tetramethylpyrazine suppresses transient oxygen-glucose deprivation-induced connexin32 expression and cell apoptosisviathe ERK1/2 and p38 MAPK pathway in cultured hippocampal neurons[J]. PLoS One, 2014,9(9): e105944.
[17]Doyle KP, Simon RP, Stenzel-Poore MP. Mechanisms of ischemic brain damage[J]. Neuropharmacology, 2008, 55(3): 310-318.
[18]Wang P, Guan YF, Du H,et al. Induction of autophagy contributes to the neuroprotection of nicotinamide phosphoribosyl transferase in cerebral ischemia[J]. Autophagy,2012, 8(1): 77-87.
[19]Yenari MA, Liu J, Zheng Z,et al. Antiapoptotic and antiinflammatory mechanisms of heat-shock protein protection[J].Ann N Y Acad Sci, 2005, 1053: 74-83.
[20]Kim JY, Kim N, Zheng Z,et al. 70-kDa Heat shock protein downregulates dynamin in experimental stroke: a new therapeutic target?[J]. Stroke, 2016, 47(8): 2103-2111.
[21]Hoehn B, Ringer TM, Xu L,et al. Overexpression of HSP72 after induction of experimental stroke protects neurons from ischemic damage[J]. J Cereb Blood Flow Metab, 2001, 21(11): 1303-1309.
[22]Alani B, Salehi R, Sadeghi P,et al. Silencing of HSP70 intensifies 6-OHDA-induced apoptosis and Hsp90 upregulation in PC12 cells[J]. J Mol Neurosci, 2015, 55(1): 174-183.
[23]Yamamoto Y, Koma H, Nishii S,et al. Anti-heat shock 70kDa protein antibody induced neuronal cell death[J]. Biol Pharm Bull, 2017, 40(4): 402-412.

