FGF9和CHIR99021诱导胚胎干细胞形成肾脏样结构
肖枫林,王圣元,李明旭*
(中国人民解放军海军总医院 1.肾脏病科; 2.高压氧科, 北京 100048)
肾脏起源于中胚层,输尿管芽(ureteric bud,UB)与后肾间充质(metanephric mesenchyme,MM)相互作用:UB形成输尿管树,从而产生集合管、肾盂和输尿管, 而MM产生肾单位[1]。迄今已证明成纤维细胞生长因子9(fibroblast growth factor 9,FGF9)刺激早期原始条纹形成UB,而CHIR99021刺激晚期原始条纹形成MM[2]。为在体外形成肾脏样结构,需利用上述细胞因子诱导干细胞分化,模拟体内发育过程。
ESCs能产生所有3个胚层,适于功能性人肾细胞和组织的产生[3],已有研究证实ESCs可在体外分化为UB或MM[4-8]。ESCs易于从肾脏病患者体内直接获取,可作为其特异性模型[9]。利用ESCs产生的肾脏祖细胞拥有与体内肾脏祖细胞同样的发育潜能:形成肾小囊并自发形成肾单位[10]。因此,ESCs是体外再生医学和疾病建模的重要工具,故本研究使用细胞因子诱导ESCs分化形成肾脏样结构。
1 材料与方法
1.1 材料
1.1.1 实验细胞:ESCs细胞系H9(北京赛贝生物技术有限公司)。
1.1.2 主要试剂:Matrigel基质胶、PSC-Easy培养基、PSC-Easy解冻液和PSC-Easy传代工作液(北京赛贝生物技术有限公司);CHIR99021、FGF-9 (R&D公司);APEL培养基、抗生素-抗真菌试剂(Life Technologies公司);PBS磷酸盐缓冲液(1×)(Thermo Fisher Scientific公司);肝素 (Sigma-Aldrich公司)。
1.2 方法
1.2.1 肾脏样结构的形成:培养阶段:在细胞培养皿的表面铺上matrigel基质胶作为细胞外基质,利用PSC-Easy培养基将ESCs在基质胶表面培养(37 ℃细胞培养箱中)。正常情况下2~3 d后细胞可达40%~50%汇合度,开始分化阶段。
1.2.2 分化阶段一(细胞培养皿上):弃去PSC-Easy培养基,换为APEL培养基(含8 μmol/L 因子CHIR99021)培养4 d,每1~2 d更换此培养基。4 d后更换为APEL培养基(含1 μg/mL肝素+200 ng/mL因子FGF9)培养3 d,每1~2 d更换此培养基。
收集细胞并离心:使用PSC-Easy传代工作液消化细胞,400×g离心3 min,用纯APEL培养基重悬细胞,然后进行细胞计数,取约5×105个细胞转移至1.5 mL离心管。再次400×g离心2 min,弃上清,剩1个细胞球,将其置于Transwell透明膜上。
分化阶段二(Transwell透明膜上):利用APEL培养基(含5 μmol/L因子CHIR99021)在37 ℃培养1 h,然后弃去培养基并换为APEL培养基(含1 μg/mL肝素+ 200 ng/mL因子FGF9)培养5 d,每1~2 d更换此培养基。此后换为不含细胞因子的纯APEL培养基,并继续培养6~13 d,每1~2 d更换纯APEL培养基。光镜下观察并成像,收集细胞球继续进一步实验。
1.2.3 免疫荧光染色:对细胞球依次使用4%多聚甲醛在4 ℃下固定30 min,PBS洗3次。使用0.1% Triton X-100在室温下放置20 min,PBS洗3次。使用5% BSA在室温下放置20 min。按1∶100~1∶200稀释一抗,每孔加100 μL,4 ℃孵育过夜,室温回暖30 min,PBS洗3次。按1∶100~1∶400稀释二抗,每孔加100 μL,室温避光放置1 h,PBS洗3次。加入DAPI,观察荧光并成像。
1.2.4 电镜检查:细胞球经5%戊二醛、2%锇酸固定,梯度乙醇脱水,环氧树脂包埋,超薄切片,在60 ℃下封闭、固化12 h,电镜下观察并成像。
2 结果
2.1 细胞培养情况
在matrigel基质胶表面上培养ESCs的倍增时间约2~3 d(图1)。
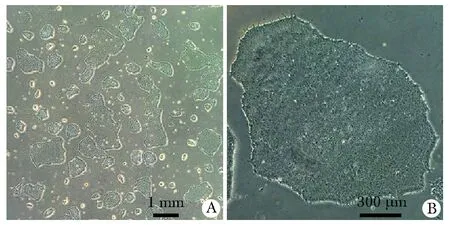
A.confluence of ESCs reached 40%-50%; B.morphology of ESCs
2.2 利用ESCs构建的类肾体形态
细胞球制作完成后的外观(图2),利用ESCs分化形成的细胞球直径约10 mm。细胞球的光镜下形态(图3),可见细胞球内部发育出肾小球、肾小管等肾脏样结构。

图2 利用ESCs分化形成的细胞球直径约10 mmFig 2 Diameter of multicellular clusters is about 10 mm
2.3 免疫荧光染色检查结果
在细胞球中,可见到肾小球(WT1+)、远端小管(ECAD+)的荧光标志物,荧光显微镜下可见细胞球内发育出肾脏样的复杂组织结构。在人类肾脏中,上皮细胞包裹在肾间质内,其内含有血管网络。在利用ESCs分化形成的细胞球中也能观察到血管网络(CD31)包绕在近端小管(LTL+)周围(图4)。
2.4 电镜检查结果
电镜检查见细胞球内部形成以开放腔为特征的肾小管样结构,而且可见肾小管上皮细胞特征性的短微绒毛(microvilli, m)以及细胞间紧密连接(tight junctions, tj)等结构(图5)。

A, B.cell morphology of the differentiation stage one of ESCs(×4, ×40); C, D.ESCs differentiation stage two, forming the kidney-like structure(×4,×40)
3 讨论
迄今已有研究利用干细胞分化为肾脏细胞[2, 11]。

图4 肾脏样结构的免疫荧光检查结果Fig 4 Immunofluorescence staining images of the kidney-like structure
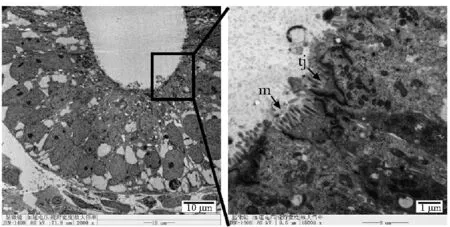
图5 肾脏样结构的电镜检查结果Fig 5 Electron microscopic examination of kidney like structure
肾由肾单位、血管、肾间质中的许多不同细胞类型组成。肾单位是肾脏的功能性结构,由负责过滤的肾小球以及负责重吸收和分泌大量溶质及重吸收水分的分段肾小管组成。肾单位的损失是慢性肾脏病(chronic kidney disease, CKD)的特征,最终导致终末期肾病(end-stage kidney disease, ESKD)。因此,体外生成有功能的肾脏最重要的是有效地利用干细胞产生肾单位。肾单位形成复杂的三维结构而发挥作用。为了在体外建立此类结构,需要有三维培养系统。肾脏样结构是在培养皿中模拟体内器官结构和功能而形成的三维器官组织。目前还没有明确利用干细胞体外形成的肾脏样结构应该包含多少种细胞类型,但公认的研究方法需具备如下特征:1)三维结构;2)多细胞组成;3)细胞自发形成组织;4)体外培养成功。
迄今已证明多种生长因子在干细胞向肾系细胞的分化发育中起关键作用。CHIR99021因子调控后肾间充质的分化比例,并决定肾单位的分化比例;FGF9因子调控输尿管上皮的分化比例,并决定集合管及输尿管的分化比例。本研究通过细胞因子调控胚胎干细胞的分化,在体外形成肾脏样结构。免疫荧光检查见此结构可以表达肾单位各部分的标志物。电镜检查见含有典型的短微绒毛、紧密连接等结构的肾小管。
利用干细胞在体外分化形成肾脏样结构,最重要的应用是建立体外模型,研究人类疾病的机制以及寻找新的治疗方法。此方法可以对大量化学物质进行药物筛选以找到新的候选治疗药物,而这在样本数量有限的动物研究中难以实现。目前已知的遗传性肾病有160多种[12],但是目前能用于寻找遗传性肾病新疗法的疾病模型很少。因此,体外形成的肾脏样结构是一种有潜力的研究人类遗传性肾病机制的方法。
未来,在利用干细胞建立肾脏疾病模型方面无疑会有更多研究方向。除了遗传性肾脏疾病以外,还可以利用干细胞建立其他更常见疾病的疾病模型、作为新型疗法最终应用于人体。但为了完善这种方法,仍需要在细胞分化流程、遗传背景和表观遗传变异等方面进行深入研究。
:
[1] Saxen L, Sariola H. Early organogenesis of the kidney[J]. Pediatr Nephrol (Berlin), 1987,1:385-392.
[2] Takasato M, Er PX, Chiu HS,etal. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis[J]. Nature, 2015,526:564- 568.
[3] Thomson JA, Itskovitz-Eldor J, Shapiro SS,etal. Embryonic stem cell lines derived from human blastocysts[J]. Science (New York), 1998,282:1145- 1147.
[4] Mae S, Shono A, Shiota F,etal. Monitoring and robust induction of nephrogenic intermediate mesoderm from human pluripotent stem cells[J]. Nat Commun, 2013,4:1367.doi:10.1038/ncomms2378.
[5] Xia Y, Nivet E, Sancho-Martinez I,etal. Directed differentiation of human pluripotent cells to ureteric bud kidney progenitor-like cells[J]. Nat Cell Biol, 2013,15:1507- 1515.
[6] Taguchi A, Kaku Y, Ohmori T,etal. Redefining theinvivoorigin of metanephric nephron progenitors enables generation of complex kidney structures from pluripotent stem cells[J]. Cell Stem Cell, 2014,14:53- 67.
[7] Kang M, Han YM. Differentiation of human pluripotent stem cells into nephron progenitor cells in a serum and feeder free system[J]. PLoS One, 2014,9:e94888. doi: 10.1371/journal.pone.0094888. eCollection 2014.
[8] Lam AQ, Freedman BS, Morizane R,etal. Rapid and efficient differentiation of human pluripotent stem cells into intermediate mesoderm that forms tubules expressing kidney proximal tubular markers[J]. J Am Society Nephrol, 2014,25:1211- 1225.
[9] Takahashi K, Tanabe K, Ohnuki M,etal. Induction of pluripotent stem cells from adult human fibroblasts by defined factors[J]. Cell, 2007,131:861- 872.
[10] Morizane R, Lam AQ, Freedman BS,etal. Nephron organoids derived from human pluripotent stem cells model kidney development and injury[J]. Nat Biotechnol, 2015,33:1193- 1200.
[11] Ciampi O, Iacone R, Longaretti L,etal. Generation of functional podocytes from human induced pluripotent stem cells[J]. Stem Cell Res, 2016,17:130-139.
[12] Devuyst O, Knoers NV, Remuzzi G,etal. Rare inherited kidney diseases: challenges, opportunities, and perspectives[J]. Lancet (London), 2014,383:1844- 1859.

