从晶胞结构层面谈创新姚
■郑州外国语学校 姚卫民
自2006年江苏卷率先在选择题里出现晶胞结构以来,各种晶胞结构陆续在全国及各省市高考题中出现。有关晶体的部分可谓是年年创新,下面我们分别从以下几个方面举例探究。
一、晶胞中原子的位置互换
例1钙钛矿结构材料广泛应用于压电、超导、催化、磁电阻等领域。回答下列问题:
(1)元素钙的焰色反应呈砖红色,其中红色对应的辐射波长为____nm(填标号)。
A.324.7 B.404.4 C.460.7
D.553.5 E.657.3
(2)基态Ca原子中,核外电子占据的第三层符号是____,占据该能层最高能级电子的电子云轮廓形状为____。Ti和Cu属于同一周期,Ti的原子半径大于Cu的,但金属Ti的熔沸点比Cu的高,说明金属的熔沸点与金属原子半径、____和晶体结构中原子堆积方式等因素有关。
(3)被誉为“生命元素”的元素Se和Ca处于同一周期,我国科学家尝试用Na2SeO3清除人体内的活性氧,离子的几何构型为____,中心原子的杂化类型为____。
(4)钙钛矿晶胞为立方结构,边长为anm,晶胞中Ti、Ca、O分别处于顶角、体心、棱中心位置,如图1所示。Ca与O间最短距离为____nm,与Ti紧邻的O的个数为____。

图1
(5)在钙钛矿晶胞结构的另一种表示中,Ca处于各顶角位置,则Ti处于____位置,O处于____位置。
答案:(1)E
(2)M 哑铃形(或纺锤形) 金属原子的价电子结构
(3)三角锥形 sp3杂化
(4)a6
(5)体心 面心
分析:在高中课本中主要介绍了四种晶胞类型:简单立方晶胞、体心立方晶胞、面心立方晶胞和六方晶胞,对于离子晶体晶胞类型也只是提到CsCl型、NaCl型、ZnS型、CaF2型等四种类型,并没有讲过钙钛矿型,当然高考并没有超纲,这恰恰是高考源于课本又高于课本的体现,是对考生处理未知信息能力的考查。然而站在考生的角度,如何去做这种题呢?其实仔细研究不难发现,钙钛矿晶胞结构其实是把CsCl型晶胞和NaCl型晶胞嵌套在一起形成的。所以此题其实是在变相考查考生对CsCl型晶胞和NaCl型晶胞特点的掌握情况。
新编题:(1)F-与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,结构如图2所示。晶胞边长为anm,晶胞中Mg2+、K+、F-分别处于顶角、体心、棱中心位置。该晶体的化学式为____,与K+紧邻的F-的个数为____。

图2
(2)在该离子晶胞结构的另一种表示中,F-处于各顶角和部分面心位置,则Mg2+处于____位置,K+处于____位置。
答案:(1)KMgF312(2)棱中心面心
二、原子坐标
例2(1)Na+与Ne互为等电子体,电离能I2(Na)___I1(Ne)(填 “<”“=”或“>”)。
(2)第四周期中,与Al原子未成对电子数相同的金属元素有____种。气态氯化铝的分子组成为(AlCl3)2,分子中所含的化学键类型有____,Al原子的杂化方式为____。
(3)可燃冰是天然气水合物,具有笼形结构如图3(表面的小球是水分子,内部的大球是甲烷分子)。水分子成笼的作用力是____,图3中最小的环中连接的原子总数是____。可燃冰晶体具有多种笼状结构,其中一种由1个图3所示笼分别用2个面与另外两个相同的笼共面而成,则中间笼实际占有____个水分子。

图3
(4)金属镁晶体中原子的堆积方式为六方最密堆积,如图4所示,晶胞可用图5表示。设金属镁的原子半径为acm,晶胞的高为bcm,则该晶体的空间利用率为____(写出计算式);设晶胞中A点原子的坐标为(0,0,0),C点原子的坐标为(2a,0,0),D点原子的坐标为(0,0,b),则B点原子的坐标为____。
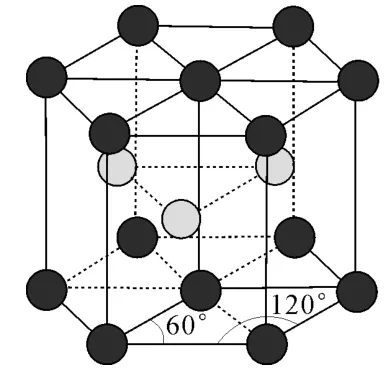
图4

图5
答案:(1)> (2)4共价键、配位键sp3(3)氢键 1015 (4)× 100%
分析:从历年各省份高考题来看,还从未考查过有关六方晶胞中的距离、空间占有率以及晶胞参数。这可能成为未来晶体结构出题的一个重要方向。
三、粒子填隙和替换
粒子填隙和替换,是晶体结构丰富多样的原因之一。
例3研究发现,在CO2低压合成甲醇反应(CO2+3H2══CH3OH+H2O)中,CO氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)CO基态原子核外电子排布式为____。元素Mn与O中,第一电离能较大的是____,基态原子核外未成对电子数较多的是____。
(2)CO2和CH3OH分子中C原子的杂化形式分别为____和____。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为____,原因是____。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在____。
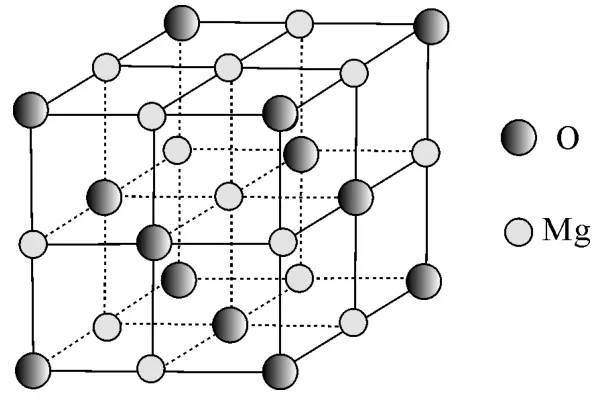
图6
(5)MgO具有NaCl型结构(如图6),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为____nm。MnO也属于NaCl型结构,晶胞参数为a'=0.448nm,则r(Mn2+)为____nm。
答案:(1)1s22s22p63s23p63d74s2或[Ar]3d74s2OMn
(2)sp sp3
(3)H2O>CH3OH>CO2>H2H2O与CH3OH均为极性分子,H2O中氢键比甲醇多;CO2与H2均为非极性分子,CO2分子量较大,范德华力较大
(4)离子键和π键
(5)0.1480.076
分析:在离子晶体中,一般阴离子体积比阳离子的大,所以离子晶体的形成,一般看成阴离子先密堆积,然后阳离子来填充阴离子堆积所形成的空隙。而只有当正、负离子完全紧密接触时,晶体才是稳定的。在不同构型的离子晶体中,要使正负离子完全接触,则正负离子的半径比值必须满足一定的条件,如表1所示。这也是离子晶体比较多变的原因之一。所以这方面应该引起我们的关注和深入研究。
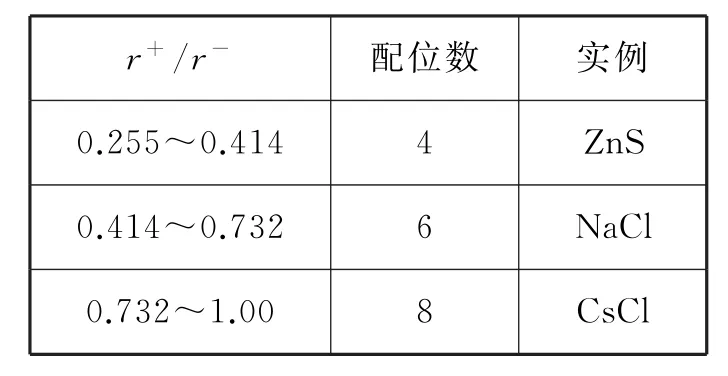
表1
填隙又分为恰好填隙(不改变原有阴离子的最密堆积)和填隙之后使阴离子相离两种情况。例3就是在考查这两种情况。从空隙对称性来看,简单立方、面心立方和六方晶胞的空隙都是对称性的,而体心立方空隙是不规则的,所以通常对具有对称性空隙晶体的考查较多。简单立方填隙为CsCl型晶胞,面心立方填隙分别得到NaCl型晶胞、立方ZnS型晶胞和CaF2型晶胞,六方晶胞填隙能得到六方ZnS型晶胞。
总结:化学的创新实质上就是通过一个新颖的载体,把知识有机地结合到一起,从而达到考查认知的目的。从上述例题分析来看,结合近几年出题类型,无论是创新题还是改编题,无论是原子坐标还是原子互换,其实都是对课本知识的深入挖掘,有的甚至能在大学无机化学教材里找到出处。不只是晶体部分,很多其他的创新题也很多来源于大学课本或是文献,这充分体现了对考生读题能力,对陌生信息处理能力的考查。所以要想创新必须深入研究课本知识,特别是大学教材,找到其与高中课本知识相衔接的地方,巧妙设计,融为一体。

