转录组测序筛选牛卵泡发育相关基因及其表达差异分析
李鹏飞,孟金柱,景炅婕,毕锡麟,王锴,朱芷葳,吕丽华
转录组测序筛选牛卵泡发育相关基因及其表达差异分析
李鹏飞1,孟金柱2,景炅婕3,毕锡麟3,王锴3,朱芷葳1,吕丽华3
(1山西农业大学生命科学学院,山西太谷 030801;2铜仁学院乌江学院,贵州铜仁 554300;3山西农业大学动物科技学院,山西太谷 030801)
【目的】通过不同生理状态牛卵泡高通量测序筛选与卵泡发育相关的基因。【方法】母牛同期发情后,B超声波连续监测并适时采集第一卵泡波出现偏差前的最大卵泡(the largest follicle at predeviation,PDF1)和第二大卵泡(the second largest follicle at predeviation,PDF2),构建RNA文库后Illumina平台测序,经数据库比对,设定参数筛选高表达基因、差异表达基因并进行GO分析,Genecards基因功能查询进一步筛选与卵泡发育直接相关的调控基因,qRT-PCR对筛选的基因进行表达量验证分析。【结果】两个转录本中共获得263个差异表达基因;GO功能聚类分析共分为三大类90组:其中生物学过程占64.4%,细胞组分占17.8%,分子功能占17.8%;获得一些重要的功能富集通路,如调控信号转导和细胞因子应答的生物途径;基因表达量分析筛选出10个高表达的上调和下调基因,获得参与雌激素合成和胎儿性别发育的、参与类固醇激素合成的、细胞发育过程中调节细胞凋亡的以及调节ERK和MEK1/2信号通路的。Genecards功能查询共获得6个基因与卵泡发育关系较为密切,其中上调基因分别为;下调基因为和;qRT-PCR结果显示,和在DF中的表达量显著高于SF(<0.05),在SF中的表达量极显著高于DF(<0.01),和在DF和SF中的表达量不存在显著差异(>0.05),但其表达变化趋势与高通量测序结果相一致。【结论】转录组测序结果真实可靠,和在卵泡发育过程中发挥正调控作用,在卵泡发育过程中发挥负调控作用,获得的牛卵泡发育相关基因和重要调节途径,对后期深入探讨卵泡发育调控机理的研究具有重要意义。
牛;卵泡;转录组;PDF1;PDF2;发育
0 引言
【研究意义】卵泡发育是一个复杂的生理过程,受动物遗传、体况、内分泌激素和卵泡内生长因子等多方面因素的综合调控。目前,对卵泡发育影响的研究多集中在单胎动物上,基因组测序技术的发展,为其生物学研究提供了更全面、便利的平台。本研究通过对不同生理状态牛卵泡的高通量测序来筛选与卵泡发育相关的基因,对全面分析牛卵泡发育的关键调控因子具有重要意义,同时为阐明牛卵泡发育的调控机理奠定基础。【前人研究进展】在卵泡发育过程中,基因转录和蛋白表达等一系列关键事件是通过特定基因顺序表达基础上完成的,是调控卵泡募集、选择及卵泡细胞凋亡的内在因素[1]。因此,研究者通过基因芯片和新一代高通量测序技术对影响动物卵泡发育的相关调控基因展开了研究,TERENINA等[2]通过基因芯片技术对猪闭锁卵泡和健康卵泡颗粒细胞(granulesa cells, GCs)全基因表达谱进行分析,共发现1 684个差异表达的调控基因,其中两个转录组共有287个高表达基因,有11个差异表达基因(和)可能是卵泡闭锁的标记基因。TICIANELLI等[3]对不同品种牛和不同应激温度处理组卵泡的卵母细胞、卵丘细胞进行转录组分析,共获得127个卵泡发育相关基因,qRT-PCR检测发现在荷斯坦奶牛卵泡细胞中表达显著上调,促凋亡基因和膜转运基因则显著下调。课题组前期也通过Illumina测序平台对牛第一卵泡波的最大卵泡(PDF1)和出现优势化的最大卵泡ODF1进行转录组测序,获得的83个差异表达基因中,有42个属于上调基因,41个属于下调基因,其中和被认为是与牛卵泡发育密切相关,如和直接参与类固醇激素的生物合成[4]。【本研究切入点】PDF1和第一卵泡波的第二大卵泡(PDF2)是牛卵泡发育波中具有显著生理特征的两个发育阶段,随着卵泡的进一步发育,PDF1最终可能出现优势化进而成为优势卵泡(dominant follicles, DF),而PDF2卵泡必将成为从属卵泡(subordinate follicles, SF),本研究以牛第一卵泡波PDF1和PDF2作为研究对象筛选卵泡发育相关基因,并通过qRT-PCR交叉检测DF和SF中这些基因的表达谱,具有可靠的理论依据。【拟解决的关键问题】试验中运用转录组测序技术、qRT-PCR技术研究影响牛卵泡发育的调控基因,并从功能上进行验证分析,提高了卵泡发育基因筛选的准确性。
1 材料与方法
1.1 试验动物及样品采集
选取8头10月龄海福特青年母牛(2013年9月),同期发情(前列腺素F2α)处理后,B超声波监测并记录卵泡的生长状况,山西省文水县胡兰镇肉牛屠宰厂屠宰并采集第一卵泡波优势化前的PDF1(直径6—8 mm)和PDF2(直径5—6 mm),该阶段的卵泡处于发情开始5 d内[5-6]。qRT-PCR试验中DF和SF的采集通过卵泡黄体形态观察和雌激素/孕酮比值进行确定,具体方法参照课题组前期研究[7]。采集后的双侧卵巢放入灭菌的DPBS中,实验室分离GCs。
1.2 试验方法
1.2.1 Illumina平台测序 分离PDF1和PDF2卵泡GCs,提取总RNA后Illumina平台对PDF1和PDF2转录组测序,具体方法参照课题组前期研究[4, 8]。
1.2.2 差异表达基因的筛选及GO分析 参照AUDIC等[9]的算法,将Illumina平台对PDF1和PDF2测序得到的结果进行数据库比对,设定RPKM≥0.5,获得有意义的表达基因;设定参数:PDF1 RPKM /PDF2 RPKM>2及PDF2 RPKM /PDF1 RPKM>2,FDR校正的-value<0.05,获得差异表达基因;应用DAVID v6.8对获得的差异表达基因进行GO(Gene ontology)功能显著性富集分析(-value<0.05),Excel作图。
1.2.3 反转录及引物设计 提取DF和SF颗粒细胞总RNA,反转录反应条件为:7℃15 min,85℃5 s,-20℃保存;参考NCBI上提交的()各基因的序列,Primer 3.0设计引物(表1),将作为内参基因,引物合成由北京六合华大完成。

表1 荧光定量引物
1.2.4 qRT-PCR检测 依据qRT-PCR检测技术要求,数据需经内参基因校正、物理校正和重复校正,扩增前先制作标准曲线。根据标准曲线和不同基因的扩增条件进行qRT-PCR反应,构建20 μL反应体系,试验流程参照qRT-PCR说明书进行;反应条件:95℃变性10 s,95℃5 s,60℃25 s,40个循环。
1.3 统计分析
采用△△CT法计算各目的基因的相对表达量,各基因的相对表达水平=2–△△CT。结果采用均值±标准差表示,各基因的表达量经内参基因0表达量校正,设定在DF的表达量作为对照组[10],实验数据运用SPSS(V 18.0)统计软件进行t检验分析。
2 结果
2.1 高表达基因筛选
将Illumina平台对PDF1和PDF2测序得到的结果进行数据库比对,设定RPKM≥0.5,共获得15 760个基因,表2中列出了表达量最高的10个基因,从中可以发现一些基因是已经明确了与卵泡发育直接相关,如卵泡抑素(follistatin, FST)和抑制素β(inhibin, beta A,INHBA)都属于负调控卵泡发育的因子。

表2 转录组PDF1和PDF2中表达量最高的10个基因
2.2 差异表达基因筛选及GO分析
数据库比对结果设定参数:RPKM≥0.5,PDF1-RPKM /PDF2-RPKM>2,FDR校正<0.05,共获得196差异表达基因,表3列出了前10个高差异上调基因及其功能;设定参数PDF2-RPKM /PDF1-RPKM>2,FDR校正<0.05,共获得67差异表达基因,表4列出了前10个高差异下调基因及其功能。应用DAVID v6.8对263个筛选出的差异表达基因进行GO功能聚类分析,共分为三大类90组:其中生物学过程占64.4%,细胞组分占17.8%,分子功能占17.8%(图1)。
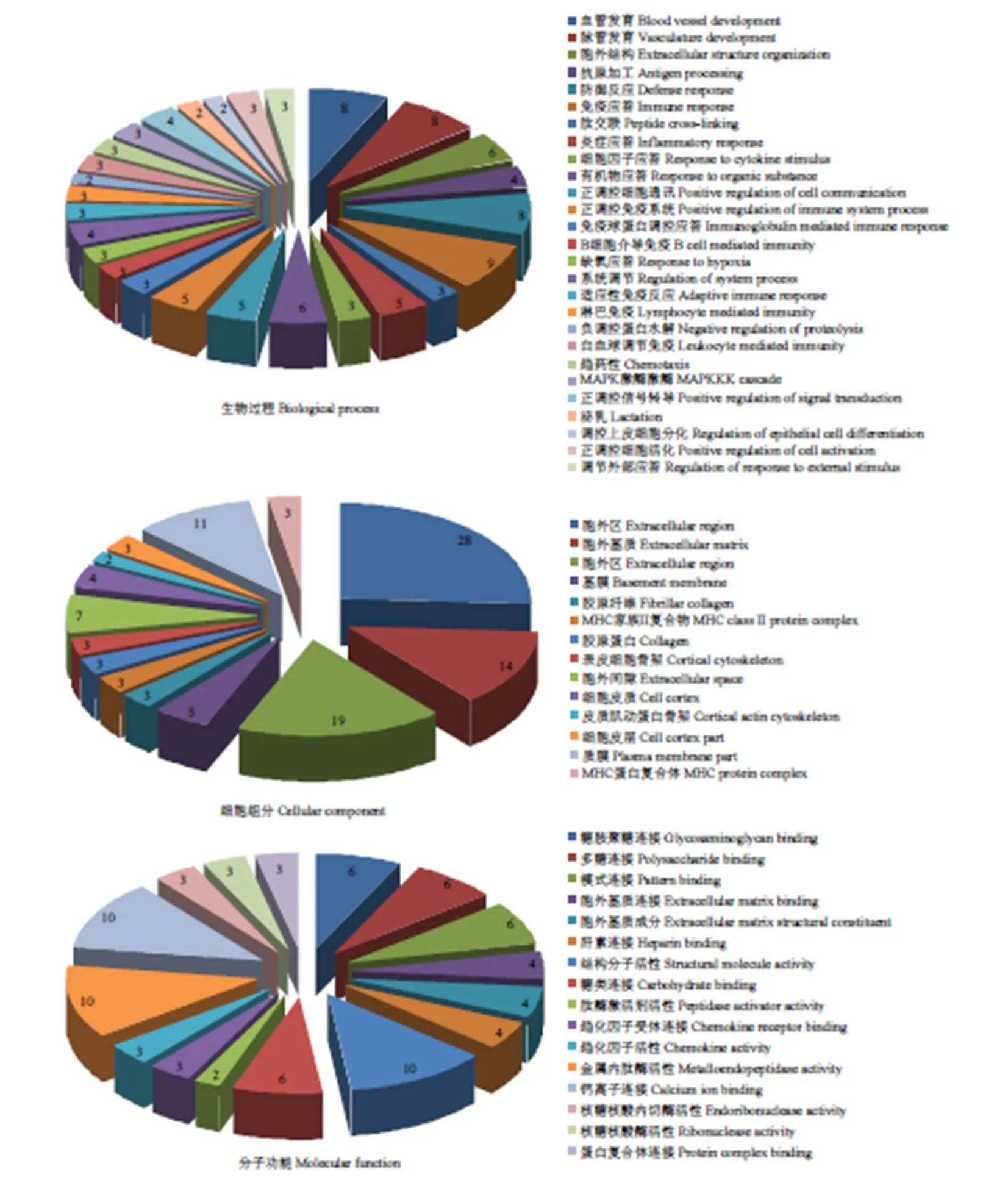
饼状图数字表示基因富集数 The numbers in pie chart represent the numbers of gene enrichment

表3 转录组PDF1和PDF2中的上调基因及其功能
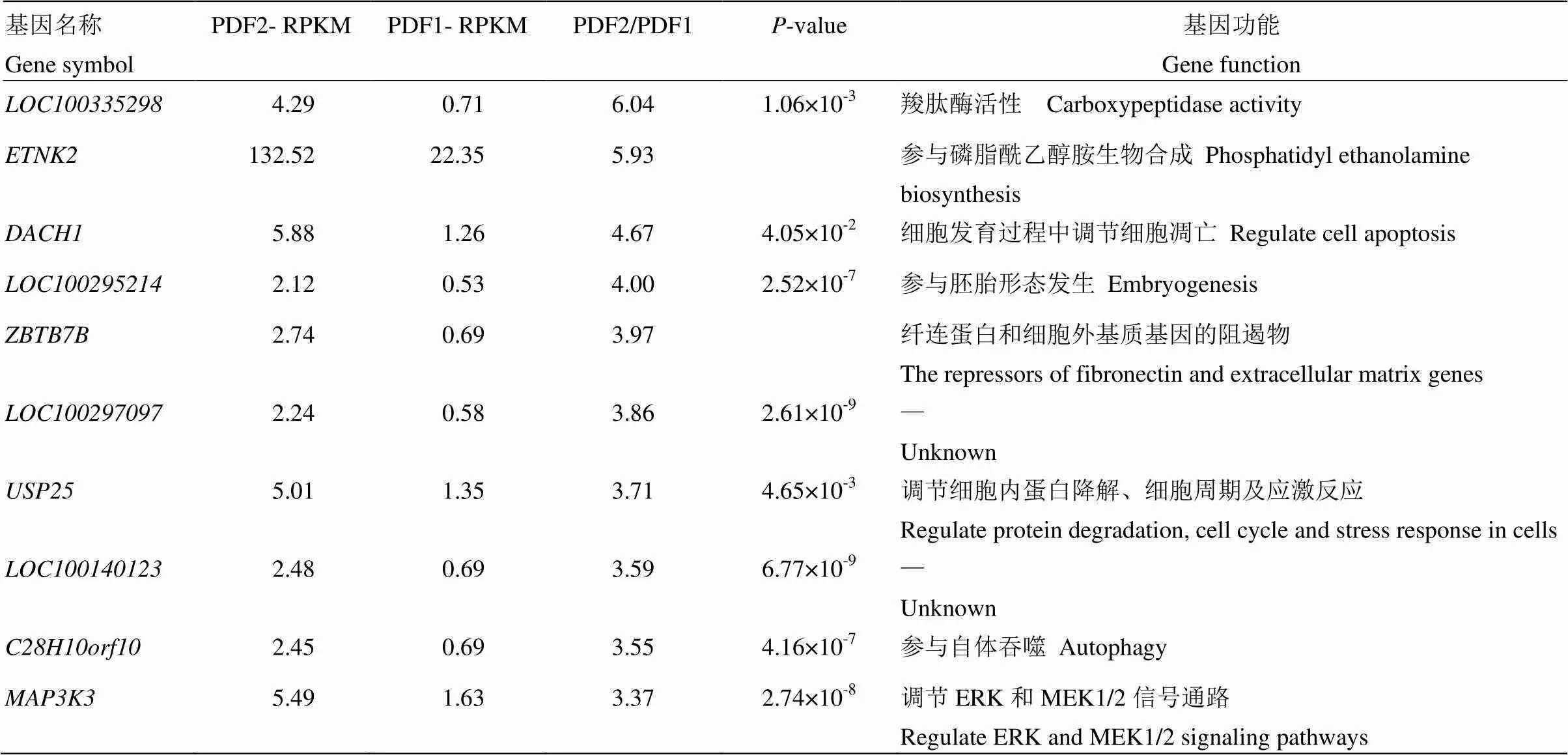
表4 转录组PDF1和PDF2中的下调基因及其功能
2.3 牛卵泡发育相关基因的筛选及qRT-PCR验证分析
筛选出的263个差异表达基因,经Genecards功能查询分析,共获得6个基因与卵泡发育关系较为密切。其中上调基因分别为;下调基因为和(表5)。qRT-PCR分析结果显示(图2),6个基因在DF和SF的表达变化趋势与高通量测序结果相一致,其中和在DF中的表达量显著高于SF(<0.05);CPXM1在SF中的表达量极显著高于DF(<0.01);和在DF和SF中的表达量不存在显著差异(>0.05)。
3 讨论
动物卵泡发育是一个复杂的生理过程,受到基因、蛋白水平以及内分泌激素等多方面调控,因此,动物卵泡发育的关键调控因子及作用机理仍不明确。转录组水平的研究是对特定组织或细胞在不同生理状态下所有RNA转录集合的全方位分析,其显著特点是测序通量高,可深度挖掘研究对象中各基因表达的细微变化[11-12]。与基因芯片技术相比较,新一代测序技术在基因挖掘、表达灵敏度方面优势明显;MARIONI等[13]对动物组织采用基因芯片和新一代测序技术进行了对比研究,发现在相同的FDR校正下,Illumina技术获得的差异表达基因比基因芯片多检测出30%;同时,Illumina测序结果重复性好,技术误差也较小[14]。因此,本试验通过Illumina技术对牛卵泡转录组PDF1和PDF2进行深度测序,结合Genecards功能查询共筛选出6个差异表达基因与卵泡发育相关;经qRT-PCR检测确定了各基因差异表达趋势与转录组测序结果相一致,其中和在DF中的表达量显著高于SF(<0.05),CPXM1在SF中的表达量极显著高于DF(<0.01)。
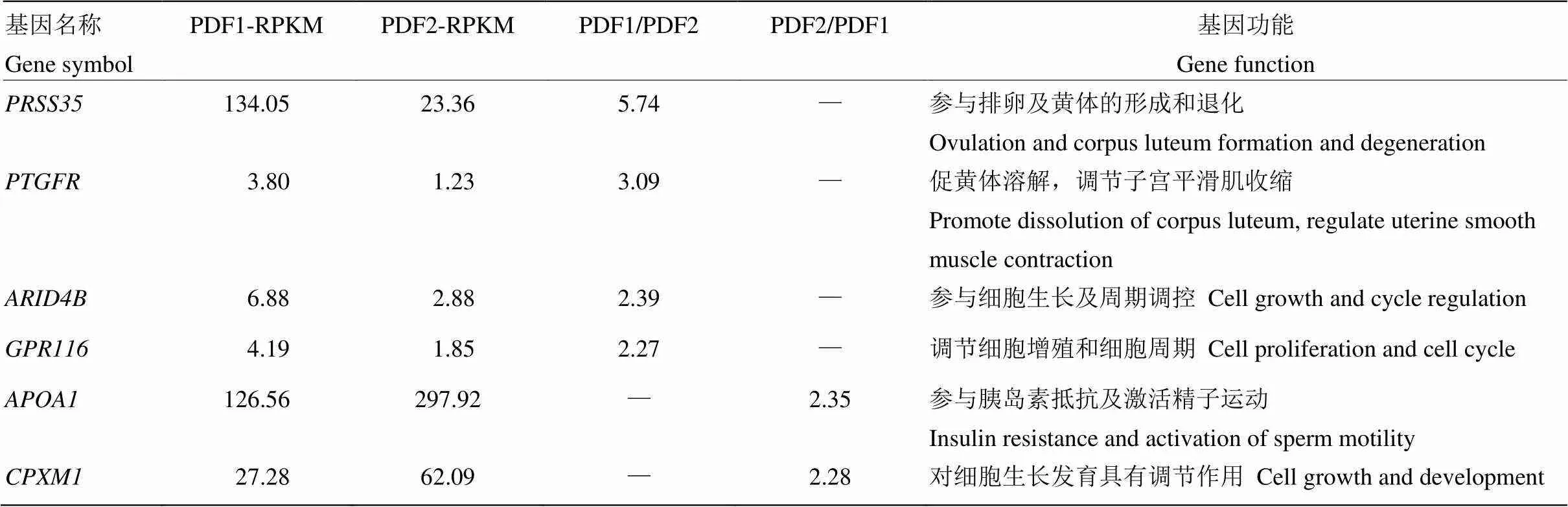
表5 PDF1/PDF2和PDF2/PDF1转录本中筛选卵泡发育相关基因

**和*分别表示在显著水平0.01和0.05的结果 Superscript ** and * indicate significantly different at the level of 0.05 and 0.01
PRSS35(Serine protease 35)是以丝氨酸为活性中心的蛋白水解酶,在动物体内主要通过抑制或激活蛋白酶原,参与蛋白质的合成与降解[15]。其生理功能的执行主要通过丝氨酸蛋白酶抑制剂(serine protease inhibitor,SPI)的调节,在病原入侵、细胞分化、组织重建、血管形成和胚胎发育等过程中都发挥着重要作用[16]。WAHLBERG等通过基因芯片技术对参与小鼠排卵期的蛋白酶进行了鉴定,其中,在促性腺激素诱导下表达上调;深入研究促性腺激素诱导的未性成熟的小鼠和假孕小鼠黄体期的表达谱发现,在发育卵泡的膜细胞层表达,并强烈诱导排卵期前的卵泡GCs表达该基因;同时,在黄体的形成和退化过程中也有表达;这些结果表明PRSS35可能参与了动物排卵以及黄体的形成和退化[17]。LI等研究也表明PRSS35在排卵期和黄体期存在较高水平的表达,类固醇替代实验研究表明卵泡破裂之前的mRNA的表达依赖于黄体酮的调节[18]。
ARID(AT rich interactive domain)即核苷酸AT富集区域,主要存在于DNA双螺旋大沟中,该区域呈螺旋-转角-螺旋结构,在生物进化过程中高度保守。该特殊区域最先在果蝇Dri基因[19]以及鼠特异性转录因子[20]上发现。目前,在人和动物中共发现15个ARID家族基因,7个亚家族之间ARID结构域的核苷酸和氨基酸序列相似性均较低[21]。ARID蛋白家族在动物体内执行广泛的生理功能,如在基因表达调控、细胞分化、增殖和分裂以及染色体重塑过程中发挥重要作用[22]。ARID4有ARID4A和ARID4B两个异构体,二者氨基酸序列相似性为74%,其显著特点是二者均包含一个TD(Tudor domain)和CD(Chrome domain)结构域。CAO等研究表明在细胞生长间期,ARID4过表达会引起转录因子E2F依赖性基因转录沉默,抑制细胞进入DNA合成期,从而阻碍细胞正常生长,这表明ARID4具有转录抑制活性[23]。动物正常组织中,ARID4B的表达具有规律性并受到严格限制,由于其在人癌组织表达丰富,ARID4B通常作为标记物用于早期肿瘤检测[24]。本研究发现,ARID4B在牛第一卵泡波DF颗粒细胞中表达量显著高于SF(<0.05),而第一卵泡波中的DF最终不排卵,因此,ARID4B可能在DF的生长发育过程中阻碍颗粒细胞的增殖和雌激素的分泌,从而抑制了排卵。
羧肽酶(carboxypeptidases)是专一性从多肽链C-末端逐个降解并释放游离氨基酸的肽链外切酶,在生物体各组织器官中广泛分布,发挥重要生理功能[25]。羧肽酶依据活性中心金属离子和氨基酸残基的不同,可分为半胱氨酸羧肽酶、金属羧肽酶、丝氨酸羧肽酶[26]。编码金属羧肽酶蛋白(carboxypeptidase X, Member 1,CPXM1)也称为CPX1,其氨基酸序列中包含有一个由160个氨基酸构成的DSD蛋白结合后区域[27]。GO功能聚类分析显示,CPXM1具有金属羧肽酶活性并与锌离子连接有关,其功能是将肽链C-末端降解为精氨酸和赖氨酸短肽,选择性地对肽类激素进行加工和修饰[28]。有研究表明,小鼠通过基因点突变造成机体羧肽酶E缺乏,但小鼠仍具有完整的神经内分泌调节能力,这表明各类羧肽酶之间肽类激素加工及其调节存在相互替代的现象;进一步通过原位杂交对小鼠胚胎和胎儿组织研究发现,从头到胸部CPXM1均有表达,提示神经内分泌肽可能通过CPXM1的加工,实现对细胞间相互作用的调节,从而对细胞生长和发育产生调控作用[29]。目前对CPXM1功能研究的相关报道较少,UEHIRO等[30]研究表明,CPXM1的表达受表观遗传调控,在乳腺癌发展过程中作为肿瘤抑制基因存在。
综上所述,通过转录组数据分析并结合Genecards功能查询筛选调控卵泡发育相关基因,为进一步对影响卵泡发育各信号通路关键蛋白的功能研究及调控网络基因扰动研究提供了依据,也为深入探讨卵泡发育调控机理奠定了基础。
4 结论
牛第一卵泡波的最大卵泡和第二大卵泡转录组测序共获得15 760个转录本,其中筛选出263个差异表达基因;经Genecards基因功能注释分析,4个上调基因和2个下调基因,与卵泡发育相关;qRT-PCR分析表明,和在优势卵泡和从属卵泡表达量存在显著差异,推测在牛卵泡发育过程中可能参与了卵泡的优势化或闭锁。
[1] BEG M A, BERGFELT D R, KOT K, GINTHER O J. Follicle selection in cattle: dynamics of follicular fluid factors during development of follicle dominance., 2002, 66(1): 120-126.
[2] TERENINA E, FABRE S, BONNET A, MONNIAUX D, ROBERT- GRANIÉ C, SANCRISTOBAL M, SARRY J, VIGNOLES F, GONDRET F, MONGET P, TOSSER-KLOPP G. Differentially expressed genes and gene networks involved in pig ovarian follicular atresia., 2017, 49(2):67-80.
[3] TICIANELLI J S, EMANUELLI I P, SATRAPA R A, CASTILHO A C, LOUREIRO B, SUDANO M J, FONTES P K, PINTO R F, RAZZA E M, SURJUS R S, SARTORI R, ASSUMPCAO M E, VISINTIN J A, BARROS C M, PAULA-LOPES F F. Gene expression profile in heat-shocked Holstein and Nelore oocytes and cumulus cells., 2016, doi: 10.1071/ RD16154.
[4] LI P, MENG J, LIU W, SMITH G W, YAO J, LYU L. Transcriptome analysis of bovine ovarian follicles at predeviation and onset of deviation stages of a follicular wave., 2016, doi:10.1155/2016/3472748.
[5] SAVIO J D, KEENAN L, BOLAND M P, ROCHE J F. Pattern of growth of dominant follicles during the oestrous cycle of heifers., 1988, 83(2):663-671.
[6] SIROIS J, FORTUNE J E. Ovarian follicular dynamics during the estrous cycle in heifers monitored by real-time ultrasonography., 1988, 39(2):308-317.
[7] 李鹏飞,毕锡麟,王锴,景炅婕,吕丽华. CART在不同发育阶段牛卵泡颗粒细胞中的表达和定位. 中国农业科学,2016, 49(12): 2389-2396.
LI P F, BI X L, WANG K, JING J J, LÜ L H. Research on the expression and localization of CART in bovine granulosa cells at different developmental stages., 2016, 49(12):2389-2396. (in Chinese)
[8] 李鹏飞, 孟金柱, 谢建山, 朱芷葳, 刘岩, 姜晓龙, 陈建伟, 姚晓磊, 赵妙妙, 吕丽华. 牛卵泡ODF1 与ODF2 转录组发育相关基因筛选及表达差异分析. 畜牧兽医学报,2015, 46(11):1961-1966.
LI P F, MENG J Z, XIE J S, ZHU Z W, LIU Y, JIANG X L, CHEN J W, YAO X L, ZHAO M M, LÜ L H. Screening and analyse study of genes associated with follicular development in bovine ODF1 and ODF2 transcript., 2015, 46(11): 1961-1966. (in Chinese)
[9] AUDIC S, CLAVERIE J M. The significance of digital gene expression profiles., 1997, 7(10):986-995.
[10] 李鹏飞. 牛卵泡可卡因-苯丙胺调节转录肽(CART)受体的筛选[D]. 太谷:山西农业大学,2014.
LI P F. Screening of cocaine-and amphetamine-regulated transcript peptide (CART) receptor of cattle follicle [D]. Taigu: Shanxi Agricultural University, 2014. (in Chinese)
[11] WANG Z, GERSTEIN M, SNYDER M. RNA-Seq: a revolutionary tool for transcriptomics., 2009, 10(1):57-63.
[12] HAAS B J, ZODY M C. Advancing RNA-Seq analysis., 2010, 28(5):421-423.
[13] MARIONI J C, MASON C E, MANE S M, STEPHENS M, GILAD Y. RNA-seq: an assessment of technical reproducibility and comparison with gene expression arrays., 2008, 18(9): 1509-1517.
[14] CROUCHER N J, FOOKES M C, PERKINS T T, TURNER D J, MARGUERAT S B, KEANE T, QUAIL M A, HE M, ASSEFA S, BÄHLER J, KINGSLEY R A, PARKHILL J, BENTLEY S D, DOUGAN G, THOMSON N R. A simple method for directional transcriptome sequencing using Illumina technology., 2009, 37(22): e148.
[15] SOON W W, MILLER L D, BLACK M A, DALMASSO C, CHAN X B, PANG B, ONG C W, SALTO-TELLEZ M, DESAI K V, LIU E T. Combined genomic and phenotype screening reveals secretory factor SPINK1 as an invasion and survival factor associated with patient prognosis in breast cancer., 2011, 3(8): 451-464.
[16] DIAO H, XIAO S, LI R, ZHAO F, YE X. Distinct spatiotemporal expression of serine proteases Prss23 and Prss35 in periimplantation mouse uterus and dispensable function of Prss35 in fertility., 2013, 8(2):e56757.
[17] WAHLBERG P, NYLANDER A, AHLSKOG N, LIU K, NY T. Expression and localization of the serine proteases high-temperature requirement factor A1, serine protease 23, and serine protease 35 in the mouse ovary., 2008, 149(10):5070-5077.
[18] LI S H, LIN M H, HWU Y M, LU C H, YEH L Y, CHEN Y J, LEE R K. Correlation of cumulus gene expression of GJA1, PRSS35, PTX3, and SERPINE2 with oocyte maturation, fertilization, and embryo development., 2015, 13:93. doi: 10.1186/s12958-015-0091-3.
[19] KIM S, ZHANG Z, UPCHURCH S, ISERN N, CHEN Y. Structure and DNA-binding sites of the SWII AT-rich interaction domain (ARID) suggest determinants for sequence-specific DNA recognition., 2004, 279(16):16670-16676.
[20] HERRSCHER R F, KAPLAN M H, LELSZ D L, DAS C, SCHEUERMANN R, TUCKER P W. The immunoglobulin heavy chain matrix associating regions are bound by Bright: a B cell-specific trans-activator that describes a new DNA-binding protein family., 1995, 9(24):3067-3082.
[21] WILSKER D, PATSIALOU A, DALLAS P B, MORAN E. ARID proteins: a diverse family of DNA binding proteins implicated in the control of cell growth, differentiation, and development., 2002, 13(3):95-106.
[22] LAI A, MARCELLUS R C, CORBEIL H B, BRANTON P E. RBP1 induces growth arrest by repression of E2F-dependent transcription., 1999, 18(12):2091-2100.
[23] CAO J, GAO T, STANBRIDGE E J, IRIE R. RBP1L1, a retinoblastoma- binding protein-related gene encoding an antigenic epitope abundantly expressed in human carcinomas and normal testis., 2001, 93(15):1159-1165.
[24] ATEEQ B, TOMLINS S A, LAXMAN B, ASANGANI I A, CAO Q, CAO X, LI Y, WANG X, FENG F Y, PIENTA K J, VARAMBALLY S, CHINNAIYAN A M. Therapeutic targeting of SPINK1-positive prostate cancer., 2011, 3(72): 72ra17.
[25] GHADGE G D, SLUSHER B S, BODNER A, CANTO M D, WOZNIAK K, THOMAS A G, ROJAS C, TSUKAMOTO T, MAJER P, MILLER R J, MONTI A L, ROOS R P. Glutamate carboxypeptidase II inhibition protects motor neurons from death in familial amyotrophic lateral sclerosis models., 2003, 100(16):9554-9559.
[26] GOMIS-RÜTH F X, COMPANYS V, QIAN Y, FRICKER L D, VENDRELL J, AVILÉS F X, COLL M. Crystal structure of avian carboxypeptidase D domain II: a prototype for the regulatory metallocarboxypeptidase subfamily., 1999, 18(21): 5817-5826.
[27] KIM Y H, O'NEILL H M, WHITEHEAD J P. Carboxypeptidase X-1 (CPX-1) is a secreted collagen-binding glycoprotein., 2015, 468(4):894-899.
[28] CHANG E J, KWAK H B, KIM H, PARK J C, LEE Z H, KIM H H. Elucidation of CPX-1 involvement in RANKL-induced osteoclastogenesis by a proteomics approach., 2004, 564(1/2):166-170.
[29] LEI Y, XIN X, MORGAN D, PINTAR J E, FRICKER L D. Identification of mouse CPX-1, a novel member of the metallocarboxypeptidase gene family with highest similarity to CPX-2., 1999, 18(2):175-185.
[30] UEHIRO N, SATO F, PU F, TANAKA S, KAWASHIMA M, KAWAGUCHI K, SUGIMOTO M, SAJI S, TOI M. Circulating cell-free DNA-based epigenetic assay can detect early breast cancer., 2016, 18(1):129-142.
(责任编辑 林鉴非)
Follicular Development Related Genes Screening and Differential Expressed Analysis by Transcriptome Sequencing in Bovine Ovary
LI PengFei1, MENG JinZhu2, JING JiongJie3, BI XiLin3, WANG Kai3, ZHU ZhiWei1, LÜ LiHua3
(1College of Life Science, Shanxi Agricultural University, Taigu 030801, Shanxi;2Wujiang College, Tongren University, Tongren 554300, Guizhou;3College of Animal Science and Technology, Shanxi Agricultural University, Taigu 030801, Shanxi)
【Objective】The study focused on screening some genes involved in follicular development through high- throughput sequencing in bovine follicles at different physiological states. 【Method】Cows were selected for estrus synchronization, and the largest follicle and second largest follicle at predeviation during the first follicle wave were gathered by B-type ultrasonography. Thereafter, the RNA libraries were constructed and RNA sequencing was performed by Illumina platform. Compared with the database, parameters were set to screen high-expressed genes and differentially expressed genes, and then GO analysis was conducted. Further screened regulatory genes directly related to follicular development by Genecards, and qRT-PCR was performed to validate expression of screened genes associated with follicular development. 【Result】Results showed that 263 differentially expressed genes were obtained from the two transcripts, which could be assigned into 90 groups under three categories by GO clustering analysis (biological processes, 64.4%; cell component, 17.8%; molecular function, 17.8%). Some important functional enrichment pathways were obtained, such as regulating signal transduction and cytokine response biological pathways; 10 high-expressed up-regulated and down-regulated genes were selected by gene expression analysis,involved in estrogen synthesis and fetal gender development,participated in steroid hormone synthesis,regulated cell apoptosis in process of cell development, andregulated ERK and MEK1/2 signaling pathways. Six genes were found closely associate with follicular development by Genecards: up-regulated genes includedand, down-regulated genes includedand. qRT-PCR results showed that expression ofandwere significantly higher in DF than in SF (<0.05), andexpression was significantly higher in SF than in DF (<0.01). There was no significant difference in the expression of,andbetween DF and SF (>0.05),however, the expression variation trend was consistent with high-throughput sequencing results. 【Conclusion】The transcriptome sequencing results were accurate,andplayed positive roles andplayed a negative role in regulating follicular development, genes related to bovine follicular development and important regulated pathways, which were of great significance to further study the regulation mechanism of follicular development.
bovine; follicle; transcript; PDF1; PDF2; development
2017-03-28;
2018-07-06
山西省重点研发计划(一般)农业项目(201703D221020-1)、山西省国际科技合作项目(201603D421006)、山西省三晋学者和人才引进项目、山西农业大学创新基金项目(zdpy201403/201503)、引进人才博士科研启动基金(2014ZZ04)和青年拔尖创新人才支持计划(TYIT201403)
李鹏飞,E-mail:adamlpf@126.com。通信作者吕丽华,E-mail:lihualvsxau@126.com
10.3864/j.issn.0578-1752.2018.15.0015

