大鼠羊水栓塞模型的法医病理学检验分析
李连鹏 戴伟 李桢 王尚文 张桓
羊水栓塞(amniotic fluid embolism,AFE)是由于羊水进入母体血循环引起的一系列严重并发症,临床以突发性低血压、低氧血症及凝血功能障碍为主,AFE是一种发病率低,但是导致孕产妇死亡的重要原因,死亡率高达60%以上,是极其凶险且不可预料的产科并发症,是孕产妇死亡的主要原因之一[1~3]。但查阅文献和在法医学实践工作中发现,进入母体循环的羊水量至今无法计算,且多量羊水进入循环系统后发展变化规律不明确,故我们通过给母体注射不同剂量的自体羊水成分,将进入母体的羊水量进行限制,复制不同剂量的大鼠AFE模型和多量羊水入体的不同时间点AFE模型,并通过常规法医学方法检测和验证,来研究AFE大鼠模型的发展变化规律。
1 材料与方法
1.1 实验动物与分组 选取体重(395±30)g,孕龄20d左右的健康孕晚期SD大鼠80只(昆明医科大学实验动物研究中心和湖南斯莱克景达实验动物有限公司提供),均为精选满足实验要求者。
分组:①健康孕晚期SD大鼠40只,随机分成不同剂量的4组,即注入自体羊水1.25ml/kg组(低剂量组)8只、2.5ml/kg组(中剂量组)8只、4ml/kg组(大剂量组)8只以及注入所能采集到的最多无污染清亮的自体羊水组(约3ml/只,即极大剂量组)8只的大鼠模型和正常组大鼠8只做子宫次全切、下腔静脉缓慢注射生理盐水2ml/只后缝合;观察60min后处杀。②健康孕晚期SD大鼠40只,随机分成不同时间点的4组和正常组,后实验组均注入4ml/kg羊水。实验分组:分别为注入羊水后30min组8只、3h组8只、6h组8只、24h组8只和24h正常对照组8只。
1.2 实验方法
1.2.1 制备实验用羊水 羊水来自每只动物,实验当天行子宫次全切,剪破离体子宫壁、羊膜腔后收集肉眼观测清亮的羊水。
1.2.2 制备羊水栓塞动物模型 术前禁食6h,饮水不受限。10%水合氯醛腹腔注射麻醉动物,麻醉生效后固定于手术台上剪去腹部体毛,使用含有效碘0.5%的碘伏消毒液消毒术区皮肤;使用消毒手术器械做腹部切口和子宫次全切术;使用无菌纱布覆盖切口,并立即使用无菌生理盐水漂洗离体子宫,擦干后行子宫内羊水收集,体外取羊水时速度要快,尽量避免胎粪浸染羊水,确保收集的羊水清亮;后按规定剂量从下腔静脉缓慢注入自体羊水,实验中注入羊水时速度尽量缓慢以贴近于临床实际;注射完成后缝合腹壁各层组织并碘伏消毒。使用消毒过的鼠笼、垫料分笼单独饲养实验大鼠(以防止麻醉清醒早的大鼠利用体重压迫麻醉清醒晚的大鼠)。上述各组到时间后拉颈处死动物,取肺、脑、肝组织,使用10%福尔马林溶液固定后行石蜡包埋、采用相同组织的连续3张切片(厚度5μm),行常规组织HE染色,对无法检出明确羊水成分组织的其余两张切片,行抗角蛋白16染色法、APM双重组化染色法染色,后行病理学检查。正常对照组子宫次全切后从下腔静脉缓慢注入生理盐水后关腹。
1.2.3 查找羊水成分 由两名从事十年以上法医病理学鉴定的专家在显微镜下对大鼠肺、肝、脑组织病理切片进行羊水成分(鳞状上皮细胞、毳毛、胎粪、粘液和羊水结晶等成分)的查找,如未发现羊水成分则行抗角蛋白16染色法、APM双重组化染色法染色复查。
1.3 统计学方法 实验定量资料(如:每张固定大小切片中检出血管中有羊水成分的血管数量/该张切片中血管总数量)用均数±标准差(±s)表示,采用软件SPSS 16.0进行统计分析,进行单因素方差分析及两两比较的q检验。P<0.05(或P<0.01)为组间差异有统计学意义。
2 结果
2.1 模型组孕鼠的临床表现 对照组从腹主静脉缓慢注入生理盐水后出现短暂性呼吸加快,后恢复。AFE各组均有心率和呼吸频率的改变:麻醉苏醒后各组大鼠的心率均加快,且心率加快的持续时间随着羊水剂量的增大而增大。麻醉苏醒后各组大鼠的呼吸频率均有加快,且呼吸频率加快的持续时间随着羊水剂量的增大而增大。在不同剂量的4组中,大剂量组和极大剂量组的心率和呼吸频率加快时间是同步的,且各实验动物从麻醉苏醒至实验结束均未恢复。在不同时间点的4组中,6h组和24h组持续时间分别为(4±1.75)h、(4±2.5)h,但差异无统计学意义;AFE各组均伴有局部抽搐、小便失禁等,差异无统计学意义。所有按无菌标准操作和术后单只分鼠笼单独饲养的各组大鼠在处死前均无死亡。
2.2 染色结果
2.2.1 肺梗死和出血情况 极大剂量组3只(37.5%)检见小灶状的肺梗死、肺出血,大剂量组1只(12.5%)检见小灶状的肺梗死、肺出血;其余各组实验大鼠肺、脑、肝中仅肺组织可以检出羊水成分。在检见小灶状肺梗死的实验大鼠的脑组织和肝组织中检见毳毛(见图1)、角化上皮、粘液和血栓等成分,分析认为毳毛和角化上皮等成分系肺梗死后进入肺静脉通过体循环进入。
2.2.2 低剂量组存在未检出羊水成分的情况 不同剂量的4组中,低剂量组3只(37.5%)肺组织中未检出羊水成分。未检出羊水成分实验大鼠的肺、脑、肝组织均经过APM染色和抗角蛋白16染色亦未发现羊水成分。其余各组均检出羊水成分。
2.2.3 各实验组的相似性变化 各实验组均有不同程度的肺水肿和炎性细胞浸润,随剂量增大而加重;不同剂量的4组中,大剂量组7只(87.5%)和极大剂量组8只(100%)的肺组织有重度肺水肿(见图2)、肺出血及炎性反应。各实验组的肺组织均可见不同程度的肺萎陷、肺泡腔变窄所致的肺泡大小不一(见图3),间质血管扩张,出血,血管及支气管周围可见大量以中性粒细胞为主的炎性细胞浸润,随剂量增大而加重。各实验组均可见脑水肿、神经细胞肿胀或固缩的缺氧性病变和肝细胞水样变性的改变。各实验组均可见溶血样改变,部分管腔内可见肿胀的红细胞(见图4)。
2.2.4 羊水成分的重吸收和分解情况 不同时间点的4组中,24h组未检见羊水成分中的毳毛、胎粪和粘液,同时该切片APM染色法能在支气管中检见分泌的粘液成分;检见的角化上皮成分的量和大小均较前3组轻微,差异有统计学意义(P<0.05);炎性细胞浸润程度略重。
2.2.5 HE染色下肺动脉分支及肺泡壁毛细血管内检见红色条索状的角化上皮成分、淡红色粘液、黄褐色的胎粪及红色的微血栓,以及核蓝色、胞浆红色的合体样细胞等羊水成分,均为非特异性着色(见图 2)。
2.2.6 APM染色法下肺动脉分支及肺泡壁毛细血管内可见呈条索状、桃红色的鳞状上皮细胞和毳毛等角化上皮成分以及蓝色的酸性粘液和桃红色的微血栓,肺上皮细胞的胞浆呈淡染的浅蓝或无色,血管内皮细胞胞浆几乎不着色(见图5)。
2.2.7 Resist keratin-16免疫组化染色法下肺动脉分支及肺泡壁毛细血管内可见角化上皮呈褐色(见图6)。

图1 脑干HE染色,×200,示血管内检见毳毛成分

图2 肺HE染色,×400,示重度肺水肿

图3 肺HE染色,×200,血管空虚、炎性细胞和肺泡大小不一

图4 前额皮质HE染色,×400,血管内溶血
3 讨论
一直认为,AFE的发生机理是由于羊水和羊水中的有形成分进入孕产妇血循环,但Clark等[4,5]观察到胎儿的鳞状上皮细胞进入孕妇血循环而不引起AFE症状,认为正常羊水进入孕产妇血循环可能并无危害。Hankins等[6]发现在所有输注羊水的样本中肺循环系统有升压反应,且升压反应程度在输注羊水原液、被过滤的羊水、被过滤且被煮沸的羊水的标本是相同的。用羊水原液灌流离体肺[7],也未产生由于机械性栓塞而引起的肺动脉高压和肺水肿,并且在镜下检查发现有胎儿毳毛及上皮细胞沉着在血管内,无明显的血管痉挛发生;而用不含羊水有形成分的羊水栓塞样血浆灌流离体肺,虽无机械性栓塞现象,但能立即使肺动脉压升高,导致肺水肿产生。胡国英[8]等证实大鼠羊水入血后可引起中性粒细胞、巨噬细胞浸润及一系列病理变化,由此引起肺损伤及临床症状,但并无致死性动物。有报道称AFE病例尸检未在孕产妇血循环中发现胎儿鳞状上皮碎屑,认为鳞状上皮存在与否对AFE而言并非主要[9]。这些结果直接表明羊水栓塞致肺循环病变的原因不完全是羊水中有形成分引起的机械性栓塞,而羊水入血后引起一些血管活性物质的释放导致机体出现严重的病理生理改变,或者是极少数的人对羊水中的抗原成分产生特殊的反应,使孕产妇出现严重的血液动力学变化,包括左心功能衰竭、肺血管损伤、凝血功能异常,这些是引发AFE的重要因素[10,11]。羊水进入孕产妇血循环是胎盘生理屏障存在破口之故,在正常妊娠中胎儿血细胞、胎儿上皮细胞或滋养层细胞在孕产妇血中可以见到。大多数情况下这些物质不引起临床症状,但在某些孕妇中这种胎儿相关成分则可引起一系列严重的病理生理反应,极像在过敏性休克及感染性休克中所见[11~15]。现有部分观点认为AFE发病机制可能是无抗体参加的过敏样反应,在此反应中异体物质引起肥大细胞脱颗粒,异常的花生四烯酸代谢产物,包括白三烯、前列腺素、血栓素等进入孕产妇血循环引起一系列严重病理生理变化[12,13]。已有研究证实,这些递质和凝血机制紊乱直接相关。可以说,羊水栓塞综合征事实上是一种类过敏反应综合征。随着对变应原疾病发病机制认识的不断深入,目前已从单纯测定组胺、白三烯等介质延伸至检测参与过敏性炎症重要的生物活性物质,以评估炎症的程度和判断病情。具体机制尚需进一步研究。
我们的实验也证实上述观点,只有在羊水量极大的情况下,甚至是可以收集到的全部自体羊水成分通过下腔静脉等进入右心室,才会有部分实验大鼠通过栓塞引起肺组织小灶状梗死,羊水成分才能通过梗死灶进入肺静脉,且进入体循环的羊水量尚不足以引起脏器的梗死。但自体羊水大部分进入循环系统在临床中是难以发生的,而且我们的实验也证实羊水进入循环系统后存在吸收和分解的情况。且本次实验的大鼠均未发生死亡,推测可能原因是致死性AFE发生率较低,实验动物数量少,难以成功复制致死性AFE模型;在实验中,收集的羊水保持清亮状态,胎粪浸染少,致敏性强的胎粪成分少,也可能是无致死性AFE的原因之一;大鼠耐受性较强,对有创性手术和实验抵御能力强,且无菌操作和大鼠饲养条件中环境的消毒是保证大鼠存活的必要条件;实验观测时间短,尚未达到溶血、出血等因素导致的多器官功能衰竭死亡,也可能是实验中无致死性AFE的原因之一。从上述情况推测少量羊水成分进入孕鼠血循环后,单一因羊水成分中有形物质机械性栓塞尚不足以导致实验动物死亡,且羊水成分存在重吸收和分解的情况。我们认为在实验中羊水成分的检出率应为100%,但本实验结果却显示低剂量组3只孕鼠( 37.5% )肺组织中未检出羊水成分,在黄神姣等[16]的实验中,也证实通过病理学来诊断羊水栓塞可能是不可靠的。

图5 肺APM染色,×400,示重度肺水肿
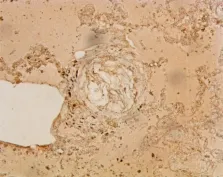
图6 肺抗角蛋白16染色,×400,示重度肺水肿
综上所述,羊水成分进入孕鼠血循环后,单一因羊水成分中有形物质机械性栓塞尚不足以导致实验动物死亡,且羊水成分存在重吸收和分解的情况。羊水栓塞综合征事实上是存在个体差异和种属差异,是一种类过敏反应综合征。随着对变应原疾病发病机制认识的不断深入,目前已从单纯测定组胺、白三烯等介质延伸至检测参与过敏性炎症重要的生物活性物质,以评估炎症的程度和判断病情,而类过敏反应综合征的发生和发展机制尚需进一步研究。

