不同基因型高粱的氮效率及对低氮胁迫的生理响应
刘鹏,武爱莲,王劲松,南江宽,董二伟,焦晓燕,平俊爱,白文斌
不同基因型高粱的氮效率及对低氮胁迫的生理响应
刘鹏1,2,3,武爱莲2,王劲松2,南江宽2,董二伟2,焦晓燕2,平俊爱3,白文斌3
(1山西大学生物工程学院,太原 030006;2山西省农业科学院农业环境与资源研究所,太原 030031;3山西省农业科学院高粱研究所, 山西晋中 030600)
【目的】探讨不同基因型高粱氮素吸收效率和利用效率及其差异机制,研究低氮胁迫对不同基因型高粱叶片无机氮含量和氮同化酶活性的影响,为耐低氮型高粱品种的选育提供理论依据。【方法】采用盆栽试验,选取2个低氮敏感型高粱(冀蚜2号和TX7000B)和2个耐低氮型高粱(SX44B和TX378)为试验材料,设置高氮(0.24 g·kg-1风干土)和低氮(0.04 g·kg-1风干土)2个处理,分别在挑旗期和灌浆期测定高粱叶片NO3--N、NO2--N及NH4+-N含量和硝酸还原酶(NR)、亚硝酸还原酶(NiR)、谷氨酰胺合成酶(GS)和谷氨酸合成酶(GOGAT)活性,分析不同基因型高粱在2个氮处理下的氮效率相关指标及其差异。【结果】(1)不同基因型高粱籽粒产量对低氮的响应不同,低氮处理显著降低了冀蚜2号和TX7000B的籽粒产量,与高氮处理比较分别降低13.87% 和19.25%,但没有降低SX44B和TX378的籽粒产量。(2)与高氮处理比较,低氮处理的相对籽粒氮累积量、相对植株氮累积量和相对氮收获指数不能表征各基因型高粱是否具有耐低氮特性;但相对低氮敏感型高粱,耐低氮型高粱在低氮处理下有着较高的相对氮肥偏生产力和相对氮素利用效率。低氮处理下SX44B和TX378的氮肥偏生产力是高氮处理的6.19和7.49倍,而冀蚜2号和TX7000B则分别为5.17和4.85倍;低氮处理下SX44B和TX378的氮素利用效率是高氮处理的1.84和1.85倍,而冀蚜2号和TX7000B则分别为1.67和1.35倍。(3)通径分析表明,高氮处理下,植株氮累积量和氮素利用效率对籽粒产量贡献相同;而在低氮处理下,氮素利用效率对籽粒产量关联作用更大。(4)高粱的叶片无机氮含量不能表征高粱是否具有耐低氮特性,灌浆期叶片无机氮含量较挑旗期显著降低。(5)与高氮处理比较,低氮处理时冀蚜2号和TX7000B叶片中NR、GS和GOGAT活性显著降低,SX44B酶活性变化不显著,而TX378叶片中GS活性增加。【结论】耐低氮型高粱在低氮胁迫时有着较高的相对籽粒产量和相对氮素利用效率。低氮胁迫时叶片较高的氮同化酶活性是高粱耐低氮的生理基础。发掘和利用低氮条件下具有较高的叶片氮同化酶活性和氮素利用效率的高粱种质资源,有助于提高耐低氮高粱品种的培育效率。
高粱;氮素吸收效率;氮素利用效率;氮同化关键酶
0 引言
【研究意义】高粱[(L.) Moench]是世界上重要的粮食作物,并被广泛应用于饲料、酿造、生物质能源以及食品加工等领域[1-2]。由于高粱具有较强的耐瘠薄特性,往往被作为先锋作物种植在土壤瘠薄、干旱缺水的边际土壤中[3]。目前,虽然育种专家在提高高粱最大产量潜力方面已取得一定进展,但是过去几十年中,高粱产量的提高主要取决于瘠薄田(或低产田)高粱产量的提升[4]。在我国,79%的土地为中低产田[5],为此筛选具有高效吸收和利用氮素遗传潜力的高粱资源材料,利用高粱固有的生物学特性,挖掘高粱自身高效吸收利用氮素的潜力对实现高粱高产、氮素资源高效利用具有重要意义。【前人研究进展】在逆境(比如低氮胁迫等)条件下,植物可以感受外界胁迫并通过调节自身系统,在生理和形态等方面发生适应性改变以增强在胁迫条件下的生存能力[6]。研究表明,不同作物或者同种作物的不同品种之间的耐低氮能力存在着明显的基因型差异,作物的耐低氮能力和作物对氮的吸收和利用能力有关[7]。Moll[8]将氮效率(grain nitrogen use efficiency)定义为每单位供氮量所能获得的籽粒产量,在特定的氮素供应量条件下氮效率又可以分解成氮素吸收效率(nitrogen uptake efficiency)和氮素利用效率(nitrogen utilization efficiency)。对水稻、玉米、小麦等作物进行的研究中,氮高效品种较低效品种通常具有更高的氮素吸收效率或者氮素利用效率[9-11]。养分胁迫程度加剧时,养分利用效率对产量的贡献增加[12]。作物对氮素的利用涉及对已吸收的氮素的同化、转运和再利用,氮的同化酶硝酸还原酶(NR)、亚硝酸还原酶(NiR)、谷氨酰胺合成酶(GS)和谷氨酸合成酶(GOGAT)[13]在其中发挥着关键作用。前人对玉米[14]、小麦[11,15]、水稻[16]等作物研究表明,植物在低氮下NR、GS活性下降,但是耐低氮品种的降幅低于不耐的品种。【本研究切入点】我国对耐低氮型高粱的研究滞后于其他作物,耐低氮型高粱的氮素吸收和利用效率的基因型差异以及高粱对低氮胁迫的生理响应鲜见报道。【拟解决的关键问题】本研究选取2个低氮敏感型和2个耐低氮型高粱为材料,探讨不同基因型高粱在高氮和低氮2个处理下的氮效率及其差异机制,研究高粱对低氮胁迫的生理响应,为耐低氮型高粱品种的选育提供理论依据。
1 材料与方法
1.1 试验材料
供试材料为前期鉴定耐瘠性有差异的4个不同的高粱基因型材料,分别为冀蚜2号、TX7000B、SX44B和TX378,材料种子由山西省农业科学院高粱研究所提供。其中,冀蚜2号和TX7000B的低氮处理下的籽粒产量分别为高氮处理的67.14% 和82.00%,而SX44B和TX378分别为96.80%和90.65%[17]。依据低氮和高氮处理下的相对产量,将冀蚜2号和TX7000B鉴定为低氮敏感型材料,SX44B和TX378为耐低氮型材料。
1.2 试验设计
盆栽试验于2017年5月至9月在山西省农业科学院连栋温室内进行。供试土壤质地为黏壤土,土壤养分含量为有机质15.2 g·kg-1,全氮0.65 g·kg-1,硝态氮5.7 mg·kg-1,有效磷6.43 mg·kg-1,速效钾105 mg·kg-1,pH 8.47,EC 162 μs·cm-1。试验设置低氮(LN)和高氮(HN)2个处理,每个处理各设12次重复,每个重复为一盆。低氮处理氮用量为0.04g·kg-1风干土,高氮处理为0.24 g·kg-1风干土,P2O5和 K2O用量均为0.15 g·kg-1风干土。肥料和风干土以每盆为单元充分混匀后装盆,试验所用盆的最小内径和最大内径分别为18和27 cm,高度为19 cm,每盆装土9 kg。试验于5月6日播种,播前充分灌水,每盆种20粒种子以保证出苗效果。3叶期时每盆留苗5株,4叶期时每盆留苗3株直至收获。于9月8日结束,出苗至收获一共为122 d。
1.3 测定项目
分别在挑旗期和灌浆期测定叶片无机氮含量和叶片NR、NiR、GS以及GOGAT活性。在挑旗期和灌浆期各处理均选取3盆高粱,以每盆为单元进行破坏性采样。在晴朗上午的9:00—11:00选取上数第2—3片叶片,每个指标剪取约0.3 g叶片,采样后立即保存在液氮中带回实验室。测定无机氮含量的叶片贮存于-20℃低温冰箱内,测定酶活性的叶片贮存于-80℃超低温冰箱中用于后续分析,酶活性测定全过程保持在0℃—4℃。在收获期,同样以每盆为单元进行采样,将高粱籽粒和茎秆分开,用去离子水冲洗干净并于105℃下杀青30 min,65℃烘至恒重,把籽粒和茎秆分别称重后粉碎,然后进行全氮的测定。
1.3.1 硝态氮和铵态氮测定 参照Balotf等[18]的方法测定叶片硝态氮和铵态氮。高粱叶片用30 mmol·L-1的硫酸研磨后,置于沸水浴中30 min,20 000×
1.3.2 亚硝态氮和硝酸还原酶(NR)、亚硝酸还原酶(NiR)活性 参照Rajasekhar等[19]和Ding等[20]的方法测定NR、NiR活性。叶片置于预冷的研钵中,加入石英砂和磷酸缓冲液(pH 7.5,含10 mmol·L-1的半胱氨酸和0.05 mmol·L-1的EDTA),冰浴研磨。18 000×mol·L-1的KNO3,0.4 ml NADH后混匀,25℃下反应30 min后,依次加入4 ml磺胺,4 mlN-(1-萘基)乙二胺二盐酸盐,显色20 min后于12 000×Rajasekhar等[19]的方法
1.3.3 谷氨酰胺合成酶(GS)和谷氨酸合成酶(GOGAT)活性 将叶片置于预冷的研钵中,加入石英砂和磷酸缓冲液(pH 7.2,含50 mmol·L-1的K2SO4和0.5 mmol·L-1的EDTA),冰浴研磨。20 000×Ding等[20]的方法,酶活性用每小时催化产生的γ-谷氨酰异羟肟酸与铁络合物的吸光值来表示。GOGAT的测定则采用叶利庭等[21]的方法,取0.4 ml 20 mmol·L-1的谷氨酰胺,0.5 ml 20 mmol·L-1的2-酮戊二酸,0.1 ml 10 mmol·L-1的KCl,0.3 ml的粗酶液,0.2 ml 3 mmol·L-1NADH,1.5 ml磷酸缓冲液混匀后于340 nm处每30 s测定一个吸光值,连续测定11次。一个GOGAT活性单位定义为每分钟反应混合液减少1 μmol NADH所需酶的量。
1.3.4 全氮含量的测定 称取0.50 g植株样,加入浓硫酸以及催化剂,420℃消煮2 h后用全自动凯氏定氮仪测定全氮含量[2]。
1.3.5 参数计算本文中涉及的相关指标计算公式如下:
植株氮累积量=某一部位全氮浓度×该部位生物量
氮收获指数(%)=籽粒氮累积量/植株氮累积量
氮肥偏生产力(g·g-1)=籽粒产量/施氮量[16]
氮素吸收效率(g·g-1)=植株氮累积量/土壤供氮量[8,12]
氮素利用效率(g·g-1)=籽粒产量/植株氮累积量[15]
相对值=低氮处理下性状表型值/高氮处理下性状表型值[22]
1.4 数据统计分析
2 结果
2.1 不同基因型高粱在高氮和低氮处理下的生物量和产量构成因素
与高氮处理相比,低氮处理下的冀蚜2号、TX7000B的花期分别推迟0.5和5 d,而耐低氮型高粱在低氮条件下提前开花,SX44B和TX378较高氮处理分别提早1和3 d。由表1可知,不同基因型高粱收获期高粱地上部生物量对氮肥的响应不同。低氮显著降低了冀蚜2号的地上部生物量,对TX7000B和SX44B生物量没有影响,同时低氮处理显著增加了TX378的地上部生物量(<0.05)。对于耐低氮型高粱而言,低氮条件下高粱地上部生物量没有降低。
低氮处理显著降低了低氮敏感型高粱的籽粒产量(<0.05),较高氮处理,冀蚜2号和TX7000B籽粒产量分别下降13.87%和19.25%,但对SX44B籽粒产量没有影响,而且低氮处理下TX378的籽粒产量显著增加,较高氮处理增加24.91%。低氮处理下低氮敏感型高粱产量降低原因不同(表1)。较高氮处理,低氮处理的冀蚜2号千粒重降低10.00%,尽管冀蚜2号低氮处理没有降低籽粒数量,但是由于千粒重的下降导致其产量下降;TX7000B籽粒数量降低32.91%,是低氮处理TX7000B产量降低的最主要的原因。另外,低氮处理下的TX378单穗籽粒数增加,最终使得产量增加。
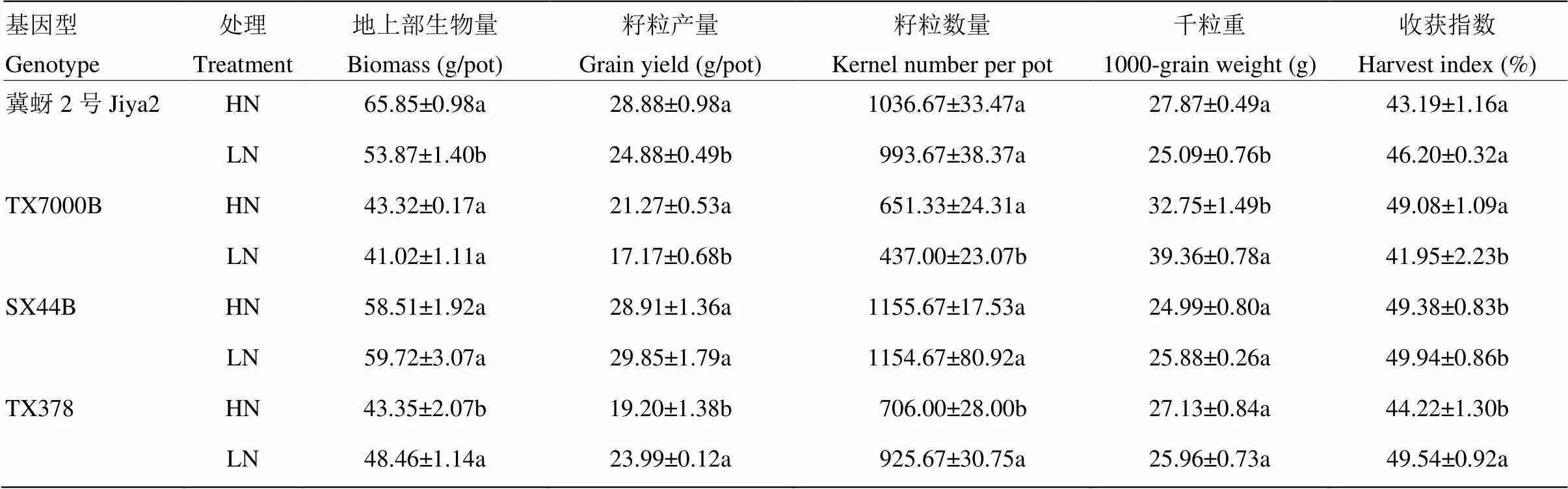
表1 不同氮处理对不同基因型高粱的生物量、籽粒产量构成因素的影响
表中同一高粱基因型各指标后的不同小写字母表示两个处理在0.05水平上差异显著。下同
Values within a column followed by different letters of the same genotype represent significant difference at0.05 level. The same as below
2.2 不同基因型高粱的氮素累积量及氮效率
由表2可知,低氮处理显著降低了籽粒氮累积量、地上部植株氮累积量,显著提高了氮收获指数(<0.05)。高粱在高氮、低氮处理下的相对籽粒氮累积量、相对植株氮累积量以及相对氮收获指数和高粱是否耐低氮表现并不完全一致。低氮处理下,冀蚜2号和TX7000B的籽粒氮累积量较高氮处理分别降低42.04%和35.99%,而SX44B和TX378则分别降低40.96%和22.27%;冀蚜2号和TX7000B的植株氮累积量较高氮处理分别降低47.77%和39.97%,SX44B和TX378则分别降低43.89%和32.31%;冀蚜2号和TX7000B的氮收获指数较高氮处理分别提高11.90%和6.54%,SX44B和TX378则分别提高5.20%和15.06%。
低氮处理显著地提高了4个基因型高粱的氮肥偏生产力和氮素利用效率(<0.05)(表2)。SX44B和TX378在低氮处理下的氮肥偏生产力是高氮处理6.19和7.49倍,冀蚜2号和TX7000B分别是5.17和4.85倍;SX44B和TX378在低氮处理下的氮素利用效率是高氮处理的1.84和1.85倍,冀蚜2号和TX7000B则分别是1.67和1.35倍。耐低氮型高粱的相对氮肥偏生产力和相对氮素利用效率均高于低氮敏感型高粱。
2.3 植株氮累积量、氮素利用效率和籽粒产量的关系
由表3可知,在高氮和低氮处理下,高粱的植株氮累积量和氮素利用效率均和籽粒产量呈显著正相关。由直接通径系数和决策系数可知,植株氮累积量和氮素利用效率均对高粱的籽粒产量起促进作用。在高氮处理下,植株氮累积量和氮素利用效率对籽粒产量的影响一样大;而在低氮处理下,氮素利用效率的影响要大于植株氮累积量,表明在低氮处理下较高的氮素同化能力更容易促进高粱产量的增加。
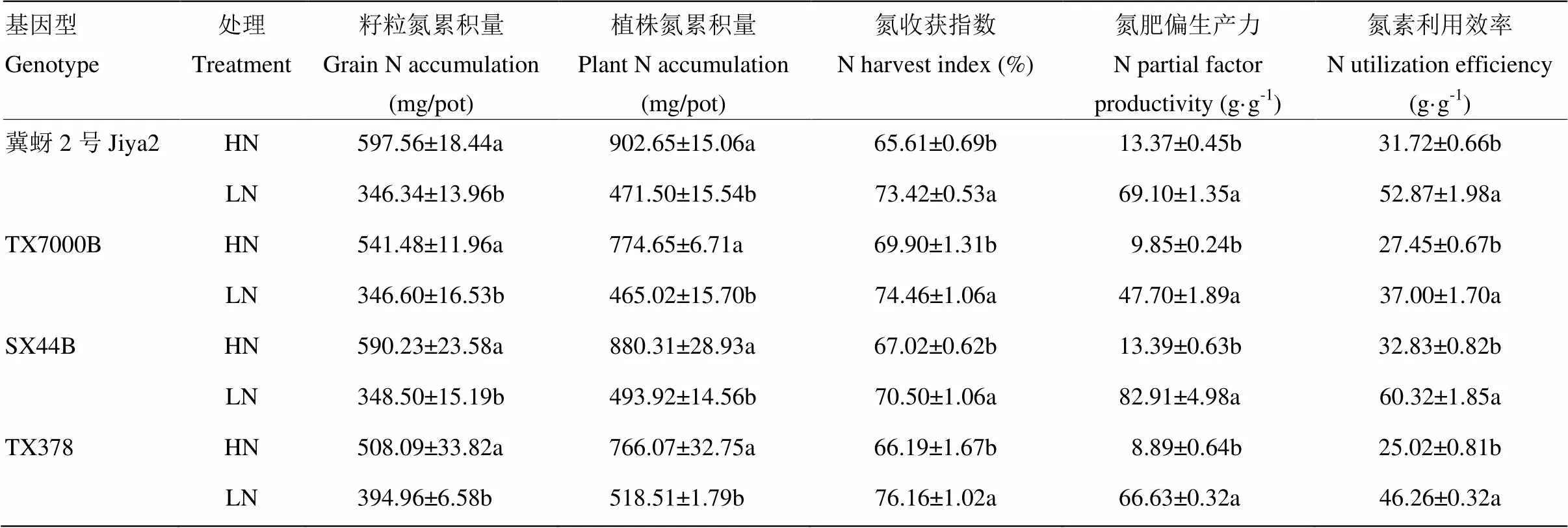
表2 不同氮处理对不同基因型高粱氮累积量、氮效率相关指标的影响
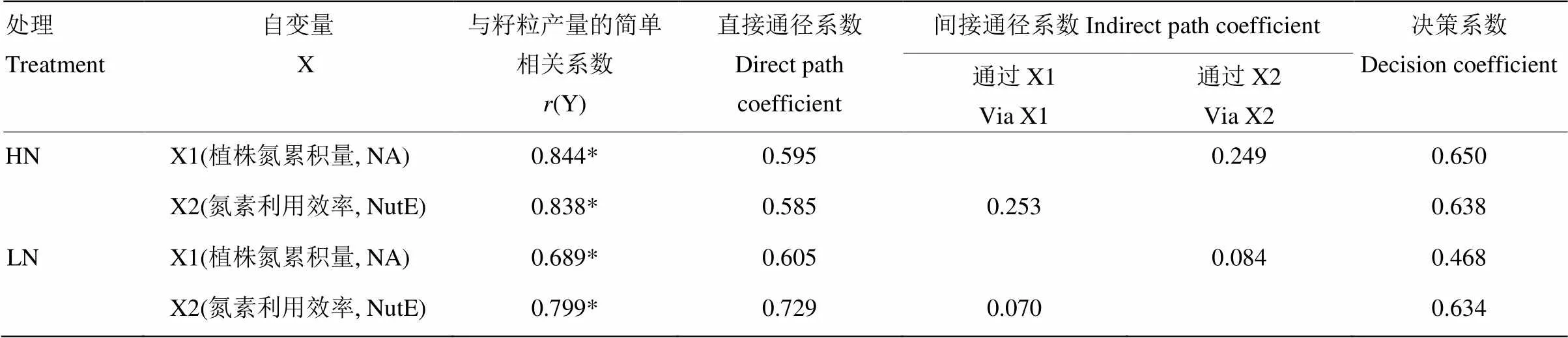
表3 植株氮累积量和氮素利用效率与籽粒产量的简单相关系数分解
X:自变量Independent variable;(Y):与籽粒产量的简单相关系数Simple coefficient with grain yield;NA:植株氮累积量Nitrogen accumulation;NutE:氮素利用效率Nitrogen utilization efficiency
2.4 不同基因型高粱高氮和低氮处理下叶片无机氮含量
叶片是氮素同化的主要场所,经根部吸收的无机氮经木质部运输到叶片中进行一系列同化反应[23]。在挑旗期和灌浆期,冀蚜2号低氮处理的叶片硝态氮含量均显著低于高氮处理(<0.05)。低氮处理对TX7000B的叶片硝态氮含量没有影响,显著降低了SX44B灌浆期和TX378挑旗期的叶片硝态氮含量(表4)。叶片中的硝态氮在硝酸还原酶催化下,被进一步同化为亚硝态氮[23]。从表4可以看出,除挑旗期冀蚜2号外,低氮处理对冀蚜2号灌浆期以及其余3个基因型挑旗期和灌浆期的叶片亚硝态氮含量均没有影响。4个基因型均表现出灌浆期叶片亚硝态氮含量较挑旗期显著降低。亚硝态氮在叶片内被进一步同化为铵态氮,除TX378外,低氮处理显著降低了其余3个基因型的叶片铵态氮含量(<0.05)。叶片挑旗期和灌浆期叶片铵态氮含量变化和亚硝态氮含量变化规律相似(表4)。
2.5 不同基因型高粱在高氮和低氮处理下的叶片氮同化酶活性
经高粱根吸收的无机氮需要进行一系列反应,才能合成植物所需要的氨基酸、蛋白质等物质,各氮同化酶在同化过程中起着关键作用[23]。NR是无机氮同化反应链的第一个酶,4个基因型高粱均表现出高氮处理的NR活性高于低氮处理,说明低氮处理均会降低叶片NR活性。从表5可以看出,耐低氮型高粱叶片NR活性受低氮处理影响小于低氮敏感型高粱。在挑旗期,冀蚜2号和TX7000B的低氮处理叶片NR活性较高氮处理分别降低6.33%和34.25%,SX44B和TX378分别为5.69%和0.83%;灌浆期,低氮处理对NR活性的影响更明显,冀蚜2号和TX7000B的低氮处理NR活性较高氮处理分别降低35.77%和51.69%,SX44B和TX378则分别为3.84%和8.98%。低氮下较高的NR活性和高粱的耐低氮特性有较好的一致性。低氮处理对4个基因型高粱叶片中NiR影响没有明显的规律性(>0.05)(表5)。

表4 不同氮处理对不同基因型高粱叶片硝态氮、亚硝态氮和铵态氮含量
FLS:挑旗期;GFS:灌浆期。下同
FLS: Flag leaf stage; GFS: Grain filling stage. The same as below
经NiR催化后生成的氨经GS/GOGAT途径参与后续同化反应[23]。不同基因型高粱叶片GS活性对低氮和高氮处理的响应不同。在挑旗期,低氮处理的冀蚜2号和TX7000B的叶片GS活性较高氮处理分别降低39.34%和16.62%;灌浆期分别降低36.76%和68.38%。低氮处理对SX44B挑旗期和灌浆期的叶片GS活性都没有影响,TX378低氮处理两个时期的叶片GS活性较高氮处理均显著增加(<0.05)(表5)。经GS催化生成的谷氨酰胺继续在GOGAT催化下生成谷氨酸[23]。从5可以看出,较高氮处理,低氮处理下的低氮敏感型高粱在挑旗期和灌浆期GOGAT活性均显著降低(<0.05)。冀蚜2号低氮处理挑旗期和灌浆期GOGAT活性较高氮处理分别降低30.26%和31.81%;TX7000B分别降低23.62%和48.20%。SX44B在挑旗期和灌浆期,低氮处理的叶片GOGAT活性较高氮处理均增加,但不显著。TX378挑旗期低氮处理的叶片GOGAT活性较高氮处理降低22.86%,灌浆期则增加23.99%,说明缺氮对耐低氮型高粱叶片GOGAT活性的影响小于低氮敏感型高粱。
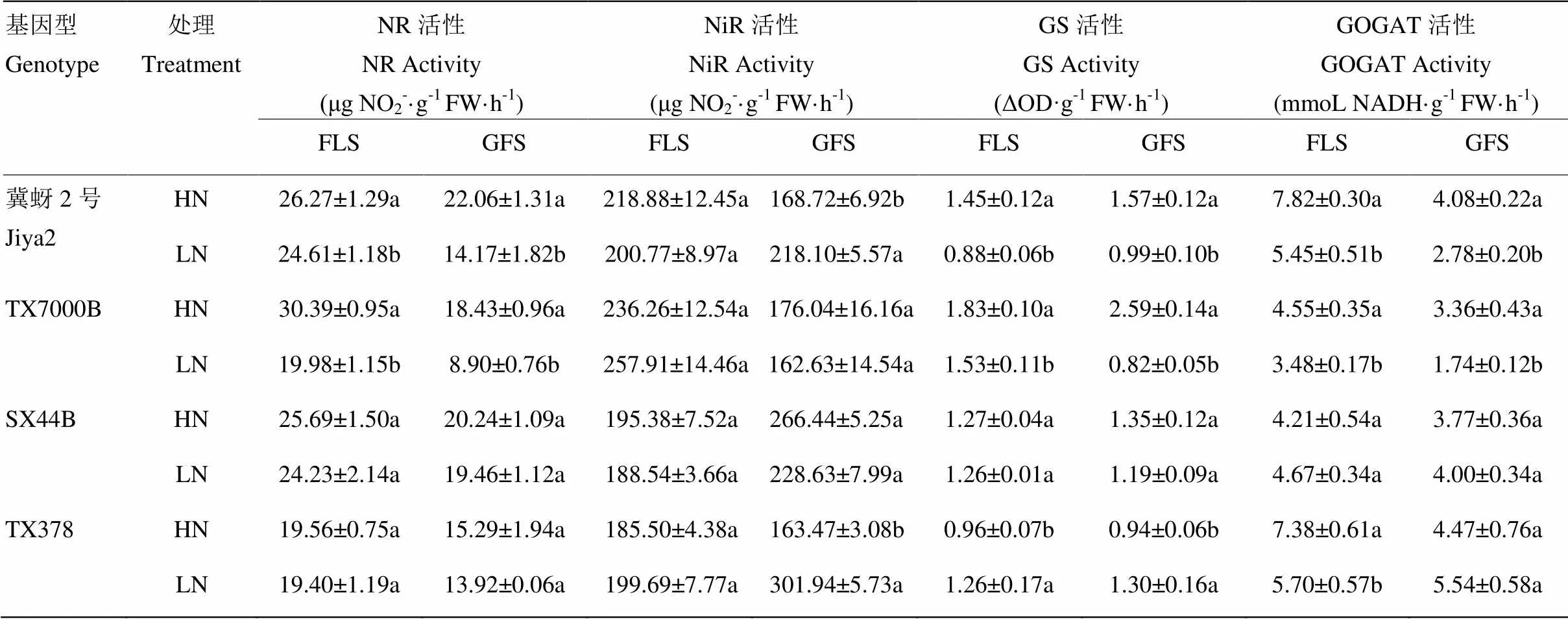
表5 不同氮处理对不同基因型高粱叶片氮同化酶活性
3 讨论
在本盆栽试验中,低氮敏感型高粱冀蚜2号和TX7000B低氮处理的产量较高氮处理显著降低,而耐低氮型高粱SX44B和TX378低氮处理的籽粒产量较高氮处理没有降低(表1),这和前期鉴定试验趋势表现一致[17]。本试验中高粱籽粒产量偏低,这与两次试验的种植时间、种植地点、种植密度以及生长环境等条件不同有关。TX378高氮处理的籽粒产量低于低氮处理,这可能是由于TX378具有对氮需求量小以及耐高肥能力弱的特点,导致高氮处理下产量表现不佳,仍需进一步研究。
作物的耐低氮胁迫指数是指低氮(或者不施氮)处理下性状表型值与高氮处理下性状表型值的相对比值[22,24],可以用低氮与高氮处理下的相对植物干重、相对生物量、相对氮累积量、相对氮素利用效率等指标来辅助筛选耐低氮作物[22,24-25]。本试验中,相对籽粒氮累积量、相对植株氮累积量以及相对氮收获指数与高粱是否耐低氮表现不一致,相对氮肥偏生产力和相对氮素利用效率和高粱耐低氮表现一致。
3.1 高粱产量同氮素吸收效率和氮素利用效率的关系
低氮胁迫下,植物通常会在生理和形态等方面发生适应性改变以增加氮素吸收或者提高已吸收氮素的利用,从而减小缺氮对植物的影响[11-12, 14-15]。氮效率是籽粒产量与土壤供氮量的比值,氮素吸收效率是植株氮累积量与土壤供氮量的比值[8, 26]。土壤的供氮量包括肥料用量以及土壤中可以被植物所利用的氮总量,由于土壤中可被植物利用的氮总量难以准确测定,所以根据氮效率的计算公式,在同一供氮水平下可以认为土壤供氮量相同,即氮效率和氮肥偏生产力的大小均可以用籽粒产量来表征;同理,在同一个供氮处理下,高粱地上部植株氮的累积量大小也可以用来表征氮素吸收效率[27]。
对于氮效率而言,氮素吸收效率和氮素利用效率哪个更加重要尚无统一报道。据张亚丽[10]、Moll等[8]的研究,作物的氮素吸收效率和氮素利用效率对氮效率的相对贡献率和土壤的氮肥供应能力有关。对小麦和水稻而言,低氮条件下的产量主要取决于氮素吸收效率[10,28],而在高氮条件下,小麦品种间的氮效率遗传变异主要源于氮素利用效率的变异[29]。Moll等[8]认为,低氮和中氮条件下,玉米的产量和氮效率主要和氮素吸收效率有关,高氮下主要和氮素利用效率有关;而Worku等[30]则认为,无论氮水平如何,氮素吸收效率和氮素利用效率对产量和氮效率有着同等重要的贡献。本试验中,在高氮条件下,氮素吸收效率和氮素利用效率均和产量和氮效率呈显著正相关,且贡献相同,表明在氮肥充分时,良好的氮素吸收以及氮肥同化能力有助于获得较高产量;而在低氮条件下,氮素吸收效率和氮素利用效率仍然和籽粒产量以及氮效率呈显著正相关,但是氮素吸收效率对产量和氮效率的重要性低于氮素利用效率,本试验中的耐低氮型高粱SX44B和TX378的相对氮素利用效率高于低氮敏感型高粱冀蚜2号和TX7000B。培育耐低氮型高粱可以重点考虑如何充分挖掘高粱自身潜力,提高低氮条件下高粱的氮素利用能力,从而提高瘠薄地上的高粱产量。
3.2 叶片无机氮含量、氮同化酶活性和高粱耐低养分特性的关系
本试验中,高粱的叶片无机氮含量对低氮和高氮的响应没有明显规律,不能表征高粱是否具有耐低氮特性。灌浆期叶片无机氮含量较挑旗期显著下降,这与生育后期叶片的氮素吸收能力减弱有关[11,15]。
经高粱吸收的无机氮必须在体内进行同化,才能进一步合成为植物所必需的氨基酸、蛋白质等物质[26]。NR是氮还原过程中的第一个酶,它是一种诱导酶,硝酸盐的存在会促进NR的活性[13,31],本试验中,各基因型高粱高氮处理的NR活性均高于低氮处理。低氮处理下,各高粱的叶片NR活性均有不同程度降低,耐低氮型高粱的降幅低于低氮敏感型高粱,生育后期高粱叶片NR活性降低,但是耐低氮型高粱叶片仍保持着相对高的NR活性,这与谢孟林[32]、韩胜芳[11]、郭战玲等[33]的研究一致,表明NR活性与高粱的耐低氮特性有关。亚硝酸盐对植物细胞有很高的毒害作用,植物中存在维持高NiR活性以减少亚硝酸盐的机制[22]。本试验中,各材料NiR的活性均远高于NR活性,这与路文静[31]、韩胜芳[11]等的研究一致,但是本试验中各高粱的NiR活性和高粱是否耐低氮并没有表现出一致性,说明NiR并不能表征高粱耐低氮的特性。
经NiR催化后生成的氨仍需要进一步同化,GS/ GOGAT途径是正常条件下氨进一步同化的最主要的途径[34-35]。曾建敏等[16]提出GS和水稻的氮肥偏生产力显著正相关,Hirel等[36]也提出超表达GS基因可以提高玉米的籽粒产量。本试验中,在挑旗期和灌浆期,低氮敏感型高粱均有着较高的叶片GS活性。低氮处理显著降低了低氮敏感型高粱叶片GS活性,对耐低氮型高粱影响很小,表明高的GS活性对高粱的籽粒产量也有促进作用。催化生成的谷氨酰胺由GOGAT继续催化生成谷氨酸,该反应涉及碳水化合物的同化,是碳氮交互反应的关键节点[35]。Yamaya等[37]在水稻中超表达GOGAT基因后发现籽粒粒重增加,并指出GOGAT在籽粒灌浆中起重要作用。本试验中,低氮处理下,各高粱的叶片GOGAT活性均有不同程度降低,但是耐低氮型高粱的降幅远小于低氮敏感型高粱,表明高粱中的GOGAT同样对产量的形成有着重要作用。NR、NiR和GOGAT活性从挑旗期到灌浆期都表现出下降的趋势,GS活性则保持稳定甚至增加,这可能和GS在氮素再利用过程中发挥重要功能有关[34-35],仍需进一步研究。
4 结论
低氮处理下,耐低氮型高粱较低氮敏感型高粱有着更高的相对籽粒产量和相对氮素利用效率;高氮处理下,氮素吸收效率和氮素利用效率对氮效率贡献相同,而在低氮处理下,氮素利用效率对氮效率贡献大于氮素吸收效率;低氮处理显著降低了低氮敏感型高粱叶片硝酸还原酶(NR)、谷氨酰胺合成酶(GS)、谷氨酸合成酶(GOGAT)活性,对耐低氮型高粱影响较小。低氮处理下较高的叶片氮同化酶活性是高粱耐低氮的生理基础。
[1] Leiser W L, Rattunde H F, Piepho H P, Piepho H P, Parzies H K. Getting the most out of sorghum low-input field trials in west Africa using spatial adjustment., 2012, 198(5): 349-359.
[2] 王劲松, 焦晓燕, 丁玉川, 董二伟, 白文斌, 王立革, 武爱莲. 粒用高粱养分吸收、产量及品质对氮磷钾营养的响应. 作物学报, 2015, 41(8): 1269-1278.
Wang J S, Jiao X Y, Ding Y C,.Response of nutrient uptake, yield and quality of grain sorghum to nutrition of nitrogen, phosphorus and potassium., 2015, 41(8): 1269-1278. (in Chinese)
[3] Farré I, Faci J M. Comparative response of maize (, L.) and sorghum (L. Moench) to deficit irrigation in a Mediterranean environment., 2006, 83(1): 135-143.
[4] Ciampitti I A, Vara P P V. Historical synthesis-analysis of changes in grain nitrogen dynamics in sorghum., 2016, 7: 275.
[5] Yan H M, Ji Y Z, Liu J Y, Liu F, Hu Y F, Kuang W H. Potential promoted productivity and spatial patterns of medium- and low-yield cropland land in China., 2016, 26(3): 259-271.
[6] 张美俊, 乔治军, 杨武德, 冯美臣, 肖璐洁, 王冠, 段云. 不同糜子品种对低氮胁迫的生物学响应. 植物营养与肥料学报, 2014, 20(3): 661-669.
Zhang M J, Qiao Z J, Yang W D, Feng M C, Xiao L J, Wang G, Duan Y. Biological response of different cultivars of millet to low nitrogen stress., 2014, 20(3): 661-669. (in Chinese)
[7] Feng Y, Cao L Y, Wu W M, Shen X H, Zhan X D, Zhai R R, Wang R C, Chen D B, Cheng S H. Mapping QTLs for nitrogen-deficiency tolerance at seedling stage in rice (L.)., 2010, 129(6): 652-656.
[8] Moll R H, Kamprath E J, Jackson W A. Analysis and interpretation of factors which contribute to efficiency of nitrogen utilization., 1982, 74(3): 562-564.
[9] Raun W R, Johnson G V. Improving nitrogen use efficiency for cereal production., 1999, 91(3): 357-363.
[10] 张亚丽, 樊剑波, 段英华, 王东升, 叶利庭, 沈其荣. 不同基因型水稻氮利用效率的差异及评价. 土壤学报, 2008, 45(2): 267-273.
Zhang Y L, Fan J B, Duan Y H, Wang D S, Ye L T, Shen Q R. Variation of nitrogen use efficiency of rice different in genotype and its evaluation., 2008, 45(2): 267-273. (in Chinese)
[11] 韩胜芳, 李淑文, 吴立强, 文宏达, 肖凯. 不同小麦品种氮效率与氮吸收对氮素供应的响应及生理机制. 应用生态学报, 2007, 18(4): 807-812.
Han S F, Li S W, Wu L Q,. Responses and corresponding physiological mechanisms of different wheat varieties in their nitrogen efficiency and nitrogen uptake to nitrogen supply., 2007, 18(4): 807-812. (in Chinese)
[12] Good A G, Shrawat A K, Muench D G. Can less yield more? Is reducing nutrient input into the environment compatible with maintaining crop production?, 2004, 9(12): 597-605.
[13] Nath M, Tuteja N. NPKS uptake, sensing, and signaling and miRNAs in plant nutrient stress., 2016, 253(3): 767-786.
[14] Presterl T, Groh S, Landbeck M, Seitz G, Schmidt W, Geiger H H. Nitrogen uptake and utilization efficiency of European maize hybrids developed under conditions of low and high nitrogen input., 2010, 121(6): 480-486.
[15] 熊淑萍, 吴克远, 王小纯, 张捷, 杜盼, 吴懿鑫, 马新明. 不同氮效率基因型小麦根系吸收特性与氮素利用差异的分析. 中国农业科学, 2016, 49(12): 2267-2279.
Xiong S P, Wu K Y, Wang X C, Zhang J, Du P, Wu Y X, Ma X M. Analysis of root absorption characteristics and nitrogen utilization of wheat genotypes with different N efficiency., 2016, 49(12): 2267-2279.(in Chinese)
[16] 曾建敏, 崔克辉, 黄见良, 贺帆, 彭少兵. 水稻生理生化特性对氮肥的反应及与氮利用效率的关系. 作物学报, 2007, 33(7): 1168-1176.
Zeng J M, Cui K H, Huang J L, He F, Peng S B. Responses of physio-biochemical properties to N-fertilizer application and its relationship with nitrogen use efficiency in rice (L.)., 2007, 33(7): 1168-1176. (in Chinese)
[17] 王成, 王劲松, 丁玉川, 焦晓燕, 董二伟, 王立革, 武爱莲. 不同高粱基因型对氮磷钾缺乏的生物学响应. 山西农业科学, 2015, 43(9): 1133-1137.
Wang C, Wang J S, Ding Y C, Jiao X Y, Dong E W, Wang L G, Wu A L. Biological response of different genotypes of sorghum under deficiency of nitrogen, phosphorus and potassium., 2015, 43(9): 1133-1137. (in Chinese)
[18] Balotf S, Kavoosi G, Kholdebarin B. Nitrate reductase, nitrite reductase, glutamine synthetase, and glutamate synthase expression and activity in response to different nitrogen sources in nitrogen-starved wheat seedlings., 2015, 63(2): 220-229.
[19] Rajasekhar V K, Mohr H. Appearance of nitrite reductase in cotyledons of the mustard (L.) seedling as affected by nitrate, phytochrome and photooxidative damage of plastids., 1986, 168(3): 369-376.
[20] Ding Y, Luo W, Xu G. Characterisation of magnesium nutrition and interaction of magnesium and potassium in rice., 2006, 149(2): 111-123.
[21] 叶利庭, 吕华军, 宋文静, 图尔迪, 沈其荣, 张亚丽. 不同氮效率水稻生育后期氮代谢酶活性的变化特征. 土壤学报, 2011, 48(1): 132-140.
Ye L T, LÜ J H, Song W J,. Variation of activity of N metabolizing enzymes in rice plants different in N use efficiency at their late growth stages., 2011, 48(1): 132-140. (in Chinese)
[22] Wei D, Cui K, Ye G, Pan J, Xiang J, Huang J, Nie L. QTL mapping for nitrogen-use efficiency and nitrogen-deficiency tolerance traits in rice., 2012, 359(1/2): 281-295.
[23] Lea P J, Gaudry J F.. Berlin: Springer Berlin Heidelberg, 2001.
[24] Feng Y, Cao L Y, Wu W M, Shen X H, Zhan X D, Zhai R R, Wang R C, Chen D B, Cheng S H. Mapping QTLs for nitrogen-deficiency tolerance at seedling stage in rice (, L.)., 2010, 129(6): 652-656.
[25] 赵化田, 王瑞芳, 许云峰, 安调过. 小麦苗期耐低氮基因型的筛选与评价. 中国生态农业学报, 2011, 19(5): 1199-1204.
Zhao H T, Wang R F, Xu Y F, An D G. Screening and evaluating low nitrogen tolerant wheat genotype at seedling stage., 2011, 19(5): 1199-1204. (in Chinese)
[26] Bingham I J, Karley A J, White P J, Thomas W T, Russell J R. Analysis of improvements in nitrogen use efficiency associated with 75 years of barley breeding., 2012, 42(42): 49-58.
[27] 戢林, 李廷轩, 张锡洲, 余海英. 氮高效利用基因型水稻根系形态和活力特征. 中国农业科学, 2012, 45(23): 4770-4781.
Ji L, Li T X, Zhang X Z, Yu H Y. Root morphological and activity characteristics of rice genotype with high nitrogen utilization efficiency., 2012, 45(23): 4770-4781. (in Chinese)
[28] 李淑文, 文宏达, 周彦珍, 李雁鸣, 肖凯. 不同氮效率小麦品种氮素吸收和物质生产特性. 中国农业科学, 2006, 39(10): 1992-2000.
Li S W, Wen H D, Zhou Y Z, Li Y M, Xiao K. Characterization of nitrogen uptake and dry matter production in wheat varieties with different N efficiency., 2006, 39(10): 1992-2000. (in Chinese)
[29] Gaju O, Allard V, Martre P, Snape J W, Heumez E, LeGouis J, Moreau D, Bogard M, Griffiths S, Orford S, Hubbart S, Foulkes M J. Identification of traits to improve the nitrogen-use efficiency of wheat genotypes., 2011, 123(2): 139-152.
[30] Worku M, Bänziger M, Erley G S A, Friesen D, Diallo A O, Horst W J. Nitrogen uptake and utilization in contrasting nitrogen efficient tropical maize hybrids., 2007, 47(2): 519-528.
[31] 路文静, 张树华, 郭程瑾, 段巍巍, 肖凯. 不同氮素利用效率小麦品种的氮效率相关生理参数研究. 植物营养与肥料学报, 2009, 15(5): 985-991.
Lu W J, Zhang S H, Guo C J, Duan W W, Xiao K. Studies on the physiological parameters related to nitrogen use efficiency in wheat cultivars with different nitrogen utilization., 2009, 15(5): 985-991. (in Chinese)
[32] 谢孟林, 李强, 查丽, 朱敏, 程秋博, 袁继超, 孔凡磊. 低氮胁迫对不同耐低氮性玉米品种幼苗根系形态和生理特征的影响. 中国生态农业学报, 2015, 23(8): 946-953.
Xie M L, Li Q, Zha L, Zhu M, Cheng Q B, Yuan J C, Kong F L. Effects of low nitrogen stress on the physiological and morphological traits of roots of different low nitrogen tolerance maize varieties at seedling stage., 2015, 23(8): 946-953. (in Chinese)
[33] 郭战玲, 沈阿林, 寇长林, 马政华, 王守刚. 不同小麦品种开花后硝酸还原酶活性与氮效率的关系. 中国农学通报, 2008, 24(5): 219-223.
Guo Z L, Shen A L, Kou C L, Ma Z H, Wang S G. The relationship between NRA and nitrogen efficiency of different wheat varieties after flowering., 2008, 24(5): 219-223. (in Chinese)
[34] Zheng Z L. Carbon and nitrogen nutrient balance signaling in plants., 2009, 4(7): 584-591.
[35] Lea P J, Miflin B J. Glutamate synthase and the synthesis of glutamate in plants., 2003, 41(6): 555-564.
[36] Hirel B, Gouis J L, Ney B, Gallais A. The challenge of improving nitrogen use efficiency in crop plants: towards a more central role for genetic variability and quantitative genetics within integrated approaches., 2007, 58(9): 2369-2387.
[37] Yamaya T, Obara M, Nakajima H, Sasaki S, Hayakawa T, Sato T. Genetic manipulation and quantitative-trait loci mapping for nitrogen recycling in rice., 2002, 53(370): 917-925.
(责任编辑 杨鑫浩)
Nitrogen Use Efficiency and Physiological Responses of Different Sorghum Genotypes influenced by Nitrogen Deficiency
LIU Peng1,3, WU AiLian2, WANG JinSong2, NAN JiangKuan2, DONG ErWei2, JIAO XiaoYan2, PING JunAi3, BAI WenBin3
(1College of Biological Engineering, Shanxi University, Taiyuan 030006;2Institute of Agricultural Environment and Resources, Shanxi Academy of Agricultural Sciences, Taiyuan 030031;3Institute of Sorghum, Shanxi Academy of Agricultural Sciences, Jinzhong 030600, Shanxi)
【Objective】The aim of this study was to investigate the genotypic variability for sorghum nitrogen (N) use efficiency and related traits, and the effects of low nitrogen stress on leaf inorganic nitrogen content and nitrogen assimilation enzymes of sorghum, so as to provide theoretical basis for further improvement in the cultivation of low-N tolerant sorghum genotypes. 【Method】The experiment was conducted in greenhouse by means of pot with soil medium. There were two N levels (HN: 0.24 g N·kg-1soil, LN: 0.04 g N·kg-1soil). Four sorghum genotypes, two of which were low-N susceptible genotypes (Jiya2 and TX7000B) and the other two were low-N tolerant genotypes (SX44B and TX378), were employed to explore the effects of low nitrogen stress on plant growth, yield, N use efficiency, leaf inorganic nitrogen (NO3--N, NO2--N and NH4+-N) content, and nitrogen assimilation enzymes in terms of nitrate reductase (NR), glutamine synthetase (GS) and glutamate synthetase (GOGAT) at both flag leaf and grain filling stages. 【Result】(1) Compared with the grain yield (GY) of HN treatment, LN treatment resulted in a decrease of 13.87% and 19.25% for Jiya2 and TX7000B, respectively,However, LN treatment didn’t decrease the GY of SX44B and TX378. (2) The relative grain N accumulation, relative plant N accumulation and relative N harvest index (ratios of trait values under LN treatment to those under HN treatment) were inconsistent with the low nitrogen tolerant performance of sorghum. By contrast, the low-N tolerant genotypes had a higher relative nitrogen partial factor productivity (NPFP) and relative nitrogen utilization efficiency (NutE) than low-N susceptible genotypes. The NPFP of SX44B and TX378 under LN treatment were 6.19 and 7.49 times than that under HN treatment, respectively, while the NPFP of Jiya2 and TX7000B were 5.17 and 4.85 times, respectively. The NutE of SX44B and TX378 under LN treatment were 1.84 and 1.85 times of that under HN treatment, whereas the values of Jiya 2 and TX7000B were 1.67 and 1.35 times, respectively. (3) Path analysis showed that plant nitrogen accumulation and NutE contributed the same to grain yield under HN treatment, while the importance of NutE was over plant nitrogen accumulation in defining the GY under LN treatment. (4) Leaf inorganic N content was irrelevant to the low N tolerance of sorghum. Leaf inorganic N content at flag leaf stage was significantly lower than that at grain filling stage. (5) LN treatment significantly decreased the leaf NR, GS and GOGAT activity of Jiya2 and TX7000B. On the contrary, leaf nitrogen assimilation enzyme activity of SX44B was not notably changed by N level, and leaf GS activity of TX378 was significantly increased under LN treatment.【Conclusion】Low-N tolerant sorghum genotypes had a higher relative GY and relative NutE under LN treatment. Maintaining relatively high nitrogen assimilation enzyme activity was the physiological basis of low-N tolerant sorghum genotypes. Exploring and utilizing sorghum germplasm resources with high nitrogen assimilation enzyme activity and high NutE under low nitrogen conditions should be helpful to improve the breeding efficiency of low-N tolerant sorghum genotypes.
(L.) Moench; nitrogen uptake efficiency; nitrogen utilization efficiency; nitrogen assimilation enzymes
2018-02-08;
2018-05-04
国家现代农业产业技术体系(CARS-06-13.5-A20)、山西省农业科学院优势课题组项目(YYS1707)、高粱遗传与种质创新山西省重点实验室项目(2016K-03)
刘鹏,E-mail:434466047@qq.com。
焦晓燕,E-mail:xiaoyan_jiao@126.com
10.3864/j.issn.0578-1752.2018.16.004
