葡萄全基因组DELLA蛋白基因家族鉴定及其应答外源 赤霉素调控葡萄果实发育的特征
张文颖,王晨,朱旭东,马超,王文然,冷翔鹏,郑婷,房经贵
葡萄全基因组DELLA蛋白基因家族鉴定及其应答外源 赤霉素调控葡萄果实发育的特征
张文颖1,王晨1,朱旭东1,马超2,王文然1,冷翔鹏3,郑婷1,房经贵1
(1南京农业大学园艺学院,南京 210095;2上海交通大学农业与生物学院,上海 200240;3青岛农业大学园艺学院,山东青岛 266109)
【目的】明确DELLA蛋白基因在葡萄基因组数据库中的数量、结构和组织表达差异,探究DELLA蛋白在葡萄赤霉素(GA)信号传导及葡萄无核果实发育机理中的作用机制。【方法】基于拟南芥、水稻等植物中的DELLA蛋白基因,利用HMMER程序和NCBI的CDD程序鉴定葡萄基因组中的DELLA蛋白基因;以‘白罗莎里奥’葡萄品种为试材,采用PCR技术克隆3个DELLA蛋白基因的cDNA全长序列;通过启动子作用元件分析预测其潜在功能;利用生物信息学软件对其染色体定位、基因结构、系统进化、理化特性、亚细胞定位及蛋白互作等进行分析;利用农杆菌介导的烟草瞬时表达技术分析DELLA蛋白的亚细胞定位情况;采用qRT-PCR方法检测葡萄DELLA蛋白基因应答GA在果皮、果肉、种子(或种子区)的时空表达特征。【结果】鉴定得到3个葡萄DELLA蛋白基因,克隆并验证其精确序列,分别命名为(VIT_201s0011g05260)、(VIT_214s0006g00640)及(VIT_211s0016g04630),其染色体定位、开放阅读框(ORF)大小、编码氨基酸数量分别为:Chr1、1 773 bp、590个;Chr14、1 710 bp、569个;Chr11、1 599 bp、532个。基因结构分析表明其DNA序列均无内含子,只有1个外显子,基因结构高度保守。进化分析显示VvGAI1与VvRGA亲缘关系较近,被聚类为一组,而VvSLR1为另一组。3个基因的启动子均含有响应赤霉素和胚乳发育相关的作用元件,表明它们可能参与响应GA信号传导和胚乳发育过程。亚细胞定位结果显示3个DELLA蛋白均定位于细胞核。qRT-PCR结果显示除果皮中在近成熟期具有表达高峰外,其余均在幼果期高表达,且外源GA处理均不同程度降低了3个DELLA蛋白基因在葡萄果皮、果肉和种子区的表达,尤以种子区下调水平最为显著。蛋白互作分析表明3个DELLA蛋白均为葡萄GA信号传导的核心作用元件,均可能与GIDI1和SLY1互作参与葡萄GA信号传导。【结论】葡萄基因组中含有3个DELLA蛋白基因家族成员;不同物种间DELLA蛋白结构高度保守;GA可能通过负调控这3个成员参与葡萄果皮、果肉和种子区的发育,且3个成员均可能通过应答GA信号调控葡萄无核果实的发育。
葡萄;DELLA;亚细胞定位;表达;互作;赤霉素
0 引言
【研究意义】赤霉素(gibberellic acid,GA)是植物生长发育必需的一类激素,在植物生命周期中的诸多时期都具有重要作用,如调控种子的萌发、茎及下胚轴的伸长、短枝和植株的矮化、叶片的延展、细胞膨大、表皮毛状体的发育、控制开花时间及花果发育等多种生理和发育过程[1-3]。DELLA蛋白是GA信号传导途径的核心作用元件,对植物的生长发育起负反馈调节作用[4-5]。目前,尽管拟南芥和水稻等模式植物已有较多的研究,但研究表明不同物种间DELLA蛋白基因成员数量存在一定的差异,其作用也有所不同[6-8]。葡萄是GA高度敏感的树种,GA可高效诱导葡萄无核,且广泛应用于葡萄无核化生产[9-10]。鉴定葡萄基因组中DELLA蛋白基因家族成员及其应答外源GA信号的时空表达规律,将有助于解析DELLA蛋白基因在葡萄无核果实发育过程中的作用机制,对更科学地调控葡萄果实的发育以及无核果实的生产具有重要意义。【前人研究进展】DELLA蛋白属于GRAS核转录调节因子家族,是GRAS家族中研究最为广泛的亚族之一[11]。N端具有高度保守的DELLA和TVHYNP酸性结构域,并且该区域在亚族不同成员中有所变化[12],中部有核定位信号结构域(nuclear localization sequence, NLS),C端有类似SH2、RVER和SAW的结构域。研究表明DELLA及TVHYNP结构域可能是GA信号感知结构域,C端的VHIID、SH2和SAW等结构域可能是GA信号阻遏结构域[13]。作为GA信号传导途径中的关键抑制因子,当无GA信号时,DELLA蛋白对植物的生长发育起抑制作用;在有GA的情况下,DELLA蛋白通过泛素化途径降解,从而解除其阻遏作用[14]。此外,DELLA蛋白可通过与不同的转录因子互作,调控下游基因的表达,进而实现对多种植物激素信号的调节[15]。研究发现不同物种中DELLA蛋白基因家族成员数量存在差异,拟南芥含有5个DELLA蛋白基因家族成员(、、、及)[6],而水稻中只有1个成员Os[11],大麦中只有1个成员[16]。近年来,越来越多植物的DELLA蛋白基因被克隆[17],但在葡萄方面,除笔者课题组前期做了初步的研究之外[18-19],尚未见到关于DELLA蛋白基因家族系统的研究报道。【本研究切入点】基因组测序使葡萄基因组中DELLA蛋白基因成员的分离与鉴定成为可能,但葡萄DELLA蛋白成员的系统鉴定、进化分析及GA介导DELLA蛋白调控葡萄果实发育的研究尚无相关报道,DELLA蛋白是否参与了葡萄无核果实的发育及其调控方式尚未明确。【拟解决的关键问题】以葡萄全基因组为基础,鉴定所有DELLA蛋白基因家族成员,克隆并验证其精确序列,揭示其染色体定位、结构特点、进化特征、亚细胞定位、蛋白互作等信息,明确葡萄DELLA蛋白家族基因在果皮、果肉、种子区中的表达特征及其应答外源GA的时空表达模式,为DELLA蛋白功能的解析和深入阐明赤霉素介导DELLA蛋白诱导葡萄无核的分子机理提供重要的理论依据。
1 材料与方法
1.1 试验材料处理
试验于2017年5月1日至8月11日在江苏句容农博园试验基地进行,供试品种为6年生欧亚种葡萄‘白罗莎里奥’(‘Rosario Bianco’),供试植株常规管理且生长健壮,株行距1 m×2.5 m,双十字V型架,避雨栽培。根据预试验结果,于花前10 d(2017年5月1日)用50 mg·L-1的GA3浸蘸葡萄花序30 s,清水处理为对照。每组处理选定12株长势较为一致的植株,每4株为1个重复,共设3次重复。分别于幼果期(花后10 d,5月28日)、硬核期(花后35 d,6月22日)、第2次膨大期(花后60 d,7月17日)、近成熟期(花后85 d,8月11日)4个果实发育时期采集葡萄果实样品,采集后的样品一半用于生理指标测定及体式显微镜观察等,另一半将果皮、果肉、种子区分别冻样,-80℃保存备用。
Prime ScriptTM反转录酶、DNase酶Ⅰ、Ex-酶、dNTPs、DNA Marker,荧光定量染料SYBR GreenⅠ均购自TaKaRa公司。各种引物由上海生工生物工程股份有限公司合成,其编号及序列见表1。
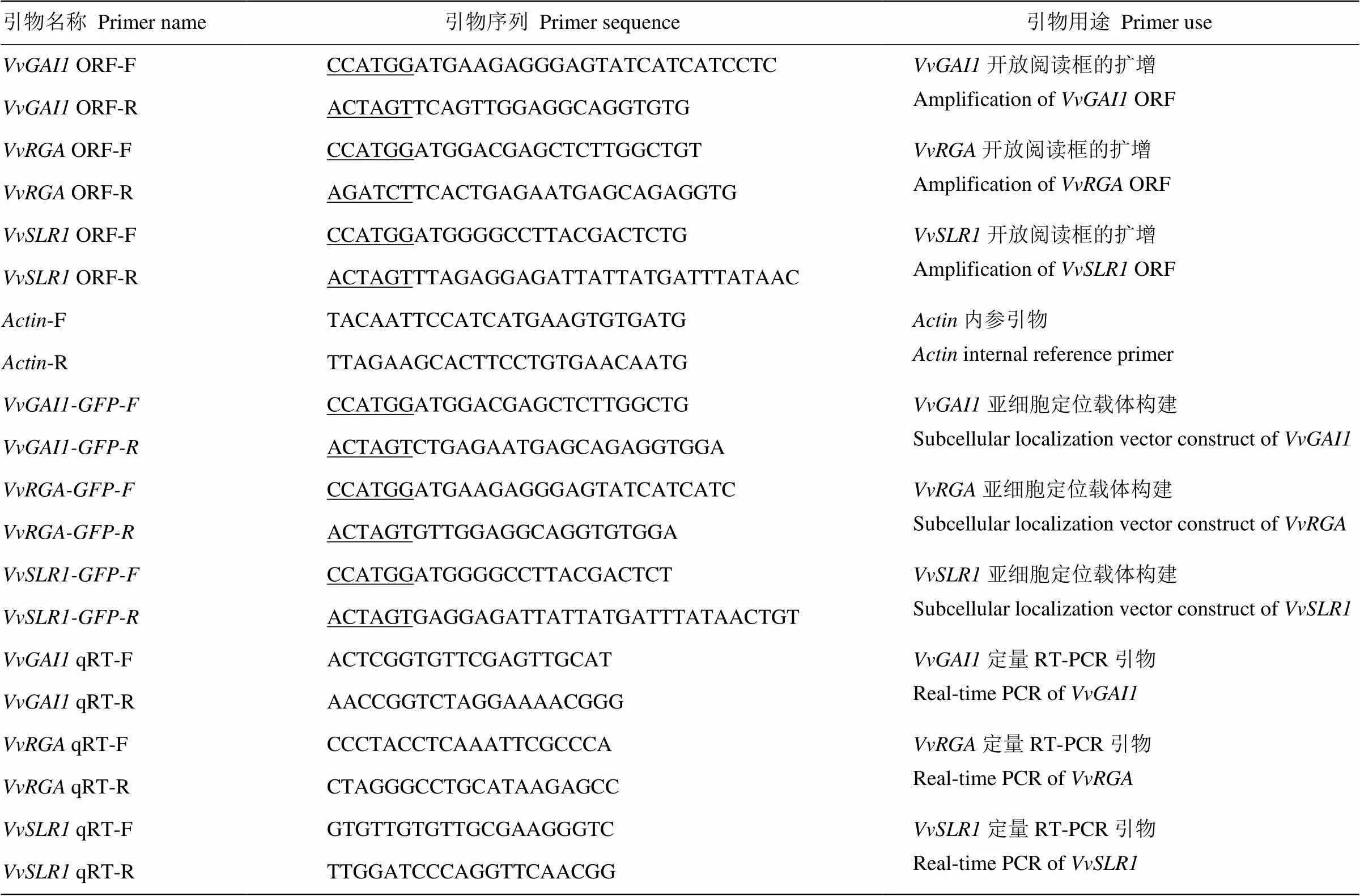
表1 引物序列及用途
下划线部分和分别为添加Ⅰ和Ⅰ酶切位点
The underlined sequencesandin the primers represent restriction enzyme sites ofⅠandⅠ, respectively
1.2 葡萄DELLA蛋白基因家族成员的鉴定
DELLA基因相关蛋白序列都包含GRAS和DELLA结构域,利用HMMER程序,以PFAM(http:/ /pfam.sanger.ac.uk)上的种子文件(GRAS: PF03514,DELLA: PF12041)为检索矩阵,检索葡萄CRIBI蛋白质数据库(http://genomes.cribi.unipd.it/grape/index. php),同时利用NCBI的CDD程序(http://www.ncbi. nlm.nih.gov/Structure/cdd/wrpsb.cgi)检查葡萄假定的DELLA相关基因结构域,对候选基因进一步确认,存在GRAS及DELLA结构域的蛋白序列属于DELLA蛋白家族。
1.3 总RNA的提取及cDNA的合成
采用笔者实验室改良的CTAB法[20]提取GA3处理与对照4个不同果实发育时期果皮、果肉及种子区的总RNA。cDNA的合成以提取的总RNA为模板,参考TaKaRa Prime ScriptTMRT-PCR试剂盒说明书进行反转录。
1.4 葡萄DELLA蛋白基因家族成员的克隆
以葡萄果皮的cDNA为模板,用相应引物(表1)进行PCR扩增。反应体系为50 μL:上下游引物各2 μL,cDNA 2 μL,10×PCR buffer(Mg2+plus)5 μL,dNTP Mixture 4 μL,Ex-酶0.50 μL。反应程序:95℃ 5 min;95℃ 30 s,58℃ 30 s,72℃ 2 min,35个循环;72℃ 10 min。4℃下保存。产物用1.5%的琼脂糖凝胶电泳检测后回收目的片段,连接至pMD19T载体进行TA克隆,DNA测序由上海生工生物工程股份有限公司完成。
1.5 葡萄DELLA蛋白基因家族的生物信息学分析
葡萄DELLA家族基因内含子、外显子和基因组定位信息均来自于葡萄基因组数据库CRIBI(http:// genomes.cribi.unipd.it/grape/index.php),染色体定位图运用MapInspect软件绘制;核苷酸及氨基酸序列利用NCBI的BLASTn和BLASTp(https://blast.ncbi.nlm. nih.gov/Blast.cgi)进行同源比对,使用MEGA 7.0.21软件,选用邻接法(neighbor-joining,NJ)构建系统进化树,校验参数为Bootstrap=1 000;利用在线工具MEME(http://meme-suite.org/tools/meme)鉴定蛋白保守基序,其参数设置基序数量10个,其余参数在默认条件下;利用本地软件Clustal X 2.1、DNAMAN 6.0及在线软件WebLogo 2.82(http://weblogo.berkeley.edu/ logo.cgi)进行蛋白多序列比对;利用在线软件GSDS 2.0(http://gsds.cbi.pku.edu.cn/index.php)绘制基因结构示意图;采用在线数据库(CDD,https//www.ncbi. nlm.nih.gov/Structure/cdd/cdd.shtml)进行保守结构域的分析;采用WoLF PSORT(http://www.genscript.com/ wolf-psort.html)在线软件进行亚细胞定位预测;利用在线软件PRABI(http://www.prabi.fr/)进行蛋白质二级结构进行预测;根据在线软件SWISS-MODEL(https://swissmodel.expasy.org/interactive)进行蛋白质三级结构分析。利用STRING(https://string-db.org/)在线软件进行蛋白互作分析。
1.6 启动子顺式作用元件分析
从葡萄基因组中找出DELLA蛋白基因转录起始位置(ATG)上游1 500 bp的序列,参考Fan等[21]的方法,利用PlantCARE在线数据库(http//bioinformatics. psb.ugent.be/webtools/plantcare/html/),进行启动子顺式作用元件分析。
1.7 DELLA蛋白亚细胞定位载体的构建和定位分析
根据3个DELLA蛋白基因的ORF序列(去除终止密码子)设计分别含有I、I 酶切位点的引物(表1),以DELLA蛋白基因完整的ORF区质粒为模板,通过PCR引入I和Ⅰ酶切位点,扩增产物经测序确认无任何突变后提取质粒,利用I和Ⅰ进行双酶切,用T4 DNA连接酶连接到pCAMBIA1302-GFP载体从而分别获得、:及融合表达载体,转入DH5,PCR、酶切筛选阳性克隆,并对阳性克隆进行测序验证。
选取具有4片真叶的野生型本氏烟草用于农杆菌侵染,参考杨占武等[22]的方法进行目的蛋白在烟草中的瞬时表达。撕取侵染后的烟草叶片下表皮在激光扫描共聚焦显微镜(TCS SP2,Leica,Germany)下观察荧光蛋白的亚细胞定位情况并拍照。
1.8 DELLA蛋白基因表达特性分析
分别以4个不同发育时期葡萄果皮、果肉和种子区总RNA反转录的cDNA为模板,以为内参基因,扩增体系及程序根据TaKaRa公司的SYBR®TMⅡ试剂盒说明书进行。进行3次生物学重复,所用引物见表1,采用2-ΔΔCt计算各基因的相对表达量,采用DPS 7.05软件对结果进行统计及差异显著性分析(<0.05)。
2 结果
2.1 赤霉素处理对‘白罗莎里奥’葡萄果实生长发育的影响
GA3处理后,果实无核率达到92%,葡萄果粒纵径、果形指数明显增加(图1-A),穗长、轴粗明显增加,但对果穗宽度的影响不大(图1-B),且这些现象均显著发生在幼果期(花后10 d)。该结果表明,赤霉素处理可明显拉长果穗,加粗穗轴,且可高效诱导‘白罗莎里奥’葡萄无核化。
2.2 葡萄全基因组DELLA蛋白基因家族成员的鉴定及克隆验证
利用生物信息学方法,从葡萄基因组中鉴定得到DELLA蛋白基因家族3个成员(VIT_ 201s0011g05260)、(VIT_214s0006g00640)及(VIT_211s0016g04630),染色体定位发现它们分别定位于chr1、chr11、chr14这3条不同的染色体(图2-A)。根据预测结果的基因序列设计特异引物,以葡萄各时期果皮混合cDNA为模板进行PCR扩增,分别克隆到3个含有完整ORF区的cDNA序列(图2-B),且3个电泳条带与预测的引物扩增片段大小一致,证实预测的3个基因在葡萄中真实存在。测序结果表明片段长度为1 773 bp,编码590个氨基酸;片段大小为1 710 bp,编码569个氨基酸;片段长为1 599 bp,编码532个氨基酸。

‘白罗莎里奥’葡萄生长发育的4个时期:10DAF:花后10 d;35DAT:花后35 d;60DAT:花后60 d;85DAT:花后85 d。图9、图10同
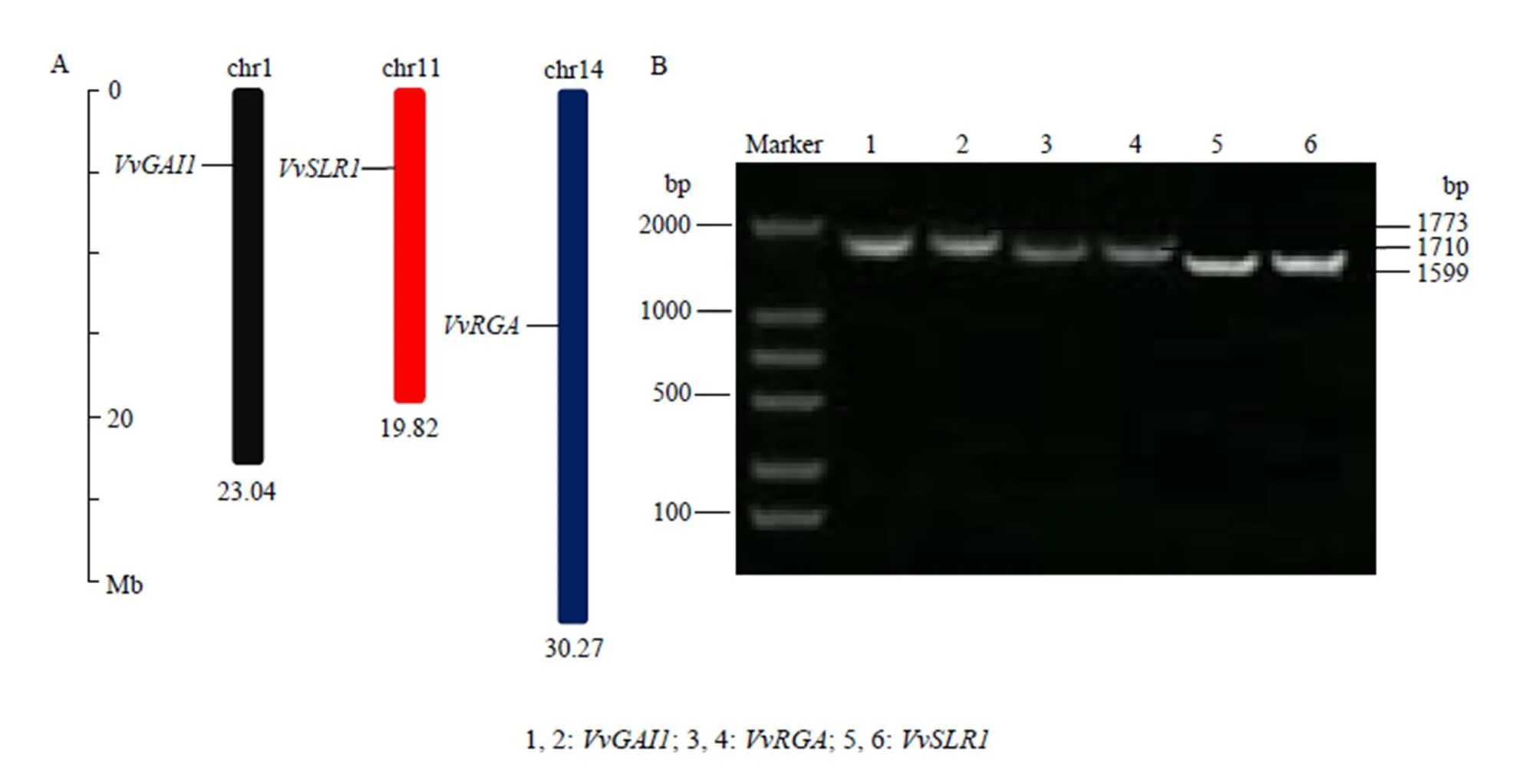
图2 葡萄DELLA蛋白基因的染色体定位(A)及cDNA全长PCR扩增产物电泳检测图(B)
2.3 DELLA蛋白基因生物信息学分析
2.3.1 DELLA蛋白氨基酸序列分析 根据3个DELLA蛋白基因cDNA编码的的氨基酸序列,分别与拟南芥、水稻、草莓、苹果、桃、核桃、枣、樱桃、甜瓜、番木瓜、番茄、莲、棉花进行同源比对。利用Clustal X 2.1和DNAMAN软件进行多重序列比对,发现不同物种DELLA蛋白氨基酸序列含有典型的DELLA结构域、TVHYNP结构域、VHVID结构域、RVER结构域、SAW结构域及核定位信号(NLS)(图3)。但在一些物种的不同成员中部分结构域有所变化,其中以DELLA结构域的变化最大,如SLR1在葡萄、莲、核桃、棉花、番木瓜、甜瓜中的DELLA结构域为DGLLA,草莓FvGAI的DELLA结构域也为DGLLA,表明DELLA蛋白家族在不同物种中的功能可能具有一定的多样性。
2.3.2 葡萄DELLA蛋白系统发育及蛋白保守基序分析 利用MEGA 7.0.21对同源比对结果进行进化分析,由图4-A可见,3个DELLA蛋白可被分为两组,其中VvGAI1与VvRGA在同一组中的不同亚组,而VvSLR1在另一组。且VvGAI1与拟南芥AtGAI和莲NnGAI1的亲缘关系较近,VvRGA与枣ZjGAI的同源性较高,而VvSLR1与莲NnSLR1的亲缘关系最近,表明不同物种DELLA蛋白系统发育关系可能存在一定的差异。由图4-B可知,各蛋白序列所包含的保守基序类型及数量虽有一定不同,但各类元件种类和数量总体较为固定,除核桃JrGAI1和JrGAI2N端不具有TVHYNP结构域(元件8)外,其余N端均含有DELLA保守结构域(元件7)、中部VHVID结构域(元件8)、C端RVER(元件3)及SAW结构域(元件6)(图4-C),揭示了其功能的保守性。
2.3.3 葡萄DELLA蛋白基因结构及蛋白保守结构域分析 根据蛋白同源比对结果,对葡萄和其他物种的DELLA蛋白基因进行结构分析,结果显示不同物种间DELLA蛋白基因结构高度保守,均含有1个外显子,无内含子(图5-A)。对DELLA蛋白保守域进行分析,发现不同物种间结构域高度保守,N端均含有DELLA结构域,C端含有GRAS结构域(图5-B),属于GRAS家族基因。

NLS:氨基酸区域内核定位信号;保守结构域:DELLA、TVHYNP、VHVID、RVER、SAW
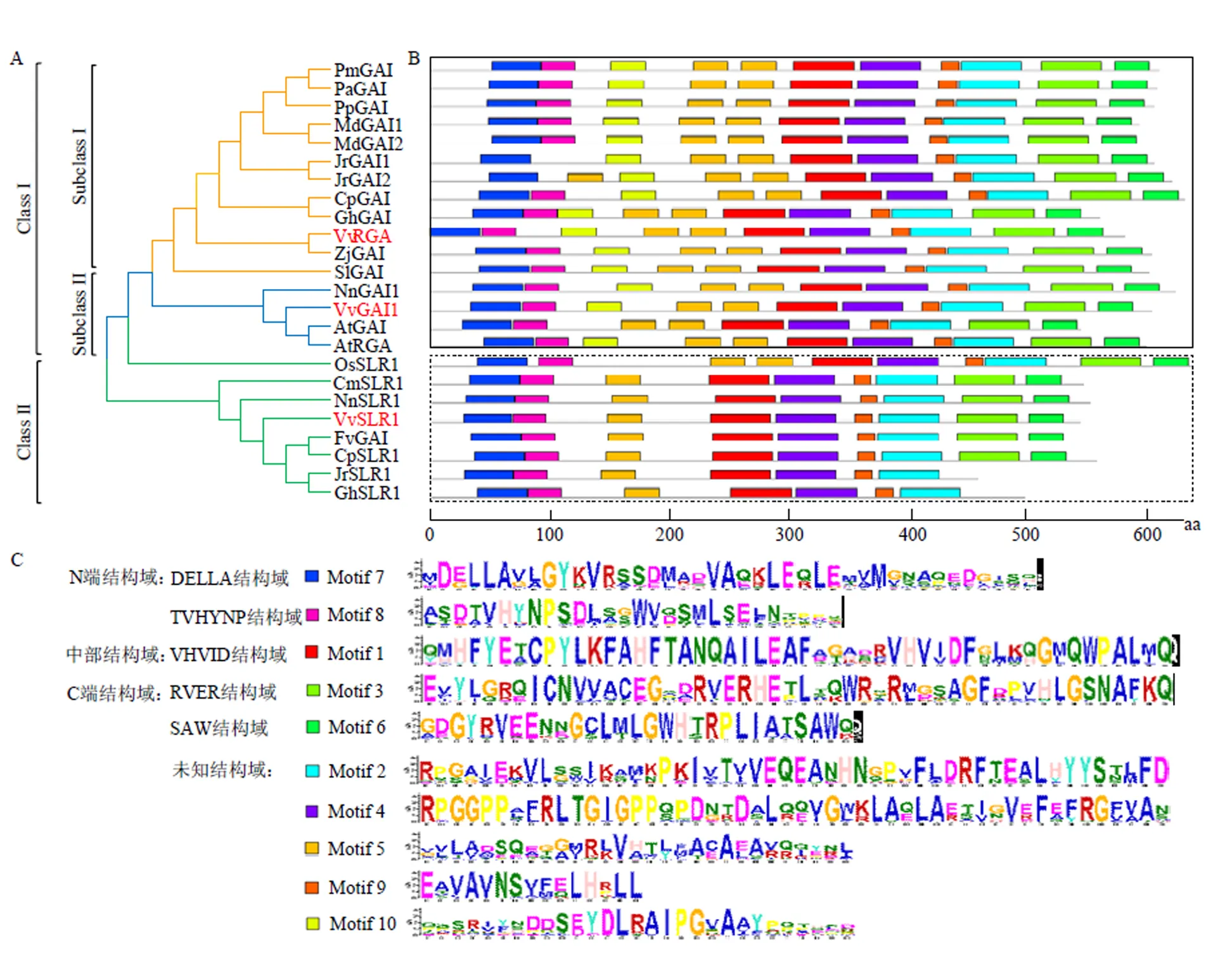
A:DELLA蛋白系统进化分析The phylogenetic relationships of DELLA proteins from various organisms;B:保守元件分布图The conservative element distribution figure;C:具体的保守元件碱基The specific conservative element residues
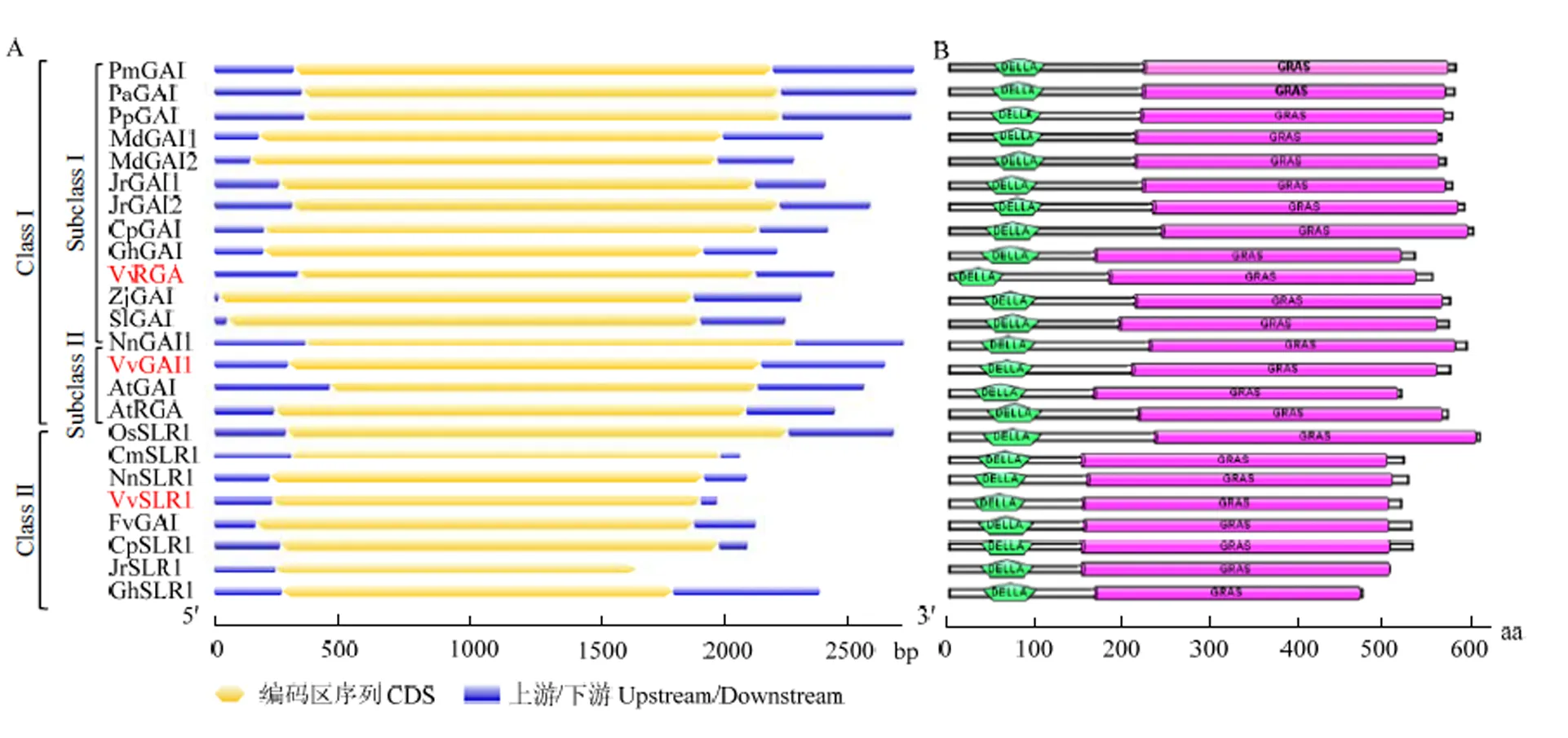
图5 DELLA蛋白基因结构(A)及保守结构域(B)预测
2.4 葡萄DELLA蛋白二、三级结构预测
对葡萄DELLA蛋白二级结构分析发现,三者二级结构均主要由-螺旋、-转角形式组成,且均以-螺旋为主,-转角结构较少(图6-A)。利用SWISS-MODEL进行三维结构同源建模,结果表明其蛋白三维空间排列所形成的蛋白质分子构象具有多样性(图6-B),且VvRGA与VvSLR1的蛋白构象更相似,表明其在某些方面可能具有相似的功能。

图6 葡萄DELLA蛋白二级(A)三级结构(B)预测
2.5 葡萄DELLA蛋白基因启动子作用元件分析
基因启动子的作用元件分析可以预测基因的潜在功能,为认识葡萄DELLA蛋白基因应答各种反应的潜在机制,本研究分析了它们启动子的顺式作用元件(图7-A)。结果显示,该家族的启动子作用元件大致可分为5类:光信号响应、激素相关响应、胁迫相关响应、组织特异性响应和昼夜周期节律相关元件(图7-A)。对比3个DELLA蛋白基因成员的作用元件发现,元件数量上,最多,其次是,而的元件数量最少。元件类型上,除不含有昼夜节律相关元件外,其余基因启动子均含有上述5类作用元件,其中以光响应元件数量最多,激素和组织特异性相关响应元件的数量次之,其次是胁迫相关响应元件,昼夜节律相关元件数量最少,且3个基因均含有胚乳发育相关的组织特异性元件。这些存在的调控元件说明葡萄DELLA蛋白基因家族成员不仅能够响应光、胁迫等外界环境信号,而且还能应答激素的影响,可能通过参与植物体内的生物学过程来共同调控葡萄无核果实的生长发育。

A:DELLA蛋白基因启动子不同类型顺式作用元件汇总The total number of diverse types of cis-elements derived from the DELLA protein gene promoters;B:DELLA蛋白基因激素相关顺式作用元件Hormone-related cis-elements of DELLA protein genes
为进一步认识DELLA蛋白基因在葡萄中响应激素的潜在作用,分析了与激素响应有关的作用元件。如图7-B所示,所有启动子均含有激素相关响应元件,主要包括GA、生长素(auxin,IAA)、水杨酸(salicylicacid,SA)及乙烯(ethylene,ET)、脱落酸(abscisic acid,ABA)、茉莉酸甲酯(methyl jasmonate,MeJA)等激素响应元件,表明这3个成员能够应答多种激素信号参与调控葡萄生长发育。值得注意的是,3个DELLA基因的启动子均具有响应GA、SA、MeJA和ABA的作用元件,其中GA和SA是葡萄花和浆果发育的关键激素,特别是与葡萄无核果的发育相关[23-24],表明DELLA蛋白基因可能通过响应激素信号参与无核葡萄的发育过程。
2.6 葡萄DELLA蛋白的亚细胞定位
亚细胞定位预测结果表明葡萄3个DELLA蛋白中VvGAI1、VvRGA集中分布在细胞核上,VvSLR1集中分布在细胞核和细胞质中(图8-A)。构建瞬时表达载体对预测结果进行进一步验证,结果表明,在转化空载体的GFP荧光信号分布在整个细胞,3个DELLA GFP的荧光信号主要分布在细胞核内,说明葡萄3个DELLA蛋白均定位在细胞核中(图8-B)。
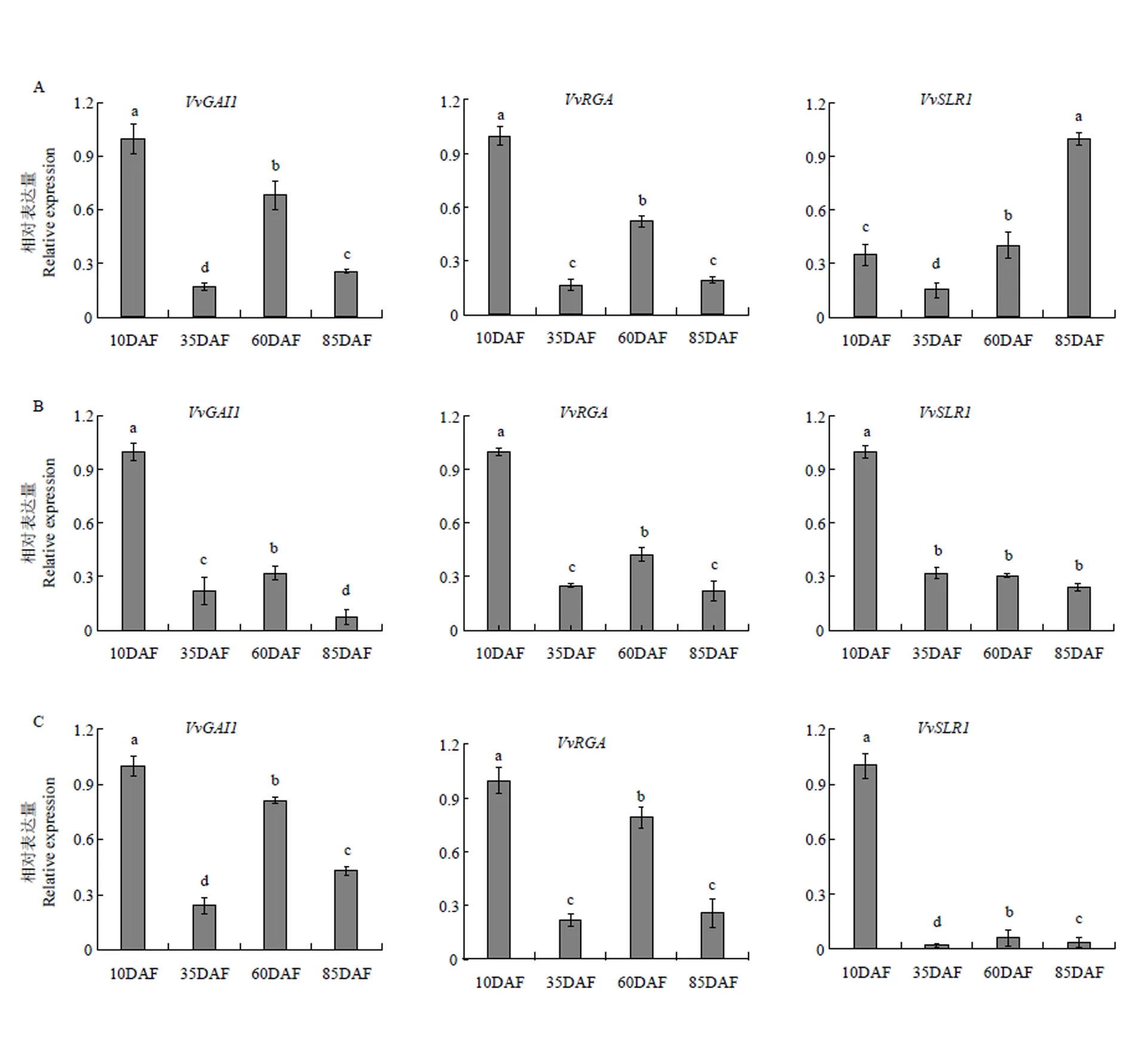
2.7 葡萄果实发育不同时期DELLA蛋白基因的时空表达特征
为认识DELLA蛋白基因在葡萄果实发育过程中的调控作用,利用qRT-PCR技术分别分析了3个DELLA基因在4个发育不同时期葡萄果皮、果肉及种子区的时空表达特征。由图9可看出,3个基因在不同组织不同时期的表达模式存在时空特异性,但总体看来与具有相似的表达模式,3个组织中均在幼果期(花后10 d)的表达量最高,在果实第2次膨大期(花后60 d)有较高表达,在其余2个时期低表达。与二者不同,在近成熟期(花后85 d)的果皮中具有表达高峰,在幼果期果肉与果核中的表达量也显著高于其他时期,但在其他时期的果核中几乎不表达,表明不同DELLA蛋白基因成员的作用方式不同。
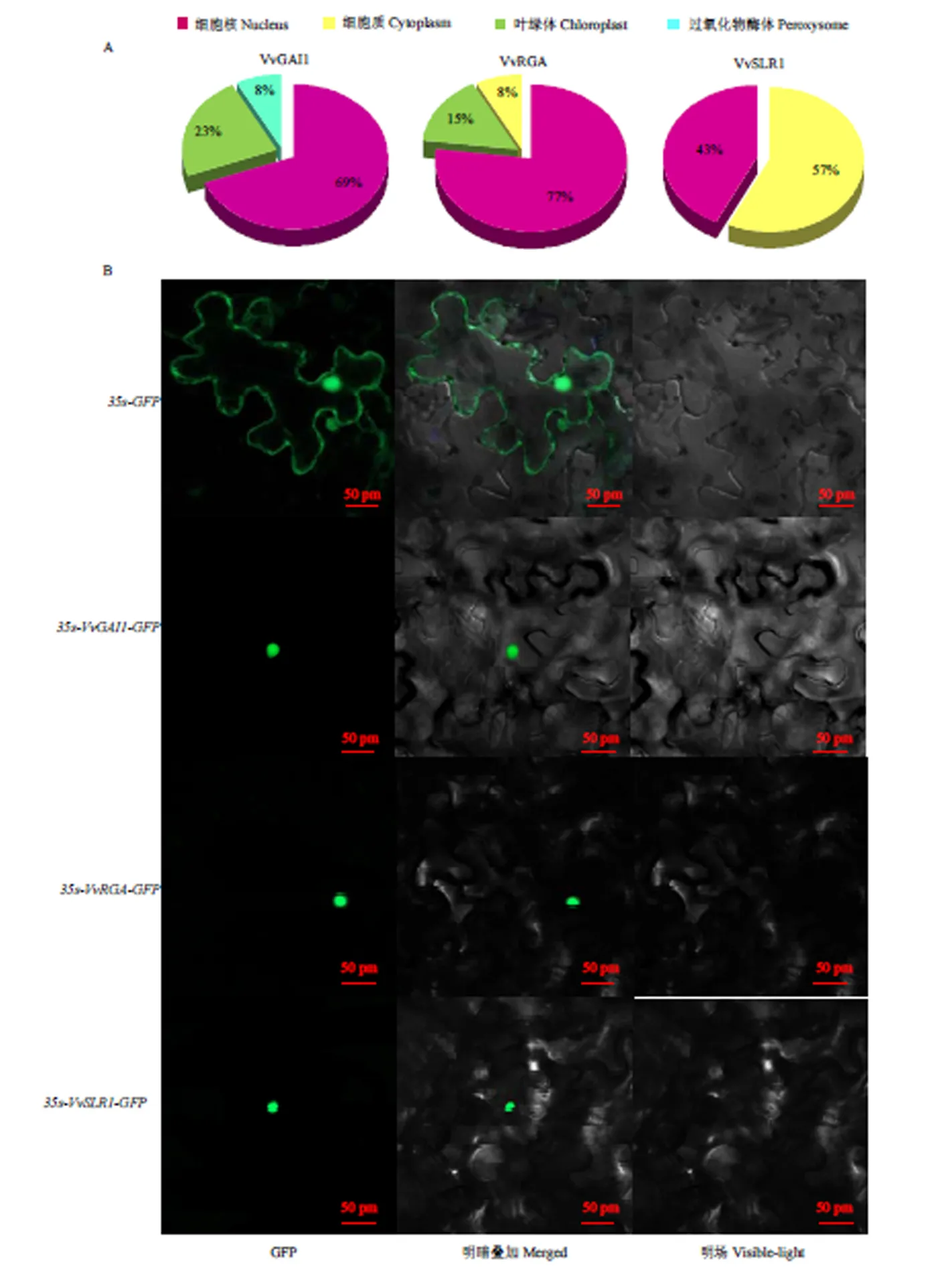
图8 葡萄DELLA蛋白亚细胞定位
A:果皮Berry pericarp;B:果肉Berry flesh;C:种子区Seed area。柱上不同字母表示差异显著 Different letters on the bars indicate significant difference (P<0.05)
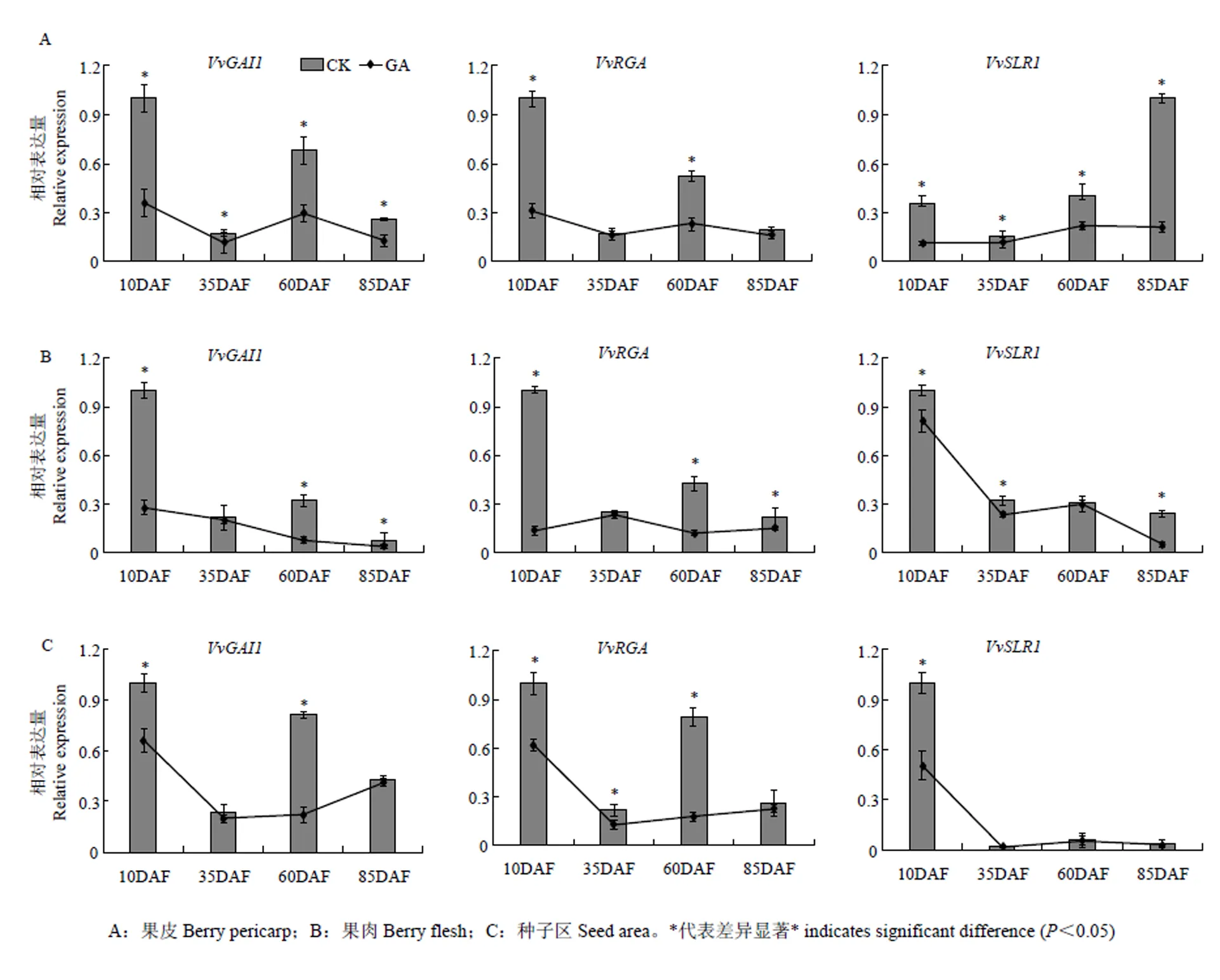
2.8 DELLA蛋白基因在GA诱导葡萄无核果实发育过程中的表达模式
为进一步认识葡萄DELLA蛋白基因在果实不同组织的不同发育时期对外源GA的响应模式,利用GA3处理和对照不同样品的cDNA为模板,对DELLA蛋白基因的表达进行定量分析。结果显示经GA3处理后,3个葡萄DELLA蛋白基因在不同发育时期葡萄果皮、果肉和种子区的表达水平均低于对照(图10),说明GA可通过抑制葡萄DELLA蛋白基因的表达参与调控葡萄果实的发育。进一步对比分析发现,和在果皮、果肉和种子区中具有相似的应答GA的表达模式,即它们在幼果期被GA显著下调。而在果实的3个不同组织中展现出不同的应答GA模式,在果皮中,仅在果实近成熟期被强烈抑制,而在果肉中的表达几乎不受GA影响,但在幼果期种子区中的表达却被GA显著下调,下调程度超过了和,表明在葡萄种子区是DELLA蛋白家族中应答GA的重要因子。
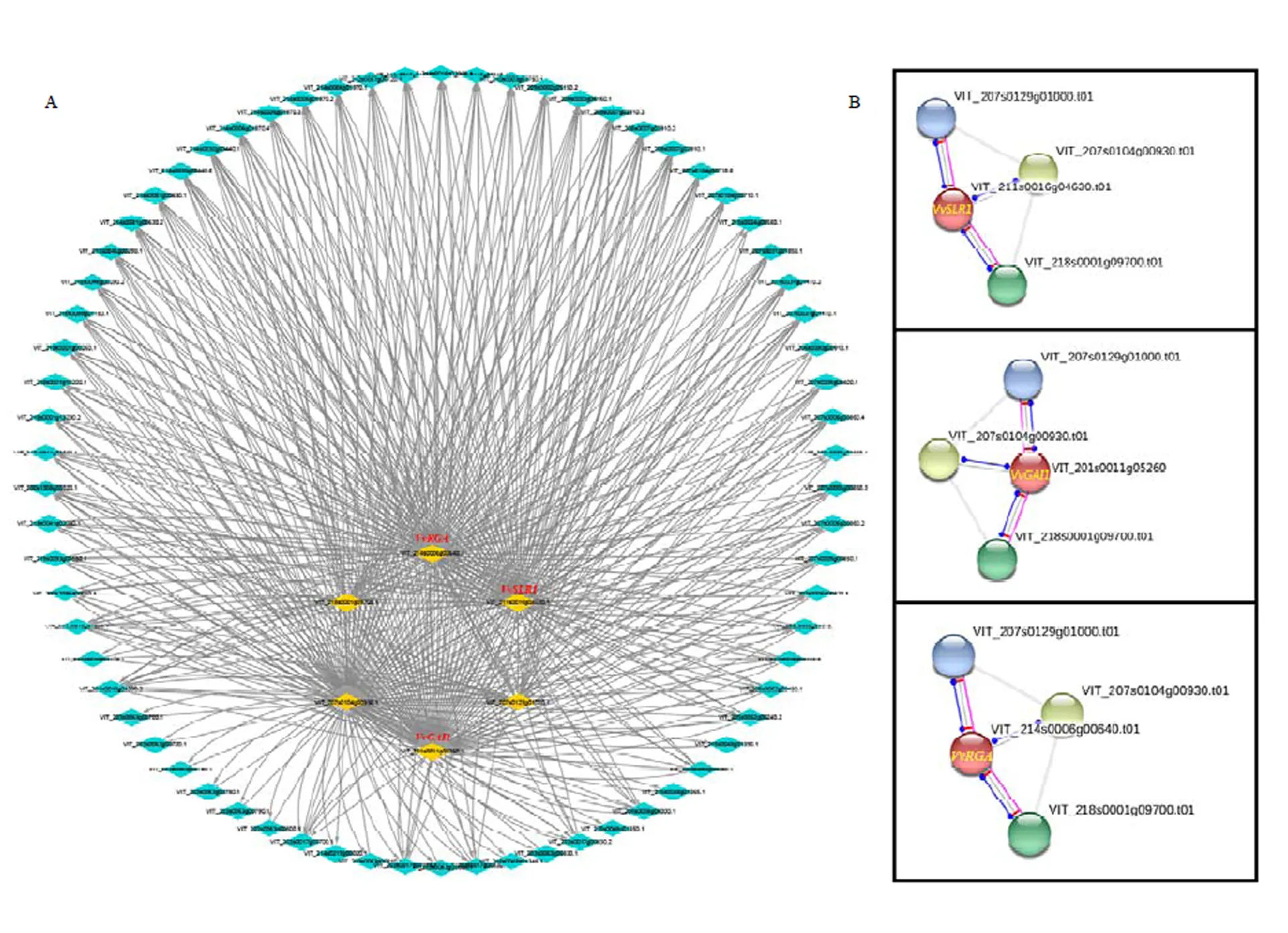
2.9 葡萄DELLA蛋白的互作
为探究葡萄中DELLA蛋白在GA信号途径中的作用情况,对DELLA蛋白的互作情况进行了预测,结果发现葡萄中3个DELLA蛋白基因均为GA信号传导的核心作用因子(图11-A)。进一步研究发现3个DELLA蛋白均可与3个蛋白有共表达(图11-B),其中2个为F-box家族蛋白SLY1,主要起抑制DELLA蛋白的作用;一个为GA受体GID1,与DELLA蛋白具体的互作情况尚未明确(表2),有待进一步试验验证。

表2 葡萄DELLA互作蛋白
A:果皮Berry pericarp;B:果肉Berry flesh;C:种子区Seed area。*代表差异显著* indicates significant difference (P<0.05)
3 讨论
无核是葡萄极其重要的经济性状,GA是诱导葡萄无核的关键激素[9-10,25]。‘白罗莎里奥’葡萄对GA高度敏感,GA可高效诱导其无核,且为当前葡萄生产中推广的一个重要品种。结合品种特性与生产经验,笔者前期开展了GA3诱导该品种无核的预备试验。于花前10 d,分别以25、50、75、100 mg·L-14个GA3浓度浸蘸葡萄花序,其中以50 mg·L-1的GA3处理诱导其无核的效果最佳,其无核率达到92%。本试验通过GA3处理,同样高效诱导了‘白罗莎里奥’葡萄果实无核化,显著拉长了葡萄果穗,加粗了葡萄穗轴。
A:葡萄赤霉素信号传导途径,中间的6个基因为途径中的核心作用元件Gibberellin signaling pathway in grape, the 6 genes in the middle are the core components of the pathway;B:每个DELLA蛋白的互作情况The interaction of each DELLA protein
作为GA信号传导途径中关键的核内负调控因子,DELLA蛋白基因家族成员的鉴定分析在拟南芥、水稻等模式植物中已有较多研究[26],但研究表明不同物种中DELLA蛋白基因成员数量及作用方式不同。而葡萄作为GA高度敏感的树种,只有杨光等[18]在‘藤稔’葡萄中初步克隆了DELLA蛋白基因家族的一个成员并将其命名为,而本研究从‘白罗莎里奥’中克隆得到葡萄DELLA蛋白基因家族的全部成员(3个),经比对发现本研究在‘白罗莎里奥’中的鉴定的序列与杨光等[18]报道的属于不同葡萄品种中的同源序列,其序列一致,说明该基因在不同品种中具有高度的序列保守性。葡萄DELLA蛋白基因家族成员的数量少于拟南芥中的成员数量(5个)[6],多于水稻和大麦(1个)[11,16],这可能是由于不同物种中经历的基因复制事件次数不同[27],从而导致不同物种中出现不同数量的DELLA蛋白基因。
生物信息学分析发现,葡萄DELLA蛋白及其同源物种的进化分析与基因结构分析、蛋白保守基序分析结果较一致。蛋白保守结构域分析表明DELLA蛋白在不同物种间高度保守,N端都具有保守的DELLA结构域来响应GA信号,C端具有GRAS结构域参与转录调节[13],但部分结构域在一些物种的不同成员中有所变化,其中以DELLA结构域的变化最大,在葡萄、莲、核桃、棉花等物种中为DGLLA,而在谷类作物中DELLA结构域也为DGLLA[12],表明DELLA蛋白家族在不同物种中功能可能具有一定的多样性。启动子作用元件分析表明,3个葡萄DELLA蛋白基因均含有GA和胚乳发育相关的调控元件,表明DELLA蛋白可能参与GA信号传导调控葡萄无核果实的发育。
荧光定量PCR表达分析结果表明,除种子区中特异表达外,3个DELLA蛋白基因在葡萄不同发育时期的果皮、果肉及种子区中均有表达。且3个基因相比,所有检测组织中的表达量明显较高。类似的,在苹果、甜樱桃、黄瓜、大豆、花生、棉花等植物中的研究发现,DELLA蛋白基因在所有组织中也均有表达,且在花或果实中的表达丰度较高[17,28],但并不是DELLA蛋白基因在各组织中均有表达,和在拟南芥所有组织中均表达,但的表达却具有组织特异性,仅在种子萌芽、幼苗期、花及长角果中高表达,但在茎、叶等组织中几乎不表达[6]。Hu等[29]对棉花的4个研究发现,所有检测组织中的表达水平显著高于其他,与本研究结果相一致。进一步比较赤霉素处理与对照样品的表达水平,发现赤霉素处理均降低了3个DELLA蛋白基因的表达量,与杨光等[18]的研究相一致,表明葡萄DELLA蛋白基因被外源GA反馈抑制调节,且DELLA蛋白基因可能响应GA信号在调控葡萄无核果实发育的过程中起着重要作用。
由于缺乏典型的DNA结合结构域,DELLA蛋白常与其他调控蛋白结合互作,通过影响互作蛋白的功能而起作用。研究表明,DELLA蛋白可与GA受体GID1结合形成GID1-GA-DELLA复合三聚体,再通过SCF(SKP1-CUL1-F-box)标记该三聚体,然后通过诱导泛素26S蛋白酶体降解DELLA蛋白对植物生长的抑制作用[30]。本研究通过预测发现葡萄3个DELLA蛋白均可能与GID1和SLY1互作,在拟南芥、甘蓝、水稻中,DELLA蛋白也可与GID1和SLY1互作,从而负向调节GA信号途径[13-14,31-32]。此外,研究发现,除GIDI和SLYI外,光敏色素互作因子(phytochrome interacting factors,PIFs)蛋白、GRAS蛋白SCL3(SCARECROWLIKE3)、EL1编码酪蛋白激酶1等还可与DELLA蛋白之间进行互作,从而抑制植物的生长[11,33-34]。但DELLA蛋白上下游基因、DELLA蛋白与其他激素间的互作机制极其复杂,具体的互作机制仍需进一步验证研究。
4 结论
葡萄基因组中含有3个DELLA蛋白基因家族成员,不同物种DELLA蛋白结构进化高度保守。在葡萄果实发育过程中,GA可能通过负调控这3个成员参与葡萄果皮、果肉和种子区的发育,且3个成员均可能通过应答GA信号调控葡萄无核果实的发育,其中在葡萄种子区中是DELLA蛋白基因家族中应答GA信号的重要因子。
[1] LIU B, De STORME N, GEELEN D. Gibberellin induces diploid pollen formation by interfering with meiotic cytokinesis., 2017, 173(1): 338-353.
[2] LINN T Z, BACHIR D G, CHEN L, HU Y G. Effects of gibberellic acid responsive dwarfing geneon plant height and agronomic traits in common wheat., 2017, 5(4): 102-111.
[3] KANNO Y, OIKAWA T, CHIBA Y, ISHIMARU Y, SHIMIZU T, SANO N, KOSHIBA T, KAMIYA Y, UEDA M, SEO M. AtSWEET13 and AtSWEET14 regulate gibberellin-mediated physiological processes., 2016, 7: 13245.
[4] ZHAO B, LI H T, LI J J, WANG B, DAI C, WANG J, LIU K D., encoding a DELLA protein, negatively regulates stem elongation through gibberellin signaling pathway., 2017, 130(4): 727-741.
[5] LI W J, Zhang J X, Sun H Y, WANG S M, CHEN K Q, LIU Y X, LI H, MA Y, ZHANG Z H., encoding a DELLA protein, negatively regulates runner production in., 2018, 247(4): 941-951.
[6] TYLER L, THOMAS S G, HU J H, DILL A, ALONSI JM, ECKER J R, SUN T P. DELLA proteins and gibberellin-regulated seed germination and floral development in., 2004, 135(2): 1008-1019.
[7] SATO T, MIYANOIRI Y, TAKEDA M, NAOE Y, MITANI R, HIRANO K, TAKEHARA S, KAINOSHO M, MATSUOKA M, TANAKA M U, KATO H. Expression and purification of a GRAS domain of SLR1, the rice DELLA protein., 2014, 95(3): 248-258.
[8] VAN DE VELDE K, CHANDLER P M, VAN DER S D, ROHDE A. Differential coupling of gibberellin responses bysuppressor alleles andin wheat highlights a unique role for the DELLA N-terminus in dormancy., 2017, 68(3): 443-455.
[9] WANG X C, ZHAO M Z, WU W M, KORIR N K, QIAN Y M, WANG Z W. Comparative transcriptome analysis of berry-sizing effects of gibberellin (GA3) on seedlessL., 2017, 39(5): 493-507.
[10] ACHEAMPONG A K, ZHENG C L, HALALY T, GIACOMELLI L, TAKEBAYASHI Y, JIKUMARU Y, KAMIYA Y, LICHTER A, OR E. Abnormal endogenous repression of GA signaling in a seedless table grape cultivar with high berry growth response to GA application., 2017, 8: 850.
[11] DAI C, XUE H W. Rice, a CKI, phosphorylates DELLA protein SLR1 to negatively regulate gibberellin signalling., 2010, 29(11): 1916-1927.
[12] VAN DE V K, RUELENS P, GEUTEN K, ROHDE A, VAN DER S D. Exploiting DELLA signaling in cereals., 2017, 22(10): 880-893.
[13] ITOH H, Ueguchi-TANAKA M, SATO Y, ASHIKARI M, MATSUOKA M. The gibberellin signaling pathway is regulated by the appearance and disappearance of SLENDER RICE1 in nuclei., 2002, 14(1): 57-70.
[14] GAO Y, CHEN J M, ZHAO Y, LI T T, WANG M L. Molecular cloning and expression analysis of a RGA-like gene responsive to plant hormones in., 2012, 39(2): 1957-1962.
[15] DE LUCAS M, DAVIERE J M, RODRIGUEZ-FALCON M, PONTIN M, IGLESIAS-PEDRAZ J M, LORRAIN S, FANKHAUSER C, BLAZQUEZ M A, TIARENKO E, PRAT S. A molecular framework for light and gibberellin control of cell elongation., 2008, 451: 480-484.
[16] FU X D, RICHARDS D E, AIT-ALI T, Hynes L W,Ougham H, Peng J, Harberd N P. Gibberellin-mediated proteasome- dependent degradation of the barley DELLA protein SLN1 repressor., 2002, 14(12): 3191-3200.
[17] 吴建明, 黄杏, 丘立杭, 陈荣发, 李杨瑞, 杨柳, 苏天明. DELLA蛋白在植物中的研究进展. 农业生物技术学报, 2016, 24(8): 1207-1215.
WU J M, HUANG X, QIU L H, CHEN R F, LI Y R, YANG L, SU T M. Progress on DELLA protein in plant., 2016, 24(8): 1207-1215. (in Chinese)
[18] 杨光, 曹雪, 房经贵, 宋长年, 王晨, 王西成. ‘藤稔’葡萄基因的克隆、亚细胞定位及时空表达分析. 园艺学报, 2011, 38(10): 1883-1892.
YANG G, CAO X, FANG J G, SONG C N, WANG C, WANG X C. Cloning, subcellular localization and spatiotemporal expression of agene from grapevine ‘Fujiminori’.,2011, 38(10): 1883-1892. (in Chinese)
[19] 任国慧, 上官凌飞, 房经贵, 慕茜, 冷翔鹏, 孙欣. 葡萄DELLA家族成员和的预测、验证及生物信息学分析. 南京农业大学学报, 2013, 36(3): 15-21.
REN G H, SHNAGGUAN L F, FANG J G, MU Q, LENG X P, SUN X. The prediction, validation and bioinformatics analysis of the grape DELLA family members aboutand., 2013, 36(3): 15-21. (in Chinese)
[20] 张彦苹, 王晨, 于华平, 蔡斌华, 房经贵. 适于葡萄不同组织RNA提取方法的筛选. 西北农业学报, 2010, 19(11): 135-140.
ZHNAG Y P, WANG C, YU H P, CAI B H, FANG J G. Screening of RNA extraction methods for various grapevine organsand tissues., 2010, 19(11): 135-140. (in Chinese)
[21] FAN S, ZHANG D, XING L B, QI S Y, DU L S, WU H Q, SHAO H X, LI Y M, MA J J, HAN M Y. Phylogenetic analysis ofgene family and characterization of its expression in response to flower induction in., 2017, 292(4): 755-771.
[22] 杨占武, 杨君, 张艳, 吴金华, 李志坤, 王省芬, 吴立强, 张桂寅, 马峙英. 棉花的亚细胞定位及其超表达烟草抗病性分析. 中国农业科学, 2016, 49(21): 4065-4073.
YANG Z W, YANG J, ZHANG Y, WU J H, LI Z K, WANG X F, WU L Q, ZHANG G Y, MA Z Y. Subcellular localization and verticillium wilt resistance analysis of cottonin overexpressed tobacco., 2016, 49(21): 4065-4073. (in Chinese)
[23] CHENG C X, JIAO C, SINGER S D, GAO M, XU X Z, ZHOU Y M, LI Z, FEI Z J, WANG Y J, WANG X P. Gibberellin-induced changes in the transcriptome of grapevine () cv. Kyoho flowers., 2015, 16: 128.
[24] CHENG C X, XU X Z, SINGER S D, LI J, ZHANG H J, GAO M, WANG L, SONG J Y, WANG X P. Effect of GA3treatment on seed development and seed-related gene expression in grape., 2013, 8(11): e80044.
[25] WANG M Q, SUN X, WANG C, CUI L W, CHEN L D, ZHNAG C B, SHANGGUAN L F, FANG J G. Characterization of miR061 and its target genes in grapevine responding to exogenous gibberellic acid., 2017, 17(5): 537-549.
[26] CAMUT L, DAVIERE J M, ACHARD P. Dynamic regulation of DELLA protein activity: SPINDLY and SECRET AGENT unmasked!., 2017, 10(6): 785-787.
[27] GALLEGO-BARTOLOME J, MINGUET E G, MARIN J A, PRAT S, BIAZQUEZ M A, ALABADI D. Transcriptional diversification and functional conservation between DELLA proteins in., 2010, 27(6): 1247-1256.
[28] AN J, HOU L, LI C, WANG C X, XIA H, ZHAO C Z, LI C S, ZHENG Y X, ZHAO Y X, WANG X J. Cloning and expression analysis of fourgenes in peanut., 2015, 62(1): 116-126.
[29] Hu M Y, LUO M, XIAO Y H, LI X B, TAN K L, HOU L, DONG J, LI D M, SONG S Q, ZHAO J, ZANG Z L, LI B L, PEI Y. Brassinosteroids and auxin down-regulate DELLA genes in fiber initiation and elongation of cotton., 2011, 10(8): 1168-1176.
[30] SUN T P. Gibberellin-GID1-DELLA: a pivotal regulatory module for plant growth and development., 2010, 154(2): 567-570.
[31] SUZUKI H, PARK S H, OKUBO K, KITAMURA J, UEGUCHI- TANKA M, LUCHI S, KATOH E, KOBAYASHI M, YAMAGUCHI L, MATSUOKA M, ASAMI T, NAKAJIMA M. Differential expression and affinities ofgibberellin receptors can explain variation in phenotypes of multiple knock-out mutants., 2009, 60(1): 48-55.
[32] NELSON S K, STEBER C M. Transcriptional mechanisms associated with seed dormancy and dormancy loss in the gibberellin-insensitivemutant of., 2017, 12(6): e0179143.
[33] FENG S H, MARTINEZ C, GUSMAROLI G, WANG Y, ZHOU J L, WANG F, CHEN L Y, YU L, IGLESIAS-PEDRAZ J M, KIRCHER S, SCHAFER E, FU X D, FAN L M, DENG X W. Coordinated regulation ofdevelopment by light and gibberellins., 2008, 451 (7177): 475-479.
[34] ZHANG Z L, OGAWA M, FLEET C M, ZENTELLA R, HU J H, HEO J O, LIM J, KAMIYA Y, YAMAGUCHI S, SUN T P.Scarecrow-like 3 promotes gibberellin signaling by antagonizing master growth repressor DELLA in., 2011, 108(5): 2160-2165.
(责任编辑 岳梅)
Genome-Wide Identification and Expression of DELLA Protein Gene Family during the Development of Grape Berry Induced by Exogenous GA
ZHANG WenYing1, WANG Chen1, ZHU XuDong1, MA Chao2, WANG WenRan1, Leng XiangPeng3, ZHENG Ting1, FANG JingGui1
(1College of Horticulture, Nanjing Agricultural University, Nanjing 210095;2Institute of Agriculture and Biology, Shanghai Jiao Tong University, Shanghai 200240;3College of Horticulture, Qingdao Agricultural University, Qingdao 266109, Shandong)
【Objective】The objectives of this study are to identify the DELLA protein family genes from grapevine () genome, to know the profile of DELLA protein family such as gene number, gene structure and tissue expression in grape, and to explore the mechanism of DELLA protein in gibberellic acid (GA) signaling pathway and in seedless fruit development of grapevine.【Method】DELLA protein genes in grape genome were identified by HMMER and NCBI CDD software based on DELLAgenes fromand rice. The full-length cDNAs were obtained by clone techniques fromgrapevine cv. ‘Rosario Bianco’. Cis-elements of their promoters were identified to predict their potential functions. Their chromosomal localization, gene structures, phylogenetic analysis, physicochemical properties, subcellular localizations and protein interactions were analyzed by bioinformatics analysis softwares. Subcellular localization of DELLA proteins were observed by-mediated transient expression in tobacco leaf.The qRT-PCR method was used to detect the temporal and spatial expression of DELLA protein genes in the grape berry pericarp, berry flesh and seed (or seed area) induced by exogenous GA.【Result】A total of 3 DELLA proteingenes were identified from grape genome, their precise sequences were cloned and verified, named(VIT_201s0011g05260),(VIT_214s0006g00640) and(VIT_211s0016g04630), respectively. Their chromosomal localization, open reading frame (ORF), number of amino acid of DELLA genes were Chr1, 1 773 bp, 590; Chr14, 1 710 bp, 569; Chr11, 1 599 bp, 532, respectively. Gene structure analysis result showed that there no intron and only one exon, and gene structures were highly conserved. Phylogenetic analysis showed that VvGAI1 was closely related to VvRGA, and were clustered into one group, with VvSLR1 was another group. The promoters of the 3 genes all contained elements that were responsible for GA and endosperm development, suggesting that they might be involved in response to GA signaling and endosperm development. Subcellular localization result showed that all 3 grape DELLA proteins were located in the nucleus. The results of qRT-PCR showed that the expression of 3 DELLA genes, except forn the grape berry pericarp, berry flesh and seed area, especially in the seed area. Protein interaction analysis showed that all 3 DELLA proteins were the core components of GA signal transduction in grape, which may interact with GIDI1 and SLY1 in GA signal transduction.【Conclusion】DELLA protein gene family in grapevine contains 3 genes. their structures among different species are highly conserved. GA may participate in the development of berry pericarp, berry flesh and seed area through negative regulation of these three members, and all 3 members may regulate the development of grapes seedless fruit by responding to GA.
grape; DELLA; subcellular location; expression; interaction; gibberellic acid (GA)
2018-02-06;
2018-04-11
国家自然科学基金青年基金(31301759)、江苏省自然科学基金(BK20180113)、上海市浦江人才计划(16PJ1404900)、中央高校基本科研业务费自主创新重大专项(自然科学)(KYTZ201602)
张文颖,E-mail:2016104035@njau.edu.cn。
王晨,E-mail:wangchen@njau.edu.cn
10.3864/j.issn.0578-1752.2018.16.009
