磷酸泛酰巯基乙胺基转移酶在真菌和细菌的研究进展
孟玲宁 刘锦燕 赵悦 吕婕 林伊静 项明洁
(1.上海交通大学医学院附属瑞金医院检验科,上海 200025;2.上海交通大学医学院附属瑞金医院卢湾分院放免检验科,上海 200020;3.上海交通大学医学院,上海 200025)
1 PPTase概述
生物体中大量存在PPTase,且它们在蛋白结构上有所差异,其主要功能即参与启动脂肪酸、聚酮化合物及非核糖体肽的合成。在1996年,就已有5个不同实验室通过生物信息学鉴定出了许多PPTase。现PPTase被分为3类。Ⅰ型PPTase即"AcpS"型 (见图1a),该型在20世纪60年代后期对大肠杆菌进行研究时被首次发现,并随后通过对植物的研究,从真核生物中得以分离,为PPTase中最为常见的一种。其主要功能是催化FAS、PKS等初级代谢合成酶中的ACP的辅基化,且在三聚体形态时发挥作用 (见图1a)。Ⅱ型PPTase即"Sfp"型 (见图1b),其代表Sfp在20世纪90年代初期被Grossman等发现,他们研究鉴定出了大肠杆菌与枯草芽孢杆菌的铁载体肠细菌素和枯草菌脂蛋白生物合成的基因,并把它们分别命名为entD和Sfp,它在菌体内参与赖氨酸的合成,活化α-氨基己二酸还原酶 (α-Aminoadipate reductase, α-AAR),并具有激活PKS和NRPS的功能 (见图1)。Ⅲ型PPTase则是融合在PKS或FAS上的一个结构域,也被称为结构域型,其发现相对较少,它能特异性催化同一个多肽链中的ACP的辅基化,且功能通常不能被其他PPTase替代[1]。
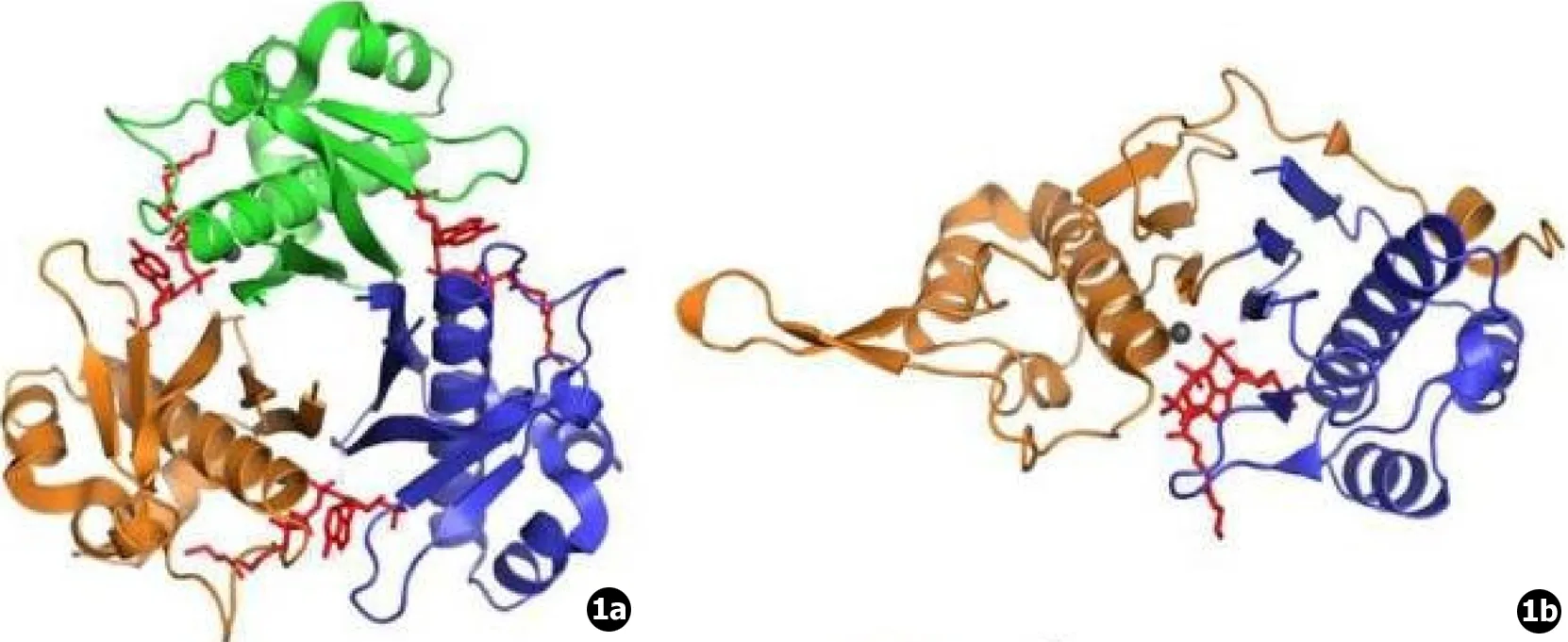
图1枯草芽孢杆菌的两种酶——AcpS (a)和Sfp (b)的顶视结构图[2]
Fig.1Fungal hyphae under microscopy
由此可见,PPTase的主要功能即催化FAS、PKS和NRPS中ACP和PCP的翻译后修饰反应,修饰包括将CoA的4-磷酸泛酸巯基乙胺部分共价连接到存在于PKS和NPRS中的所有酰基载体和肽基载体结构域中保守的丝氨酸上,从而使ACP和PCP从无活性变为有活性,启动脂肪酸、聚酮化合物和非核糖体肽的合成[3-4]。
PKs及NRPs能够影响生物的生长和繁殖,激活其合成的PPTase在不同物种中拥有不同的结构,类型也不尽相同。因此,PPTase可能成为一种新的药物研发靶点。
2 PPTase在真菌中的研究进展
在真菌中,PPTase作用于PKS与NRPS途径产生生物活性化合物,如参与赖氨酸的生物合成、聚酮化合物的合成、对铁离子的吸收等等过程,可能参与致病[5]。真菌的次级代谢产物PKs以及NRPs现被发现往往与其对人或对植物的致病有关,现已发现大量不同PKSs及NRPSs的存在,它们的结构与功能都十分多样。例如,在对人体致病的真菌 (如烟曲霉)中,PK派生的黑色素能增加其毒力,而在对植物致病的真菌中,PKSs所合成的毒素也能加强其毒性。一部分菌中的NRPSs也参与毒素合成、铁载体合成等,同样与真菌的致病有关[6-8]。尽管PKSs与NRPSs十分多样且与致病一定程度上相关,但它们中的大部分都需要PPTase所控制的翻译后修饰反应来活化,若把部分真菌中的PPTase敲除,该菌也可能会因为无法合成赖氨酸而无法生长。由此可见,PPTase可以被认为是一种真菌致病因子,并与真菌生长密切相关,且因为目前相关研究较少,从而开拓了一种制备抗真菌药的新思路。
2.1 PPTase在真菌中的分型
现在已经发现的真菌基因组中的PPTase分为3型:①Ⅰ型PPTase:此酶在反应过程中是三聚体形态而非单体形态,最早在枯草芽孢杆菌中被发现,为"AcpS"型,在天蓝链霉菌也发现有该酶。该酶具有三聚体四级结构,每种单体约15 kDa,三聚体蛋白中的每一个单体都有一个活性中心,在活性中心含有Mg2+和焦磷酸盐结合的位点。②Ⅱ型PPTase:仅有两种Ⅱ型PPTase已被解析,分别是来自枯草芽孢杆菌的Sfp15与来自人类的α-氨基己二酸半醛脱氢酶 (α-aminoadipate semialdehyde dehydrogenase,AASDHPPT)。与AcpS型不同的是,Sfp型PPTase表现出假二聚体折叠,由两个结构相似的以短多肽环连接的亚结构域组成,AASDHPPT与Sfp15的Mg2+残基数不相同,前者有2个而后者有3个。③Ⅲ型PPTase:Ⅲ型PPTase融合在PKS或FAS上,在发挥作用时,与Ⅰ型PPTase相似,也是形成三聚体形态,同时它也与Ⅱ型PPTase一样有3个Mg2+结合残基。值得一提的是,在真菌中不同类型PPTase各司其职,有其不同功能,而在细菌中可能只拥有一种PPTase,并同时兼顾各种功能。现今在人类基因组中只鉴定出一种广谱的PPTase,其功能为翻译后修饰胞浆中及线粒体中的FAS系统中的ACP组件与氨基己二酸半醛脱氢酶,后者与赖氨酸降解有关。这种在人体内鉴定出的PPTase最接近Sfp型即Ⅱ型PPTase,而真菌线粒体PPTase,例如烟曲霉中的PPTB,则更类似于结构截然不同的AcpS型即Ⅰ型PPTase[9]。这就提示我们可以寻找针对真菌线粒体PPTase的特异性的靶点,从而能够做到杀灭真菌且不对人体造成伤害。并且,PPTase有合成大量PKSs和NRPSs的“开关”作用,因此以PPTase为靶点来制造抗真菌药物可能可以有效阻断其大部分次级代谢产物的合成,从而高效地降低致病真菌的毒力,起到治疗的作用。
2.2 PPTase在真菌中的功能作用
PPTase在真菌中对于脂肪酸和赖氨酸的生物合成以及催化许多具有生物活性的次级代谢产物的生成是必不可少的,它也是真菌初级代谢和特化代谢中的各种其他中央生物合成途径的必需物质[5]。目前,对于真菌中各型PPTase的功能作用的研究较少,部分机制尚且不明。已知Ⅰ型PPTase能够对CoA和apo-ACP反应进行催化,生成holo-ACP和3',5'-二磷酸核苷酸,同时该反应也需要Mg2+或Mn2+等金属离子[10]。
现今已发现在酿酒酵母中,胞质脂肪酸、线粒体FAS和α-氨基乙二酸-半醛脱氢酶这3种物质分别需要3种特定PPTase的激活,这3种PPTase分别为:Ⅰ型PPT酶FAS2,Ⅲ型PPT酶PPT2以及Ⅱ型PPT酶Lys5。其中,FAS2主要起到胞质脂肪酸合成酶的修饰作用;PPT2主要与硫辛酸的合成有关,而硫辛酸是一种线粒体辅助因子,是线粒体呼吸的必需物质;Lys5则参与赖氨酸的生物合成,赖氨酸是真菌生长所必须的物质[11]。
2.3 PPTase对真菌生长的影响
PPTase的存在对于真菌来说可能是一种重要影响条件。研究发现若将白念珠菌的一个PPT2等位基因C1_09480W敲除,并将另一个PPT2等位基因置于可调节启动子MET3下,就可以发现在同等条件下被敲除株无法生长,即表明PPT2在白念珠菌的生长中必不可少[12]。有学者发现,在构巢曲霉中,存在单一Sfp型PPTase,即NpgA。该酶被认为负责激活构巢曲霉中所有PKSs以及NRPSs (除α-AAR)[13-14]。若将构巢曲霉的NpgA基因敲除,则其突变体在缺乏赖氨酸及部分NRPS产物的情况下无法生长[15]。另有学者YUEQIANG LENG与SHAOBIN ZHONG构建了育旋孢腔菌 (Cochliobolussativus)的ΔPPT1敲除株,即将菌中的PPT1基因敲除,通过给予不同的环境并在不同营养程度的培养基上培养,他们发现敲除这段基因会导致育旋孢腔菌对赖氨酸营养缺陷,并无法产生黑色素,且对铁的消耗以及过氧化氢的敏感度升高,也对菌株的毒力造成了损失[16]。其中,赖氨酸的合成对于育旋孢腔菌以及一部分真菌的生长都是必须的,在敲除株无法由AAR途径合成赖氨酸且外界也不提供赖氨酸的情况下,该菌株几乎无法生长。综上,PPTase在真菌合成代谢中起着至关重要的作用,若将其敲除,则会对阻断其次级代谢,对其生长及致病产生影响。
3 PPTase在细菌中的研究进展
PPTase在细菌中的功能与其在真菌中的功能较为相似,主要为调控翻译后修饰反应,把控PKSs和NRPSs的激活。现已知的许多次级代谢产物均来自于细菌,包括色素、铁载体和抗生素等。这些物质会在环境相对苛刻的情况下为细菌增强适应性,而催化产生这些具有部分保护作用次级代谢产物的源头酶便是PPTase[2]。Ⅰ型PPTase首次在大肠埃希菌中被发现,之后Grossman等在大肠埃希菌中发现了与Ⅰ型PPTase结构有很大差别的另一种PPTase,该酶与合成肠杆菌素转体载体有关,并被命名为EntD[17-18]。同时,他们也发现了芽孢杆菌中的同类型PPTase,并把这类PPTase都归为Ⅱ型PPTase。现今的研究表明,正常情况下细菌中会有至少一个I型PPTase与Ⅱ型的PPTase (独有一种PPTase的情况下以Ⅰ型PPTase居多,也存在少数细菌体内仅有一个Ⅱ型PPTase)。在PseudomonasaeruginosaPAO1 (PcpS)与Synechocystissp.Strain PCC6803 (Sppt)等菌中就只有一个PPTase[10,19]。这可能表明在细菌中,仅有的这一种PPTase既需要催化次级代谢,也需要催化初级代谢中ACP的辅基化,这与真菌中的情况不同。一部分细菌的Sfp型PPTase被证实可以弥补其他菌种的赖氨酸合成缺陷,且这类Sfp型PPTase因为能修饰初级与次级代谢中绝大部分Acps而被受到关注,大肠埃希菌的EntD PPTase便是其中的一个。目前,在细菌中进行的关于PPTase基因敲除以及其特殊作用的研究尚不充分,可能是一个较新颖的研究方向。
4 总 结
PPTase在大量不同生物体中存在,且主要起到合成FAS、PKS、NRPS等次级代谢产物的作用。近几年来,对于PPTase各方面的研究逐渐增多。Wiemann、Albermann等[20]发现异源性子囊菌 (Fusariumfujikuroi)造成水稻病的罪魁祸首是其PKS与NRPS产生的部分次级代谢产物,PKS与NRPS又被该菌内一种Sfp型的PPTase所翻译后修饰,同时该酶也与赖氨酸合成有关。他们制作了突变株后发现若该酶的基因缺失,则异源性子囊菌无法致病。Gerc与Stanley-Wall[21]也证实了粘质沙雷菌重要代谢物的产生与其PPTase即PswP有关。除了关于具体菌株内PPTase的研究, Kosa、Foley等[22]学者也尝试在各种细菌内寻找PPTase抑制剂,并利用荧光技术来监测抑制剂在人体内的作用。若抑制剂能够投入使用,则可以一定程度上避免使用抗生素时会产生耐药性的副作用。另有Bunet、Riclea等[23]对特定细菌的基因组进行分析,对PPTase的不同编码基因及其功能进行研究。在真菌中,PPTase可能参与致病,辅助合成对人或对植物致病的物质。且将真菌中的PPTase敲除可能会抑制赖氨酸合成,从而阻止真菌生长。因此可考虑发展该酶为一种新的抗真菌药靶点。在细菌中,PPTase功能与在真菌中相似,并可一种酶“身兼多职”,同时拥有真菌中几种PPTase的能力。对PPTase的研究应更深入更广泛地进行,来达到用创新思路制作药物,而更有效地抑制疾病的目的。

