胶原诱导关节炎模型中髓系来源抑制细胞通过白细胞介素-1β促进Th17细胞分化的作用
程苏云,陈香元,李洪伟,谢 颖,李 丰,曾华松
CD4+IL-17A+Th细胞是一种炎症性CD4+T辅助细胞亚群,参与自身免疫反应和炎症性疾病的发病。在白细胞介素(interleukin,IL)-17的作用下滑膜成纤维样细胞可分泌IL-6、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、基质金属蛋白酶-3(matrix metalloproteinases3,MMP-3)[1],且IL-17可与IL-1协同作用诱导核因子-κB(nuclear factor-κB,NF-κB)受体活化因子配体(receptor activator for nuclear factor-κB ligand,RANKL)与受体促进破骨细胞分化,最终导致骨侵蚀[2]。髓系来源抑制细胞(myeloid-derived suppressor cells,MDSCs)是一组异质性细胞,其主要特点是髓系来源、未成熟状态及对T细胞具有显著的免疫抑制作用,从而成为近年来免疫学研究的热点之一。在小鼠中,MDSCs具有特异性的表面标志物,通常表达CD11b和Gr1。然而,在人体中MDSCs则是一群CD11b+CD33+CD14-HLA-DR-或者Lin-CD11b+CD33+HLA-DR-细胞[3-4],或更狭义地定义为CD33+HLA-DR-细胞[5]。最初MDSCs受到广泛关注主要是由于其在肿瘤微环境中的免疫调节作用[6-7],近年来越来越多的研究表明MDSCs在多种自身免疫性疾病中发挥重要作用,如多发性硬化[8-9]、炎症性肠病[10]、Ⅰ型糖尿病[11]、类风湿关节炎[12]。小鼠(experimental encephalomyelitis,EAE)模型研究发现MDSCs具有促进炎症发生和抑制炎症反应的作用[8-9]。小鼠风湿性关节炎模型的研究表明MDSCs具有抑制关节炎病情进展、减轻炎症反应、缓解关节症状的作用[12]。目前关于MDSCs对Th17细胞的影响及作用机制尚未得出确切的结论。本研究通过胶原诱导关节炎小鼠模型(collagen induced arthritis,CIA),探讨MDSCs对Th17细胞分化的影响及其可能的机制,为进一步阐明自身免疫性关节炎的发病机制及进一步寻找新的治疗靶点提供理论依据。
1 材料与方法
1.1 实验动物
SPF级雄性DBA1/J小鼠20只,鼠龄4~6周,购于北京华阜康生物科技股份有限公司[SCXK-(京)2014-0004],饲养于中山大学动物实验中心[SYXK(粤)2012-0081]。动物实验方案通过中山大学伦理委员会审核(BD-16-0410)。
1.2 方法
1.2.1 DBA1/J小鼠CIA模型的建立:将小鼠随机分成CIA组和正常对照组组,每组各10只。将2 mg/ml的牛Ⅱ型胶原与等量含卡介苗4 mg/ml的完全弗氏佐剂完全乳化,CIA组小鼠参照文献[13]的方法进行造模,正常对照组小鼠不予任何干预。按照下述标准对小鼠关节炎模型进行评估:0 分者无红肿;1 分者小趾关节轻度红肿;2 分者小趾及足跖肿胀;3分者踝关节以下肿胀;4 分者包括踝关节在内的全部足爪和关节肿胀,或不能爬行。每只动物的每只爪评分共4 分,4爪均列入观察,共计16 分,评分6~8 分者为严重关节炎,≥6分者视为造模成功。总评分=四肢关节评分之和[14]。
1.2.2 流式细胞法分析小鼠MDSCs比例:处死CIA和正常对照组小鼠,用流式细胞仪(Ficoll-Paque PLUS,Sigma公司,USA)按照密度梯度离心法获得脾脏单个核细胞,制备单个核细胞悬液,用FITC标记的抗Gr-1抗体、PE标记的CD11b抗体(Biolegend公司,USA)4 ℃条件下孵育30 min,采用流式细胞术分析各组小鼠MDSCs比例。
1.2.3 CIA小鼠MDSCs和CD4+T细胞的分离:采用FITC-抗Gr-1抗体、PE-抗CD11b抗体标记细胞,用流式细胞仪分选CIA小鼠MDSCs,所分选的细胞纯度为(93.3±3.1)%,按照CD4+T细胞磁珠分离试剂盒(eBioscience公司,的USA)操作说明分离CD4+T细胞,细胞纯度为(93.4±2.1)%。
1.2.4 MDSCs与CD4+T细胞共培养测定MDSCs对T细胞增生的抑制作用:上述分离的CD4+T细胞(1×105cells/ml)培养前用CFSE(eBioscience公司,USA) 进行标记,重悬在100 μl含体积分数10%胎牛血清(fetal bovineserum,FBS)的RPMI-1640培养基中与MDSCs按1∶1共培养在96孔板中,并在培养基内添加抗CD3/CD28 mAbs(Biolegend,USA)作为非特异性刺激,在37 ℃、体积分数5% CO2条件下培养3 d,分别用流式细胞术和ELISA法测定CD4+T细胞的增生能力和细胞上清液中γ干扰素(interferon γ,IFN-γ)质量浓度。
1.2.5 MDSCs与CD4+T细胞共培养及分化培养条件下Th17A含量变化:参照文献[9]的方法将CD4+T细胞(4×105cells/ml)与MDSCs以1∶1体积比在Th17细胞分化条件下共培养,培养时于培养基中加20 ng/ml IL-6和5 ng/ml转化生长因子-β(transforming growth factor-β,TGF-β)(eBioscience公司,USA)和抗CD3/CD28 mAbs作为非特异性刺激(Th17细胞分化条件);另采用Transewell培养体系阻断MDSCs和Th17细胞之间的接触,明确两者之间相互作用是通过分泌细胞因子方式或细胞-细胞直接接触方式;在实验培养细胞过程中加入30 μg/ml IL-1 mAbs(Biolegend公司,USA)或200 ng/ml IL-1受体拮抗剂 (interleukin receptor 1ɑ,IL-1rɑ)(Biolegend公司,USA),在37 ℃、5% CO2条件下培养3 d 以阻断IL-1β信号,收获细胞并进行Th17细胞胞内染色,即用100 ng/ml PMA、1 μmol/L离子霉素和2 μmol/L莫能菌素(Sigma公司,USA)在37 ℃、5% CO2条件下刺激5 h,然后进行固定、破膜,完成PE-标记CD4抗体和FITC-标记IL-17A抗体胞内染色,行流式细胞分析,评估MDSCs存在与否及分化培养或常规培养条件下Th17细胞分化情况。
1.2.6 实时荧光定量PCR法测定培养细胞中及Th17细胞分化相关蛋白基因的表达:用Trizol(Invitrogen公司,USA)提取脾脏细胞或培养后细胞的总RNA,用总RNA逆转录试剂盒反转录成cDNA,通过实时定量PCR反应测定细胞中STAT3、视黄酸相关孤儿受体(retinoic acidrelated orphans receptor,ROR)α、RORγt、IL-17A mRNA的相对表达量。引物序列如下:STAT3上游序列为GTCTGTAGAGCCATACACCAAG,下游序列为GGT AGAGGTAGACAAGTGGAGA;RORɑ上游序列为GGGAAGAACTCCAGCAGATAAC,下游序列为GGC AAACTCCACCACATACT;RoRγt上游序列为CCTT CCCTCCACTCTATAAGGA,下游序列为GTCAGA GGGCTGAAGGAAATAG;IL-17A上游序列为CAA ACATGAGTCCAGGGAGAG,下游序列为GCTGAGC TTTGAGGGATGAT;β-actin作为内参基因,上游序列为GAGGTATCCTGACCCTGAAGTA,下游序列为CACACGCAGCTCATTGTAGA。测定培养细胞中Th17细胞分化相关蛋白STAT3 mRNA、RORɑ mRNA、RORγt mRNA和IL-17A mRNA相对表达量。
1.2.7 ELISA法测定小鼠血浆和培养上清液中炎性因子和抑炎因子变化:采用ELISA试剂盒(eBioscience公司,USA)测定各组炎性小鼠培养细胞上清液中炎性细胞因子IL-1β、IL-17和抑炎因子IL-10质量浓度。
1.3 统计学方法
2 结果
2.1 两组小鼠MDSCs和Th17细胞比例的比较
初次免疫后第35天CIA模型诱导成功,显示小鼠肢体和足趾充血水肿,活动能力下降;正常对照组小鼠肢体和足趾正常,活动自如(图1)。CIA组小鼠脾脏中CD11b+Gr1+MDSCs比例为(20.1±2.6)%,明显高于正常对照组的(2.6±1.1)%,差异有统计学意义(P=0.000);CIA组小鼠脾脏中CD4+IL-17A+Th17细胞比例为(1.3±0.2)%,明显高于正常对照组的 (0.3±0.1)%,差异有统计学意义(P=0.000)(图2A~C);CIA组小鼠中CD11b+Gr1+MDSCs的表达比例与Th17细胞比例呈正相关(R2=0.921,P=0.002),正常对照组小鼠CD11b+Gr1+MDSCs的表达比例与Th17细胞比例间无明显线性相关(P=0.642)(图3)。

图1 CIA成模情况
Fig1 Modeling of CIA mice
A:CIA组小鼠免疫后第35天可见包括踝关节在内的全部足爪和关节肿胀; B:正常对照组小鼠肢体正常; C: CIA组小鼠免疫肢体病理学变化; D:正常对照组小鼠肢体组织学检查正常
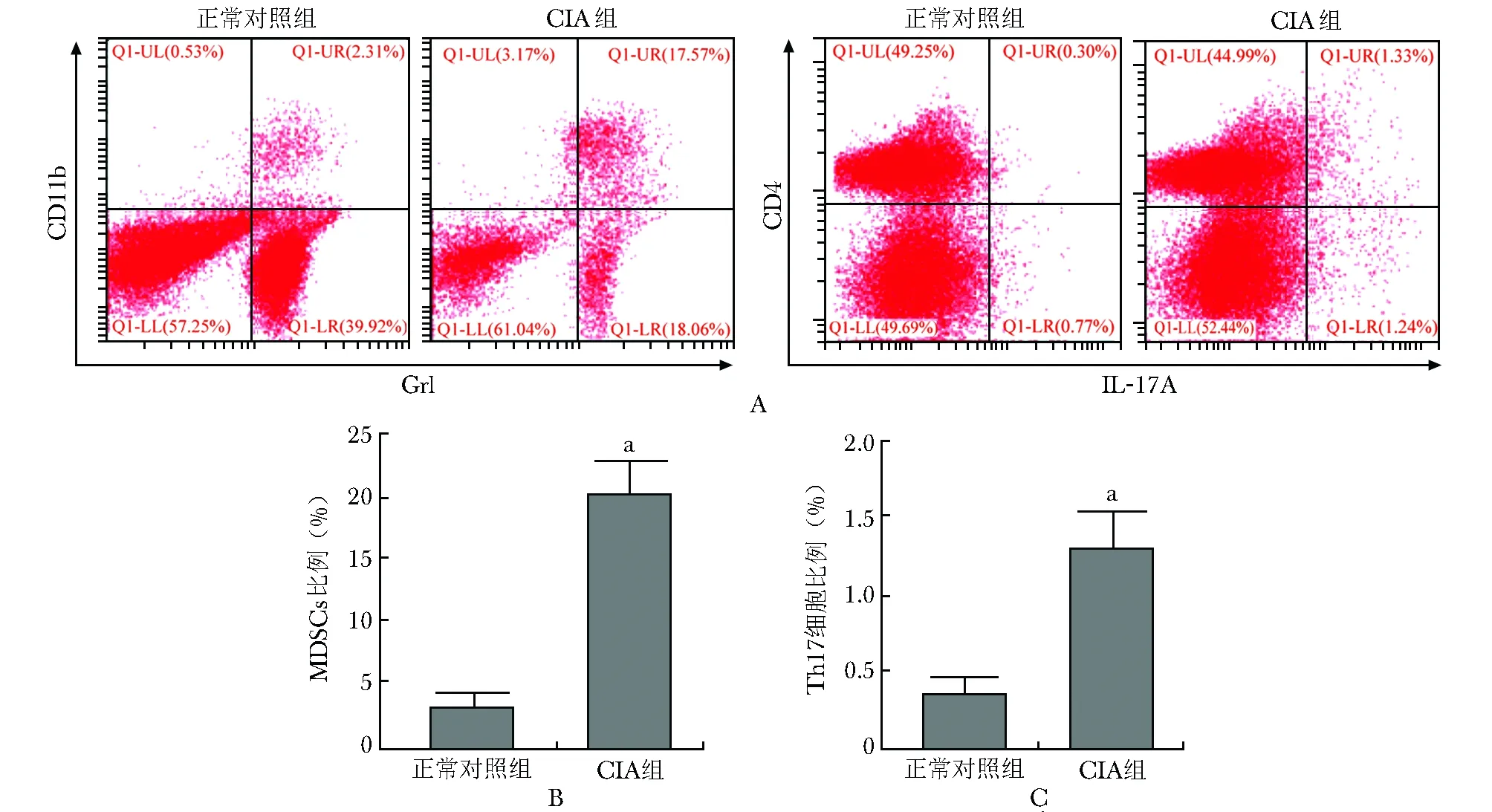
图2 流式细胞计数检测两组小鼠脾脏单个核细胞中CD11b+Gr1+MDSCs和CD4+IL-17A+ Th17细胞的变化
Fig2 Changes of CD11b+Grl+MDSCs and CD4+IL-17A+Th17 in spleen mononuclear cells of mice
A:CIA组小鼠脾脏中CD11b+Gr1+MDSCs和CD4+IL-17A+Th17细胞比例均明显高于正常对照组; B:两组小鼠脾脏单个核细胞中CD11b+Gr1+MDSCs比例的量化比较, 与正常对照组比较,aP<0.01(独立样本t检验); C:两组小鼠脾脏单个核细胞中CD4+IL-17A+Th17细胞比例的量化比较, 与正常对照组比较,aP<0.01(独立样本t检验) ;CIA:胶原诱导关节炎;MDSCs:髓系来源抑制细胞;Th17:辅助T细胞17
2.2 两组培养细胞上清液中炎症因子、抑炎因子含量及RORγt、IL-17A mRNA表达量
CIA组培养细胞上清液中炎性因子IL-1β含量为 (117.4 ±50.3) pg/ml,IL-17A质量浓度为(242.6 ±131.7) pg/ml,分别低于正常对照组的(267.9±78.8)pg/ml 和 (673.0±128.5)pg/ml,差异均有统计学意义(P=0.000、0.001)。CIA组培养细胞上清液中抑炎因子IL-10为(15.0±7.0)pg/ml,明显低于正常对照组的(31.6±8.3)pg/ml,差异有统计学意义(P=0.000)。CIA细胞上清液中L-17AmRNA 和RORγt mRNA相对表达量明显高于正常对照组,差异均有统计学意义(均P<0.01)(图4)。
2.3 CIA组CD4+T细胞与MDSCs共培养与CD4+T细胞培养后CD4+ T细胞增生率及IFN-γ含量比较
CD4+T细胞单独培养后3 d细胞增生率明显高于CD4+T细胞与MDSCs共培养,差异有统计学意义(P=0.000);CD4+T细胞单独培养后3 d细胞上清液中IFN-γ质量浓度明显高于CD4+T细胞与MDSCs共培养,差异有统计学意义(P=0.000)(图5)。
2.4 MDSCs及分化培养下Th17细胞分化情况比较
流式细胞计数检测显示,MDSCs培养组较无MDSCs培养组和普通培养基组IL-17A表达量明显增多。在MDSCs存在下,添加IL-6+TGF-β培养组较普通培养组和无MDSCs培养组Th17细胞比例明显增多,添加IL-6+TGF-β培养组较普通培养组和无MDSCs培养组细胞上清液中IL-17A质量浓度明显升高,MDSCs培养组CD4+T细胞中Th17细胞分化相关蛋白STAT3mRNA和RORγt mRNA相对表达量明显高于无MDSCs培养组,差异均有统计学意义(均P<0.01);MDSCs培养组与无MDSCs培养组间RORα mRNA相对表达量的差异无统计学意义(P>0.05)(图6)。

图3 小鼠脾脏CD11b+Gr1+MDSCs与Th17细胞频率的关系
Fig3 Correlation between CD11b+Grl+MDSCs frequency with Th17 frequency
A:正常对照组小鼠CD11b+Gr1+MDSCs的表达频率与Th17细胞频率间无明显线性相关(P=0.642,n=6)(Pearson直线相关分析);B:CIA组小鼠脾脏CD11b+Gr1+MDSCs与Th17细胞频率呈正相关(R2=0.921,P=0.002)(Pearson直线相关分析,n=6); CIA:胶原诱导关节炎;MDSCs:髓系来源抑制细胞;Th17:辅助T细胞17

图4 两组小鼠细胞上清液中炎性因子、抑炎因子含量及相关因子基因表达比较
Fig4 Comprison of inflammatory factors, inflammation-inhibitory factors, and related gene expression between CIA group and control group
与正常对照组比较,aP<0.01 (独立样本t检验); 与正常对照组比较,bP<0.05 (独立样本t检验);CIA:胶原诱导关节炎;IL:白细胞介素;ROR:视黄酸相关孤儿受体
2.5 IL-1β介导MDSCs促Th17细胞分化
与对照组比较,Transwell培养体系中Th17细胞比例和IL-17A质量浓度明显增加,上清液中IL-1β质量浓度明显升高[(33.9±3.1)pg/mlvs.(18.1±3.9)pg/ml],差异有统计学意义(P=0.006)(图7A-C)。非Transwell共培养体系上清液中IL-1β质量浓度也明显升高[(76.42±5.6)pg/mlvs.(19.3 ±2.3)pg/ml],差异有统计学意义(P=0.006)(图7D)。培养过程中阻断IL-1β信号作用时Th17细胞比例和培养液中IL-17细胞因子明显减少,Th17分化相关蛋白STAT3 mRNA、RORγt mRNA相对表达量明显减少(图7E-H)。

图5 CIA组CD4+T细胞培养与CD4+T细胞+MDSC共培养CD4+T细胞增生率和IFN-γ质量浓度比较
Fig5 Comprison of CD4+T cell frequency and IFN-γ concentration between with and without MDSCs culture in CIA group
A:流式细胞术检测CD4+T细胞单独培养细胞增生率高于CD4+T细胞+MDSCs共培养; B:CD4+T细胞培养与D4+T细胞+MDSCs共培养细胞增生率量化比较, 与CD4+T细胞单独培养比较,aP<0.01(独立样本t检验); C:CD4+T细胞培养与D4+T细胞+MDSCs共培养上清液中IFN-γ质量浓度量化比较, 与CD4+T细胞单独培养比较,aP<0.01(独立样本t检验); MDSCs:髓系来源抑制细胞;IFN-γ:γ干扰素

图6 MDSCs对CIA小鼠Th17细胞分化的促进作用
Fig6 Promoting effect of MDSCs on Th17 differentiation in CIA mice
A:流式细胞计数检测显示,MDSCs与CD4+T细胞共培养组较无MDSCs培养组和普通培养基组IL-17A表达量明显增多; B:MDSCs存在与否及是否分化培养(IL-6+TGF-β)情况下Th17细胞比例比较,与MDSCs存在的分化培养(IL-6+TGF-β)组比较,aP<0.01(单因素方差分析,LSD-t检验); C:MDSCs存在与否及是否分化培养(IL-6+TGF-β)情况下细胞上清液中IL-17A质量浓度比较,与MDSCs存在的分化培养(IL-6+TGF-β)组比较,aP<0.01(单因素方差分析,LSD-t检验); D:MDSCs存在与否细胞中Th17细胞分化相关蛋白基因的表达量变化, 与无MDSCs培养组比较,aP<0.01(独立样本t检验);MDSCs:髓系来源抑制细胞;IL:白细胞介素;Th17:辅助T细胞17;TGF:转化生长因子;ROR:视黄酸相关孤儿受体
3 讨论
正常情况下,外周血单个核细胞中MDSCs的含量不足0.5%。在正常小鼠骨髓内含有20%~30% CD11b+Gr1+MDSCs,而在脾脏内只有2%~4%,在外周淋巴结内没有[15]。本研究发现,CIA模型小鼠脾脏中增加的CD11b+Gr1+MDSCs与Th17细胞呈明显正相关,而正常小鼠中两者间无明显关系,提示在自身免疫炎症性疾病环境中MDSCs可能对疾病的发展起着一定的促进作用,同时体外研究显示,在抗CD3/抗CD28 抗体存在情况下将CIA-MDSCs与CD4+T细胞进行共培养能够抑制T细胞的增生,减少IFN-γ的产生。CIA小鼠的MDSCs尽管仍然表现出对T细胞免疫抑制的作用,但是在疾病环境中增多的MDSCs却不能限制疾病的发展,也不能下调局部的炎症反应,其原因可能是局部炎性因子水平较高,增多的MDSCs不能与之抗衡,又或者MDSCs具有双刃剑的作用[16-17]。Wang等[18]研究指出,在CIA的形成过程中M-MDSCs的量逐渐增多并与炎症程度有关,而PMN-MDSCs的水平却减少,PMN-MDSCs较M-MDSCs表现出更强的免疫抑制功能。当获得性转移PMN-MDSCs时,关节的炎症反应缓解,血清Th1和Th17细胞型因子减少,在CIA的发展过程中抑制性的PMN-MDSCs逐渐向炎症性M-MDSCs转变。Zhu等[19]在EAE小鼠外周血、脾脏及脑组织中发现M-MDSCs明显增多,这群细胞通过产生的一氧化氮或精氨酸酶1(arginase-1,Arg-1)抑制T细胞的增生并促进细胞凋亡。Ioannou等[8]发现EAE小鼠淋巴组织和靶器官内G-MDSCs明显增多,当体内过继转移G-MDSCs时可以通过抑制Th1和Th17细胞免疫反应缓解EAE病情,减少脱髓鞘现象并延迟发病。Zhang等[20]研究发现,CIA诱导期间CD11b+Gr1+细胞逐渐增多,关节炎病变达到高峰时细胞数量也达峰值,随后随着病情缓解而逐渐下降,且在病情进展过程中Ly6C+细胞逐渐增多,用吉西他滨选择性去除MDSCs能抑制T细胞的增生和IL-17、IL-1β的产生,获得性转移MDSCs则使关节炎的症状加重,并促进Th17细胞的分化。
研究表明,在分化成熟的Th17细胞内 RORα及RORγt特异性高表达,且在初始 T 细胞内转录编码RORγt的逆转录病毒可诱导其分泌 IL-17,表明 RORγt 在 Th17 分化发育过程中发挥重要作用。本研究发现CIA-MDSCs与幼稚CD4+T细胞在Th17分化培养条件下促进Th17细胞分化和IL-17A的产生以及STAT3和RORγt基因表达增多。此外,本研究还发现即使在无外加细胞因子IL-6 和TGF-β时,CIA-MDSCs也能促进Th17细胞的分化和IL-17A的产生。研究已表明,MDSCs具有免疫抑制作用,然而,在本研究中过度扩增的MDSCs不但具有抑制CD4+T细胞增生和IFN-γ产生的功能,而且还可以通过促进Th17细胞分化和相关炎症因子的产生起着促进疾病进展的作用,从而进一步加重组织炎症和组织损伤。King等[21]研究报道GM-CSF可促进表型为CD11b+CD62L+Ly6Chigh的单核细胞从骨髓中释放并通过血-脑屏障进入中枢神经系统,上调促炎因子的分泌量,并向树突状细胞和巨噬细胞分化,使EAE病情加重。Yi等[9]发现从EAE模型小鼠脊髓中分离出的MDSCs虽然在体外研究中能抑制T细胞增生,但是可以在IL-6和TGF-β细胞因子的共同作用下促进Th17细胞分化,当用吉西他滨选择性去除MDSCs后Th17细胞及炎症因子IL-17A和IL-1β含量减少,神经系统症状得到缓解,吉西他滨治疗后过继转移MDSCs时EAE症状又开始加重。另有研究表明在胃肠道肿瘤患者体内周围循环中增多的MDSCs与Th17细胞数量呈正相关,且与患者的预后不良有关[22]。以上这些结果表明MDSCs可能在病理环境中还具有促炎症反应的作用。
本研究还发现MDSCs和CD4+T细胞共培养后上清中有高水平的促炎因子IL-1β,表明MDSCs可能是IL-1β的主要来源;当在共培养过程中阻断IL-1β时Th17细胞和IL-17A以及STAT3 mRNA和RORγt mRNA表达水平明显减少,从而证明IL-1β在介导MDSCs的促进CD4+T细胞分化成Th17细胸骨过程中发挥重要作用。

图7 CIA小鼠IL-1β介导MDSCs的促Th17细胞分化作用
Fig7 Promoting effect of MDSCs Th17 differentiation mediated by IL-1β in CIA mice
A:流式细胞技术检测显示MDSCs培养组IL-17A水平明显高于无MDSCs组; B:Transwell培养体系与对照组Th17细胞数量比较,aP<0.01(独立样本t检验); C:Transwell培养体系与对照组上清液中IL-17A质量浓度比较,aP<0.01(独立样本t检验); D:MDSCs和CD4+T细胞共培养组与CD4+T细胞培养组上清液中IL-1b质量浓度比较,aP<0.01(独立样本t检验); E:流式细胞技术检测显示MDSCs+IL-1β mAb组和MDSCs+IL-1ra组上清液中IL-17A 水平明显低于MDSCs组; F:各Th17细胞分化阻断组与对照组Th17细胞数量的比较, 与安慰剂组比较,aP<0.01(单因素方差分析,LSD-t检验); G:各Th17细胞分化阻断组与对照组上清液中IL-17A质量浓度比较; 与安慰剂组比较,aP<0.01(单因素方差分析,LSD-t检验); H:各Th17细胞分化阻断组与对照组细胞中Th17分化相关蛋白mRNA相对表达量比较, 与安慰剂组比较,aP<0.01(单因素方差分析,LSD-t检验);MDSCs:髓系来源抑制细胞;IL:白细胞介素;Th17:辅助T细胞17;ROR:视黄酸相关孤儿受体
目前已有研究表明MDSCs除对T细胞活性具有抑制作用外,还可以产生一些炎症因子如IL-6、IL-1β和TNF-α等。体外诱导或者肿瘤组织中分离的MDSCs体外培养24 h或者48 h发现培养上清液中IL-1β、IL-6和TGF-β产生增加,用上清液培养CD4+幼稚T细胞时促进Th17细胞的分化和IL-17A的分泌增加[23]。此外,Yi等[9]在EAE的研究中发现,模型小鼠体内分离的MDSCs与CD4+幼稚T细胞共培养时培养液中有高水平的促炎因子IL-1β,当用吉西他滨去除EAE小鼠体内MDSCs时发现IL-1β水平降低,而且MDSCs胞内检测也发现有IL-1β的存在,这些说明MDSCs可以产生IL-1β,同时MDSCs与幼稚CD4+T细胞共培养时发现MDSCs的促Th17分化作用是通过IL-1β的信号实现的,与本研究的结果相一致。研究表明,IL-1β在Th17细胞分化的早期阶段通过促进IRF4 和RORγt的表达从而促进Th17细胞的分化[24],且RA患者活化的CD14a+单核细胞也可以IL-1β介导的方式促进Th17细胞的分化和炎症因子IL-17A的分泌[25]。尽管本研究中发现IL-1β介导了MDSCsDE 促Th17细胞分化作用,然而研究显示MDSCs能抑制Th1细胞的增生,升高的MDSCs除了是由于MDSC直接促进Th17增生分化外,还有可能是由于MDSCs更大程度抑制Th1的增生分化,从而提高Th17细胞的比例,究竟是哪种因素起主导作用还需后续实验进一步明确。
关于MDSCs对Th17细胞分化的影响目前尚未有明确定论。本研究发现体内CIA-MDSCs与Th17细胞频率呈正相关,而正常对照组中两者之间无明显相关,体外CIA-MDSCs与CD4+T细胞共培养时能促进Th17细胞的分化,推测可能与本实验分离培养的MDSCs是小鼠关节炎发病达到高峰时进行的有关,然而本实验并没有明确区别是MDSCs的哪种亚群起到了关键作用。Fujii等[12]研究发现,CIA小鼠扩增的MDSCs在体外能抑制CD4+T细胞的增生和Th17细胞的分化,抑制炎症因子如IL-6等的分泌,促进抑炎因子IL-10的产生,当获得性转移MDSCs时能减轻小鼠关节炎症状和局部淋巴结中CD4+T细胞和Th17细胞的浸润。Zhang等[26]的研究也发现CIA和佐剂性关节炎(adjuvant-induced arthritis,AIA)模型小鼠MDSCs通过调节炎症反应而缓解关节炎症状。Jiao等[27]研究中发现循环中MDSC和Arg-1增加,并且与RA患者的Th17细胞量呈负相关。MDSCs对Th17细胞分化产生的影响不一致的原因,可能是由于MDSCs的异质性以及MDSCs的抑制功能可能是由特定的疾病状态或者微环境决定所致。在自身免疫性疾病相关的炎症环境中MDSCs对Th17细胞扩增的影响及其机制有待更多的研究加以明确。

