2016—2018年我国部分猪群塞尼卡病毒回顾性监测
张 志,张丽丽,2,张 峰,刘 爽,董雅琴,张 慧,崔 进,吴发兴,李晓成
(1. 中国动物卫生与流行病学中心,山东青岛 266032;2. 青岛农业大学,山东青岛 266019)
塞尼卡病毒(Senecavirus A,SVA)曾用名塞尼卡谷病毒(Seneca Vally virus,SVV),是最近新发现的可以感染猪的一种单股RNA病毒,属于小核糖RNA病毒科[1]。SVA最初从转化的胎儿成视网膜细胞PER.C6的细胞培养基中被发现和分离到,并用于人溶瘤病毒治疗[2]。后来发现猪也可以感染SVA,并且发现发病猪的鼻吻部、蹄部冠状带等部位可以出现水泡样病变[3]。这种病变在临床上与口蹄疫、猪水泡性口炎、猪水疱病、猪水泡性疹等疾病十分相似,仅靠临床诊断很难鉴别[4]。近年来,SVA在猪群的感染范围呈现逐年扩大趋势,美国、加拿大、巴西、中国、泰国、哥伦比亚等养猪业较发达国家先后从出现水泡病的猪病料中检测到SVA[4-8]。2015年夏天,我国广东省某猪场发生了水泡样疾病,在排除口蹄疫、猪水疱病、猪水泡性口炎等疫病后,证实感染病原为SVA,且分离到SVA毒株CH-01-2015。该毒株与参考毒株SVV-001的同源性为94.4%~97.1%,这是我国首次报道猪场感染SVA[6]。随后,我国学者又分别从湖北、黑龙江、福建、河南等省份出现水泡病的猪病料中先后检测到SVA[9-12]。这些研究提示,我国猪群SVA的感染状况较为严重。但上述研究分离检测到SVA的样品均为发病的水泡样品,并没有针对SVA开展系统的流行病学调查和监测。一些流行病学信息,特别是未表现症状的外观健康猪群是否携带SVA更是亟待摸清。为此,针对2016—2018年从部分省市屠宰场和表现非水泡状猪群采集的样品,开展了SVA回顾性监测,以了解SVA在我国猪群的感染程度和分布规律。
1 材料与方法
1.1 样品与来源
458份组织混合样品和95份血清样品:2018年采集自广西、云南、新疆、辽宁、福建、湖南、湖北等7省份的屠宰场;病料样品164份:2016—2018年采自辽宁、河北、湖北、湖南、江西、四川、山东、上海、贵州、吉林、陕西、云南等12省份,其中2018年84份、2017年32份、2016年48份。采集样品时,每头猪采集适量的扁桃体、脾脏、肾脏、淋巴结、肺脏等混在一起,作为一个样品进行处理和检测。
1.2 主要试剂
Premix RT-PCR探针法一步法扩增试剂盒、pMD-18T vector和DH5α感受态细胞:宝生物工程(大连)有限公司产品;病毒RNA提取试剂盒(TRIzol):Life公司产品。
1.3 样品处理与RNA提取
将样品称重后加入4倍体积的PBS(0.01 mol/L,pH7.2)进行研磨,待全部乳化后,以8 000 r/min离心5 min,取上清液提取RNA。同时用本室分离和鉴定的SVA病毒GXT91作为阳性对照,用PBS作为阴性对照,同步提取RNA。RNA提取按照TRIzol试剂盒操作说明书进行,简述为:取0.25 mL样品上清液,加入0.75 mL TRIzol混匀,再加入0.2氯仿混匀;室温静置5 min,12 000 r/min离心5 min;取上清液加入等体积异丙醇,12 000 r/min离心5 min,保留沉淀;加入1 mL 70%乙醇洗涤1次,然后加入适量H2O溶解,置-70 ℃备用。对阳性样品接种的细胞上清液,也按照此法提取RNA。
1.4 样品检测
本研究使用荧光RT-PCR方法,对样品中的SVA核酸成分进行检测,根据GenBank公开的我国SVA毒株序列(KY419132)为靶基因序列设计引物。上游引物为SVA-F:ctgcgctgggaccgtatctca;下游引物为:SVA-R:cgccgcgccacctcatt;荧光引物 为SVA-P:5'-FAM-tgccgccaagtttcaatcccatcctgg-3'-BHQ1。反应体系为:2×Premix 12.5 μL,SVA- F引物(10 μmol/L)1 μL,SVA- R引物(10 μmol/L)1 μL,SVA- P引物(5 μmol/L)1 μL,样品RNA模板或阳性标准品2 μL,加水至25 μL。RT-PCR的反应程序为:42 ℃ 5 min,95 ℃预变性3 min,40个扩增循环(95 ℃ 8 s、60 ℃ 16 s),60 ℃读取荧光。SVA的判断标准为:Ct<35为阳性,35≤Ct<37为可疑,Ct≥37为阴性;可疑者重复检测1次,如果仍可疑或阴性,则判为阴性,如果为阳性,则判为阳性。
1.5 结果分析
根据监测结果,使用Excel、ArcGIS等软件进行分析,摸清SVA的三间分布。
2 结果与分析
2.1 屠宰场样品检测情况
本研究对7个省份的35个屠宰场进行了回顾性调查,对458份组织混合样品和95份血清样品进行回顾性检测。在混合组织样品中,检出SVA阳性55份,阳性率为12.0%;在血清样品中,检出阳性7份,阳性率为7.4%。在35个屠宰场中,有17个检出SVA阳性样品,场阳性率为48.6%。虽然7个省份均有屠宰场检出SVA阳性,但阳性率并不相同,最高的是福建,5个屠宰场均检测到阳性,场阳性率为100%,其次是湖北和新疆,场阳性率分别为66.7%和60.0%,最低的是湖南和云南,场阳性率均为20.0%。7个省份的SVA样品阳性率在2.7%~25.0%之间,其中在辽宁的60个样品中,检测到15份阳性,阳性率高达25.0%(但这些样品均来自同一个屠宰场),最低的是湖南和云南,样品阳性率均为2.7%(表1)。
2.2 病料SVA检测情况
在2016年10个省份采集的48份病料样品中,检出SVA阳性7份,占比为14.6%;2017年5个省份采集的32份病料样品中,检出SVA阳性7份,占比为21.9%。2018年3个省份采集的84份病料中,检出SVA阳性19份,占比为22.6%。其中:1—6月份,共检测病料样品36份,检测到SVA阳性5份,占比为13.9%;7—10月份,共检测病料样品48份,检测到SVA阳性14份,占比为29.2%;山东、四川、辽宁等3省份送检的病料中,均检测到SVA阳性样品(表2)。
2.3 阳性样品Ct值分布
从屠宰场62份阳性样品的SVA荧光RT-PCR扩增Ct值分布可以看出(图1),不同阳性样品的检测结果差异较大。其中:Ct≤20的3个(占4.8%),20<Ct≤25的1个(占1.6%),25<Ct≤30的10个(占16.1%),30<Ct≤35的40个(占64.5%),35<Ct≤37的8个(占12.9%)。这一结果表明,除少数阳性样品以外,大部分阳性样品中含有的SVA病毒数量并不多。

图1 屠宰场样品中SVA荧光RT-PCR扩增Ct值的分布
从病料样品SVA荧光RT-PCR扩增Ct值分布可以看出,25<Ct≤30的1个(占2.9%),30<Ct≤35的31个(占91.2%),35<Ct≤37的2个(占5.9%),说明未表现水泡样病变的样品与屠宰场样品中含有的SVA病毒数量分布基本一致(图2)。
2.4 时间分布情况
2016—2018年的病料样品SVA监测结果显示:2016年3个省份检出阳性,占比为14.6%,2017年5个省份检出阳性,占比为21.9%,2018年3个省份检出阳性,占比为22.6%,呈现逐年增加的趋势,也表明SVA早在2016年就已在我国多个省份的猪群中流行。

表1 屠宰场样品SVA检测情况

表2 我国部分省份猪病料中的SVA检出结果 单位:份

图2 屠宰场样品和发病样品中SVA阳性样品的比例分布
3 讨论
本监测研究了SVA 时间、空间分布等流行病学规律,通过对保存的病料进行检测,证实SVA在我国猪群的流行至少可以追溯到2016年,与Wu等[6]报道的时间基本一致。通过对不同时间样品进行检测发现,2016年SVA存在于辽宁、四川和山东等3个省份,2017年存在于辽宁、四川、山东、上海、贵州等5个省份,2018年存在于辽宁、上海和山东等3个省份。2018年对7个省份的36个屠宰场进行监测发现,调查的湖南、云南、新疆、辽宁、福建、湖北、广西等7省份均有不同程度的SVA感染,个体样品阳性率为11.2%(2.7%~25.0%),场阳性率为48.6%(20.0%~100%)。因调查的屠宰场位于不同的县,所以屠宰场阳性率更能反映出SVA的污染面。考虑到福建、湖北等省份已有检测到SVA的报道[9,12],且本次监测的福建(100%)和湖北(80.0%)屠宰场阳性率均较高,由此认为福建和湖北两省SVA的污染面较广。另外,有学者报道,我国的黑龙江、河南、福建、湖北、广东等5省均检测到SVA感染[9-12]。从以上结果可以看出,我国感染SVA的省份至少已有14个(图3)。
另外,本次监测虽然在部分省份采集的样品较少,如上海、贵州等地仅3个样品,但也能检测到SVA阳性,还有很多省份没有采样监测,因此推测我国的SVA实际感染情况应该比上述监测结果更严重。当然我国实际的SVA感染情况和流行面,还需要在后续工作中进一步深入研究。
根据Joshi等[13]的试验,将SVA毒株SD15-26接种猪以后,第4~5天就可呈现水泡病变,接种后第3天病毒血症最高,病毒拷贝数可达106.5个/mL,随后病毒含量逐渐下降,到接种后第10天,血液中已检测不出病毒RNA,但组织中的RNA直到接种后第28天才检测不出。另外,不同器官的SVA检出率也不同,扁桃体中检测到的病毒含量最高。本实验室已证明,本次检测使用的荧光RT-PCR方法的敏感性较高病毒拷贝数可达17.4个/μL。在用该方法对屠宰场样品和发病样品进行检测时,病毒拷贝数大于106.5个/mL的只有来自屠宰场的3个样品,而病毒拷贝数为174~1 740个/mL的样品有58份,占阳性样品总数的61.1%,病毒拷贝数为10~174个/mL的样品有20份,占阳性样品总数的21.1%,二者共计82.2%。从这一结果可以看出,病毒含量较低的样品,在阳性样品中占主要比例,这可能与病毒的代谢周期较快有关。
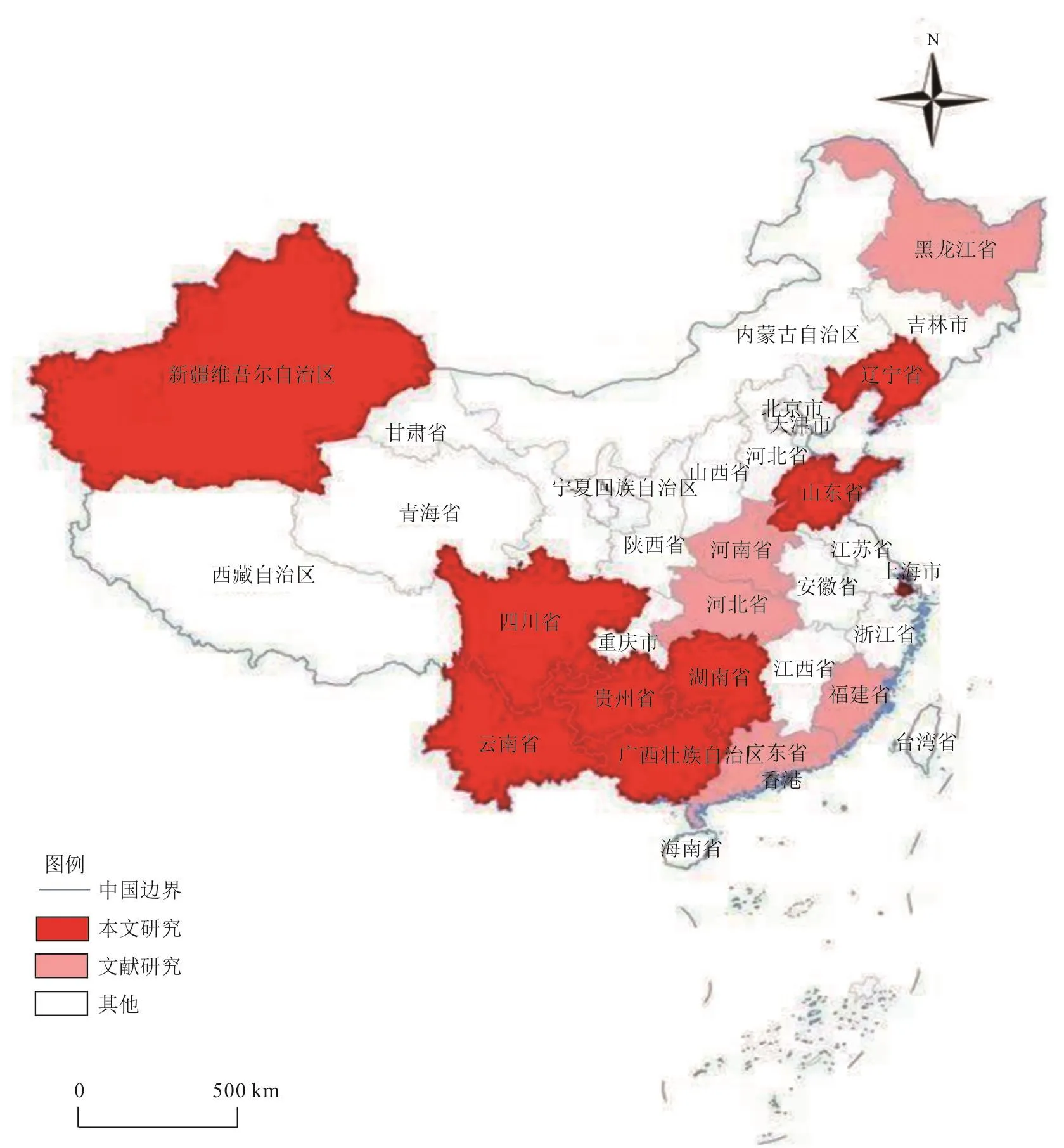
图3 我国SVA感染的空间分布
本调查是在我国猪群中首次开展的SVA流行病学监测,尽管样品的数量分布不十分规范和平衡,如有的省份收集的发病样品只有几份甚至1份,影响了结果的可信性,但这些初步的检测结果已充分证明,在外观健康的猪群中仍然可以检测到SVA阳性,且阳性率高达11.2%。这一结果说明我国猪群中SVA感染已比较常见,同时本监测也证实了许多生猪存在带毒不发病的隐性带毒现象,这种现象更有利于SVA的传播和扩散。进一步比较发病样品和外观健康猪样品中的SVA检测情况,发现发病猪样品中的SVA阳性占比为20.7%,明显高于外观健康猪群。究其原因,可能与发病猪免疫力下降有利于SVA的感染和增殖有关。总之,即使对于未表现出典型水泡样病变的生猪,仍存在携带和传播SVA的风险。另外,Joshi等[14]发现,在感染SVA猪舍的苍蝇、老鼠粪便、老鼠小肠、环境样品中均能检测到SVA,并从老鼠的粪便和小肠中分离到SVA[14],这意味着在猪群生产和管理中必须格外重视对外观健康猪群的监视和监测。
4 结论
本监测对2016—2018年从我国辽宁等12个省份采集的猪群病料和2018年从我国福建等7个省份35个屠宰场采集的组织混合样品和血清样品,用荧光实时定量RT-PCR方法进行SVA回顾性检测,在所有检测省份每年的病料样品或屠宰场样品中均检出SAV阳性,表明SVA在我国猪群的流行至少可以追溯到2016年,且流行面较广,存在隐性感染状况,今后须需重视对猪群SVA的监视和监测。

