辛伐他汀对脑出血大鼠继发性炎症损伤的防治作用及作用机制研究
李建锋,李巍,史紫堉
(1.河南省浚县人民医院神经外科,河南 鹤壁 456250 2.郑州大学医学院,河南 郑州 450001)
脑出血(ICH)是由脑血管破裂引起的非创伤性实质性出血,发病凶险,病情变化快,存活病人远期多伴随不同程度的继发性脑损伤,严重影响患者的生活质量。研究表明,脑出血发生后,内皮细胞损伤,病变周围脑组织的神经元受到刺激,核因子κB(nuclear factor kappa beta,NF-κB)通路被激活,导致血肿周围脑组织发生严重炎症反应,最终成为继发性脑损伤的重要环节[1-4]。辛伐他汀是从土曲霉素降解产物中半合成的他汀类降脂药物,研究表明,辛伐他汀可抑制脑血管疾病患者的炎症因子表达,具有抗炎、抗调亡以及保护神经,减少脑组织水肿的作用[5-6]。但是辛伐他汀是否通过抑制NF-κB通路发挥减少炎症损伤的作用还有待更进一步研究。为此,本研究通过建立SD大鼠的脑出血模型,给予辛伐他汀治疗,以探讨辛伐他汀对大鼠脑出血后继发性炎症损伤的防治作用及作用机制。
1 材料和方法
1.1 实验动物和分组
选取9~12周龄的健康雄性SD大鼠60只,体质量(300±20)g。将 60只大鼠随机分成三组:模型组、辛伐他汀组和对照组,各20只。大鼠饮食饮水正常,精神可。
1.2 脑出血模型制作
于模型组和辛伐他汀组大鼠右侧脑组织基底神经节处注射新鲜自体不凝血,采用Fredrik法[7]建立脑出血模型。大鼠出现食水摄入减少、活动减少、体重减轻、精神萎靡等症状,脑组织切片中既存在明显的血肿,又无血肿破入脑室,表示建模成功。
1.3 给药
三组均常规灌胃给药,qd,灌胃一周,辛伐他汀组给予辛伐他汀和生理盐水配制的溶液,以3 mg/(kg·d)剂量给药;模型组和对照组给予等体积的生理盐水。
1.4 取样
成功建立模型后的12,24,48,72 h和第7天,每组分别处死4只大鼠。大鼠断头取脑后迅速将血肿周围脑组织冠状切成厚约2 mm的薄片4片,2片用于干湿重法测定坏死脑组织含水量变化,剩余薄片用多聚甲醛固定,用于Nissl染色、免疫组化。
1.5 观察指标
1.5.1 神经功能行为学评分 成功建模后的12,24,48,72 h和第7天,依照Garcia法对大鼠进行神经功能行为学评分。分数越低,表示大鼠神经功能障碍越严重。
1.5.2 未损伤的神经元数目 将固定后的脑组织薄片脱水、包埋和切片后进行Nissl染色。在光学显微镜(40×10)下,观察连续6个无重叠的脑组织视野区,计算未损伤的神经元数目。
1.5.3 免疫组化观察 NF-κB、Toll样受体 4(TLR4)、白介素(IL)-1β的蛋白表达 将固定后的脑组织薄片脱水,包埋,切片和烤片后进行免疫组织化学分析。在光学显微镜(40×10)下,观察连续6个无重叠的血肿周围脑组织视野区,计数NF-κB、TLR4、IL-1β阳性细胞数目。
1.6 统计学方法
运用统计软件SPSS 21.0分析数据,计量资料以“x±s”表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 神经功能障碍评分(NDS)结果
建模后所有时间点,辛伐他汀组与模型组NDS均低于对照组,辛伐他汀组NDS均高于模型组,差异有统计学意义(P<0.05)。见表1。
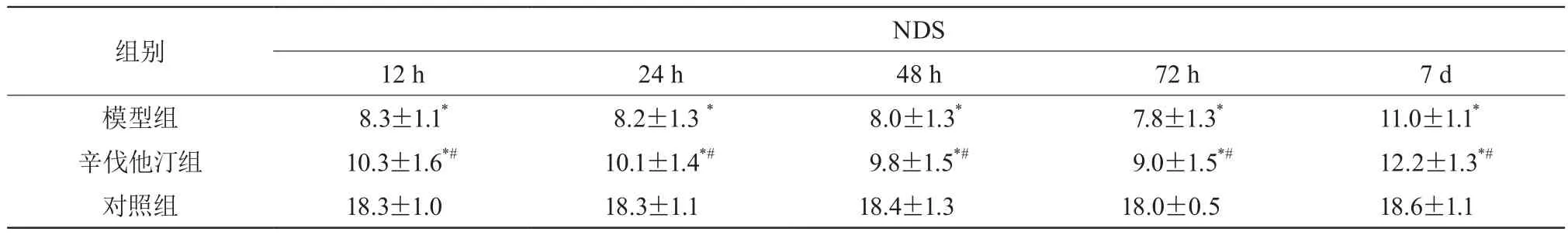
表1 三组NDS比较
2.2 未损伤的神经元数目
建模后12,24,48,72 h与7 d辛伐他汀组未受损神经元数目均高于模型组,差异有统计学意义(P<0.05)。见图1。
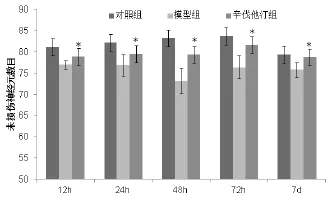
图1 三组不同时间点病变周围未受损神经元数目比较
2.3 三组损伤周围脑组织中NF-κB,TLR4和IL-1β阳性细胞数目比较
建模后7天,辛伐他汀组和模型组NF-κB、TLR4、IL-1β阳性细胞数目均高于对照组,辛伐他汀组NF-κB、TLR4、IL-1β阳性细胞数目均低于模型组,差异有统计学意义(P<0.05)。见表2。
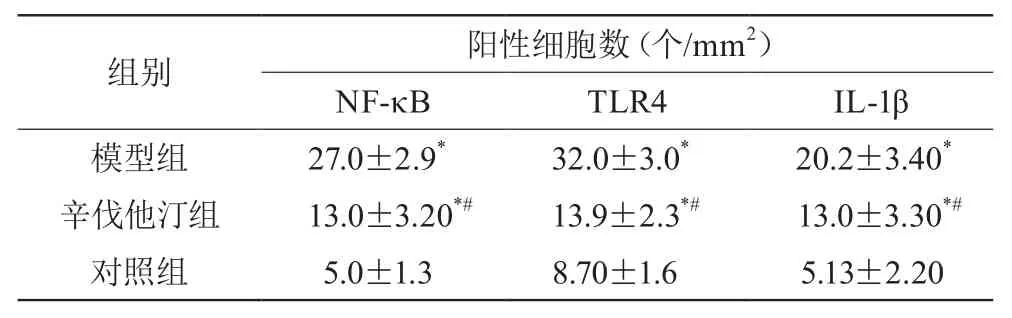
表2 7 d后三组病变周围脑组织中NF-κB,TLR4和IL-1β阳性细胞数比较
3 讨论
研究人员建立脑出血大鼠模型并使用辛伐他汀干预治疗,发现辛伐他汀可以降低神经元的死亡率,加强脑组织突触的再生,改善大鼠的神经和认知功能[7]。在本实验中,辛伐他汀组在建模后所有时间点的NDS和未受损神经元数目均显著高于模型组(P<0.05),表明辛伐他汀可有效改善脑出血大鼠的神经功能。
研究显示,脑出血发生后病变周围脑组织的神经元受到刺激,血肿周围组织缺血缺氧,可激活NF-κB通路,导致继发性炎症损伤[1-3]。提示NF-κB通路在脑出血后继发性炎症损伤的过程中起关键性作用。TLR 4为一种模式识别受体,在缺血性脑损伤机体中表达显著上调,并介导炎症因子增加,诱发脑组织炎症反应[8-9]。IL-Iβ可通过多种途径参与脑损伤后继发的炎症反应,介导神经元坏死、缺失,是构成一系列病理变化及继发性炎症损伤的重要环节[10]。NF-κB可促进IL-1β等细胞因子的表达,同时这些细胞因子又可进一步活化NF-κB,造成持续或放大的炎症反应[11]。有研究表明,辛伐他汀可有效降低TLR4通路介导的炎症因子的表达[12]。本实验中,辛伐他汀组建模7天后,NF-κB、TLR4和IL-1β阳性细胞数均显著低于模型组(P<0.05)。表明辛伐他汀可能通过下调TLR4介导的NF-κB信号通路的表达,抑制IL-1β的表达,缓解脑出血后继发性炎症损伤。
综上,辛伐他汀可能通过下调TLR4介导的NF-κB通路,抑制IL-1β的表达,减轻炎症反应,保护神经元,减少脑出血大鼠脑组织的继发性炎症损伤。

