阿帕替尼治疗晚期软组织肉瘤的临床疗效和安全性
左立杰,刘维丽,李蕊,王月华,杨已起,刘铮,依荷芭丽·迟#北京市朝阳区三环肿瘤医院肿瘤内科,北京00
2国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院肿瘤内科,北京1000210
软组织肉瘤(soft tissue sarcoma,STS)是一类间叶组织来源的恶性肿瘤,可发生于全身及各年龄段,其发病率为(2~3)/10万,占成年恶性肿瘤的1%,病死率占所有肿瘤相关死亡的2%[1]。世界卫生组织(WHO)将STS分为50多种病理组织亚型,常见的亚型包括多形性未分化肉瘤、胃肠道间质肿瘤、脂肪肉瘤、平滑肌肉瘤、滑膜肉瘤、血管肉瘤、纤维肉瘤和恶性神经鞘瘤等[2]。由于发生部位的差异,不同的病理类型间存在较强的异质性。STS的治疗需根据肿瘤的不同病理组织学亚型、分子学特征、病理分期,以及影响预后的因素等,采取包括手术、放疗、化疗和分子靶向治疗在内的个体化治疗模式[3]。手术切除是大部分STS患者的标准化初始治疗方法,且合理的外科手术是唯一治愈STS的手段[4]。约80%的STS患者术后2年可出现复发及远处转移,预后较差,多于8~12个月后死于疾病进展。多柔比星联合异环磷酰胺化疗方案是治疗晚期STS的标准一线化疗方案[5]。目前,国内尚无公认有效的二线化疗药物及治疗方案,如何提高晚期STS患者的二线治疗方案的疗效成为临床有待解决的问题[6]。近年来,多种靶向治疗药物不断应用于进展期STS的治疗,并取得了一定的临床疗效,未来分子靶向药物和免疫治疗药物成为重要的研究方向。肿瘤血管生成是恶性肿瘤发生与发展过程中的关键步骤,抑制肿瘤血管生成成为重要的治疗策略。阿帕替尼是一种口服小分子血管生成抑制剂,可高度选择性地抑制血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)的酪氨酸激酶活性,抑制VEGFR2介导的下游信号转导。有研究显示,阿帕替尼治疗晚期STS具有一定的临床疗效,且不良反应总体可控[7]。因此,本研究分析阿帕替尼治疗复发难治性STS的临床疗效和安全性,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2016年1月至2018年5月北京市朝阳区三环肿瘤医院收治的晚期STS患者的临床资料。纳入标准:①经病理组织活检证实为晚期STS;②至少有1个可测量的病灶;③既往接受一线及以上化疗方案治疗失败的患者;④美国东部肿瘤 协 作 组(Eastern Cooperative Oncology Group,ECOG)体力状况(performance status,PS)评分≤2分;⑤生存时间≥3个月。排除标准:①合并不可控制的高血压;②伴有心、肝、肾等多器官功能不全;③合并活动性出血者。依据纳入和排除标准,共纳入31例晚期STS患者,其中男14例,女17例;年龄15~71岁,≤65岁28例,﹥65岁3例;ECOG-PS评分:0~1分27例,2分4例;病理类型:平滑肌肉瘤6例,滑膜肉瘤4例,脂肪肉瘤3例,纤维肉瘤3例,血管外皮细胞瘤3例,梭形细胞肉瘤3例,横纹肌肉瘤2例,原始神经外胚层瘤2例,多形性未分化肉瘤2例,恶性外周神经鞘瘤例1例,其他类型2例;原发灶部位:四肢5例,躯干6例,内脏10例,腹膜后7例,头颈3例;所有患者均存在远处转移(肺转移19例,肝转移12例,骨转移8例,腹膜后转移7例);肿瘤直径≥5 cm共13例,﹤5 cm共18例;既往手术史:接受过1次及以上手术治疗26例,未接受过手术治疗5例;既往是否接受放疗:是7例,否24例;治疗方案:二线治疗22例,三线及以上治疗9例;初次口服阿帕替尼的剂量:250 mg 2例,425 mg 19例,500 mg 10例。
1.2 治疗方法
所有患者用药前均评估血常规、尿常规、肝肾功能、凝血功能和心脏功能。口服阿帕替尼250 mg/d、425 mg/d或500 mg/d,持续服用至疾病进展或出现不可耐受的不良反应,包括血液学不良反应(白细胞减少、血小板减少、贫血)和非血液学不良反应(重度高血压、手足综合征、蛋白尿、出血等),将阿帕替尼减量至250 mg/d或停止用药。服药期间每天测量血压1次,每2周复查血常规、尿常规、肝肾功能和心电图等指标,初次影像学复查时间为服药后6周,随后每8周进行影像学复查。采用电话或门诊复诊等方式进行随访,随访截止日期为2018年7月31日,中位随访时间为18个月(95%CI:3~29)。
1.3 观察指标和评价标准
依据实体瘤疗效评价标准(RECIST 1.1)[8]评估31例STS患者的近期疗效:完全缓解(complete response,CR),所有目标病灶消失;部分缓解(partial response,PR),基线病灶最大径总和缩小≥30%;疾病进展(progressive disease,PD),基线病灶最大径总和增加≥20%或出现新病灶;病情稳定(stable disease,SD),基线病灶最大径总和有缩小但未达PR或有增加但未达PD。12周疾病无进展率=口服阿帕替尼治疗时间达12周时疾病无进展例数/总例数×100%,客观有效率(objective response rate,ORR)=(CR+PR)例数/总例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)例数/总例数×100%。根据国际肿瘤化疗药物不良反应评价系统(CTCAE 4.0)[9]评估所有STS患者的不良反应。评估患者的远期疗效,包括无进展生存时间(progression free survival,PFS)和总生存时间(overall survival,OS),PFS指首次口服阿帕替尼至PD或死亡的时间,OS指开始口服阿帕替尼至因任何原因死亡的时间。
1.4 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计数资料以例数和率(%)表示,组间比较采用χ2检验;采用Kaplan-Meier法绘制生存曲线,生存率的比较采用Log-rank检验。P﹤0.05为差异有统计学意义。
2 结果
2.1 近期疗效
31例STS患者中,0例达到CR,5例达到PR,19例达到SD,7例为PD,ORR为16.1%(5/31),DCR为77.4%(24/31)。
2.2 远期疗效
随访至2018年7月31日时,已有24例患者出现PD,7例患者仍持续口服阿帕替尼治疗。所有患者的中位PFS为4.6个月(95%CI:1.5~12.0),12周疾病无进展率为64.5%,中位OS为8.0个月(95%CI:3.0~12.0)。(图1)
2.3 不同临床特征STS患者PFS和OS的比较
不同性别、年龄和转移部位STS患者的PFS比较,差异均有统计学意义(χ2=5.226、14.697、3.940,P﹤0.05);不同ECOG-PS评分、原发灶部位、既往是否手术、既往是否放疗、治疗方案和肿瘤直径STS患者的PFS比较,差异均无统计学意义(P﹥0.05)。不同性别、年龄、ECOG-PS评分、原发灶部位、既往是否手术、既往是否放疗、治疗方案、肿瘤直径和转移部位STS患者的OS比较,差异均无统计学意义(P﹥0.05)。(表1)
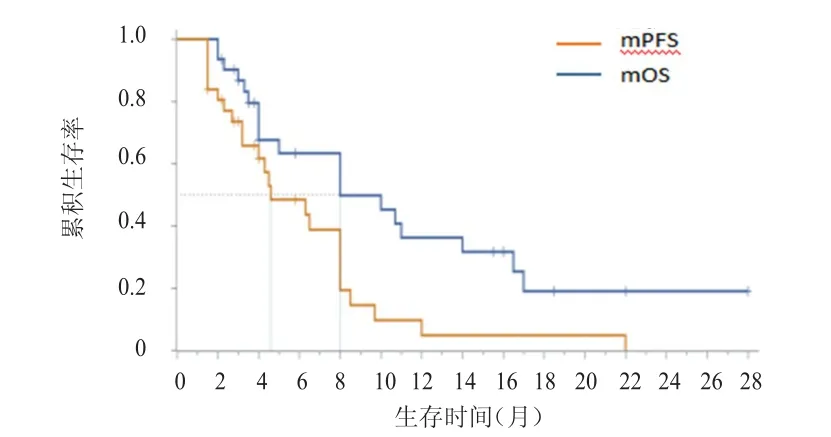
图1 31例STS患者的生存曲线
2.4 不良反应情况
随访期间,31例STS患者发生的1~2级不良反应,包括血液学不良反应(白细胞减少13例),以及非血液学不良反应(高血压15例,蛋白尿13例,手足综合征7例,口腔溃疡8例,出血5例,声音嘶哑1例)。5例患者因发生3级非血液学不良反应将阿帕替尼剂量减低至250 mg/d,其中2例为出血,2例为蛋白尿,1例为声音嘶哑。所有患者未发生4级不良反应。

表1 不同临床特征STS患者的PFS和OS( n=31)
3 讨论
成年STS是一种较少见,且异质性较强的恶性肿瘤,发病率较低,早期治疗以手术及局部放化疗为主。晚期STS患者生存期较短、预后较差。多柔比星联合异环磷酰胺化疗方案作为一线治疗晚期STS的有效率约为35%[10]。目前,对于一线治疗失败的晚期STS患者,国内尚没有标准的二、三线治疗方案。研究显示,单药多西他赛作为二线化疗药物治疗晚期STS,有效率约为17%[11]。吉西他滨联合多西他赛是目前应用较多的二线化疗方案,吉西他滨在STS的治疗中也显示出了一定的临床疗效[12]。近年来,随着对STS发病机制的深入研究,分子靶向药物和免疫抑制药物越来越多的应用于晚期STS患者,并显示出了一定的临床疗效,为晚期STS的治疗开辟了新方向。PALETTE研究为一项Ⅲ期临床研究,探讨帕唑帕尼二线治疗晚期STS的临床疗效,该研究共纳入369例既往蒽环类为基础化疗方案治疗失败的转移性STS(脂肪肉瘤除外)患者,随机分为帕唑帕尼单药组和安慰剂组,结果显示,帕唑帕尼单药组患者的PFS明显长于安慰剂组(4.6个月vs 1.6个月,P﹤0.01)[13]。表明帕唑帕尼二线治疗转移性STS患者的效果较好,帕唑帕尼成为美国食品药品监督管理局批准的第一个用于治疗晚期STS的二线靶向药物。国内一项多中心盐酸安罗替尼治疗STS的Ⅱ期临床研究结果显示,患者的12周疾病无进展率为68.42%,达到了主要研究终点,中位PFS为5.63个月[14]。此外,安罗替尼的安全性也较好。2018年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)口头报告了一项盐酸安罗替尼的ⅡB期临床研究,结果显示,安罗替尼组患者的中位PFS为6.27个月,明显长于安慰剂组的1.47个月(P﹤0.01),ORR分别为 10.13% 和 1.33%(P=0.0145),DCR分别为55.7%和22.67%(P﹤0.01)。表明安罗替尼在已有的临床研究中均显示出较好的临床疗效,有望成为STS的二线治疗方案。
阿帕替尼是一种新型的小分子抗肿瘤血管生成剂,属于VEGFR2酪氨酸激酶抑制药。阿帕替尼的主要作用机制是竞争性结合VEGFR2细胞内酪氨酸ATP结合位点,通过阻断VEGF结合后的信号转导通路,有效抑制肿瘤血管生成,从而抑制肿瘤细胞的增殖和转移[15]。早在2014年,国家食品药品监督管理总局就已经批准阿帕替尼用于晚期胃或胃-食管结合部腺癌的三线或三线以上治疗。多项研究也已证实,阿帕替尼在肺癌、乳腺癌、肝癌、结直肠癌和卵巢癌等的治疗中具有一定的临床疗效[16-17]。Yan等[18]采用阿帕替尼(425 mg/d)治疗1例化疗失败的晚期多形性脂肪肉瘤患者,患者的生活质量明显提高,PFS为3个月。Ji等[19]采用阿帕替尼治疗1例晚期血管肉瘤患者,结果显示,与化疗相比,该患者的耐受更好。Zhu等[20]采用阿帕替尼治疗31例晚期STS患者的研究结果显示,DCR为75.0%,中位PFS为4.25个月,中位OS为9.43个月。由此可见,对于一线或一线以上化疗失败的晚期STS患者,采用阿帕替尼靶向治疗具有一定治疗前景。
本研究结果显示,31例STS患者的中位PFS为4.6个月,12周疾病无进展率为64.5%;中位OS为8.0个月;此外,性别、年龄和转移部位可能与STS患者的PFS有关,与Atean等[21]的研究结果相符,表明阿帕替尼在晚期STS患者二、三线治疗中疗效确切。
本研究结果显示,31例STS患者接受阿帕替尼治疗后,最常出现的不良反应为高血压、蛋白尿、手足综合征、白细胞减少、口腔溃疡和出血等,但这些不良反应多为1~2级,对症处理后缓解。此外,5例患者因发生3级非血液学不良反应而将阿帕替尼的服药剂量减低至250 mg/d,给予对症处理后缓解。所有患者未发生4级不良反应发生及相关性死亡。相关研究显示,阿帕替尼引起的药物不良反应,如高血压、蛋白尿和手足综合征的早期出现与临床疗效和生存获益相关[22],但尚需进一步大样本、多中心、随机的临床研究,以验证阿帕替尼治疗晚期STS后出现不良反应的时间及程度是否与疗效及预后相关。
综上所述,阿帕替尼治疗一线及以上化疗失败的晚期STS患者,有一定的临床疗效,且安全性较好,但由于本研究样本量小,尚需进一步大样本的随机对照组研究进行验证。

