上海市定点监测猪群伪狂犬病病原学调查与病毒分离鉴定
鞠厚斌,杨德全,葛菲菲,刘 健,李 鑫,杨显超,齐新永,邓 波,王 建,周锦萍
(上海市动物疫病预防控制中心,上海 201103)
伪狂犬病(Pseudorabies,PR)是由疱疹病毒科、α-疱疹病毒亚科中的伪狂犬病毒(Pseudorabies virus,PRV)引起的一种急性多种动物共患传染病[1]。本病在世界范围内普遍流行,目前已有50多个国家和地区报道发生PR。随着规模化养猪业的不断发展和强毒株的出现,PR 的发生和流行日趋严重,给养猪业造成严重经济损失,已成为对全球养猪业危害最大的传染病之一。
从国内流行范围上看,PR流行范围很广,遍及 24 个省(自治区、直辖市),特别是随着养猪业集约化、规模化发展,本病有逐渐扩大和蔓延的趋势,但没有发生大规模暴发,多呈散发流行。从发病年龄上看,以繁殖母猪和仔猪为主,2 周龄以内仔猪的发病率和死亡可高达100%,断奶仔猪的发病率为20%~40%,死亡率为10%~20%,养猪密集地区的发病率较高[2]。2012 年以来,PRV变异毒株在全国范围内流行,给PR净化和预防带来了新的压力,也给我国养猪业造成了惨重损失[3]。为了解上海市定点监测猪群的PRV感染情况,应用荧光PCR方法开展病原学调查,并分离鉴定地方流行毒株,以期为制订合理的PR防控与净化策略提供参考。
1 材料与方法
1.1 样品来源
2014—2015年,采集上海市1个兽医疾病诊断中心、14个种猪场、8个规模猪场、3个屠宰场定点监测猪群的内脏、扁桃体、颌下淋巴结、血清、唾液、精液等样品,共1 863份(表1)。不同种类样品来源于不同猪只,采集后-20 ℃备用。
1.2 实验动物
PRV抗体阴性的6月龄健康家兔6只:购自上海丙干宠物有限公司。
1.3 主要试剂
核酸提取试剂盒QIAamp MinElute Virus Spin Kit :购自QIAGEN 公司;PRV荧光PCR试剂盒:购自北京生科尚仪生物科技有限公司;BHK-21细胞株:上海市动物疫病预防控制中心保存;DMEM和胎牛血清:购于Thermo公司。
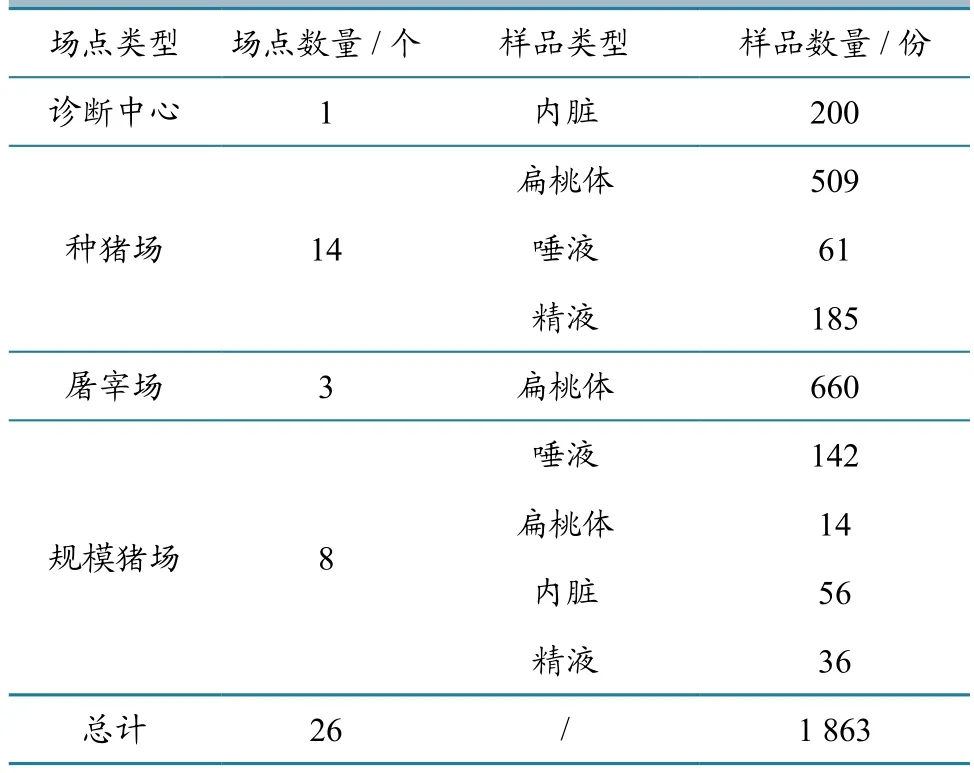
表1 2014—2015年上海市定点监测猪群PR病原学检测的样品来源与数量
1.4 核酸提取及荧光PCR 检测
参照核酸提取试剂盒QIAamp MinElute Virus Spin Kit说明提取病毒核酸,按照北京生科尚仪生物科技有限公司的PRV荧光PCR试剂盒说明书进行核酸检测。
1.5 病毒分离与鉴定
1.5.1 病料处理 将无菌采集的病死猪淋巴结、脾脏等组织研磨,用PBS制成1∶10的组织悬液,加入适量青霉素、链霉素处理后,反复冻融3次,4 000 r/min离心10 min,取上清液,-20 ℃冰箱保存备用。
1.5.2 病毒的细胞培养 将病料悬液上清液接种于BHK-21单层细胞,盲传3代,观察有无细胞病变。待细胞病变达80%左右时收获病毒液,经3 次反复冻融,4 000 r/min离心10 min,取上清液接种细胞进行病毒克隆纯化及病毒蚀斑计算。
1.5.3 荧光PCR方法鉴定 按照北京生科尚仪生物科技有限公司的PRV荧光PCR试剂盒说明书进行检测。
1.5.4 间接免疫荧光抗体试验(IFA) 将2 mL BHK-21细胞悬浮液加入腔式载玻片,37 ℃温箱培养24 h;弃掉原细胞培养液,用无菌PBS洗3次,再加入1 mL PCR检测阳性的病毒液; 37 ℃温箱作用1 h后,吸掉病毒液,加入细胞维持液继续培养24 h;弃掉维持液,再用PBS洗3次,然后用预冷丙酮固定腔式载玻片上的细胞培养物;用PBS洗涤3次,加入500 µL 1∶100稀释的PRV单抗,37 ℃孵育1 h;用PBS洗涤3次后,同FITC标记的兔抗鼠IgG抗体37 ℃孵育30 min;最后用PBS洗涤3次,在荧光显微镜下观察。同时设置加入PBS的细胞培养物作阴性对照。
1.5.5 毒价测定 取5、10、15、20代病毒培养物,经10倍系列稀释,取100 μL接种到96 孔细胞培养板;每个稀释度设4个孔,观察细胞病变产生情况,按照Reed-Muench 法计算半数细胞感染量(TCID50)[4]。
1.5.6 家兔接种试验 将6只实验家兔随机分为2组(试验组4只、对照组2只);将分离的病毒稀释至103.0TCID50/0.1 mL,然后接种于实验组家兔后颈部皮下,接种剂量为0.2 mL/只,对照组同部位注射生理盐水,观察家兔接种后的临床症状。
2 结果与分析
2.1 病原学检测
2014年共检出39份PRV核酸阳性,总阳性率为4.3%(39/898),分离出10株PRV毒株;2015年共检出9份PRV核酸阳性,总阳性率为0.9%(9/965),共分离出2株PRV毒株。从检测结果(表2)可以看出,PRV核酸阳性检出率呈现大幅下降趋势。

表2 2014—2015年PR病原学检测结果
2.2 病毒分离鉴定
2.2.1 病毒细胞培养及荧光PCR鉴定 细胞接毒后12~48 h,出现细胞病变:细胞单层出现双折光性细胞,并逐渐增多,然后完全脱落,形成合胞体,其形态和大小各异(图1)。PRV荧光PCR试剂盒检测结果显示,2014年分离的10株和2015年分离的2株病毒呈典型的S型扩增曲线,证实为PRV。
2.2.2 病毒蚀斑计算 经过3 次筛选,在稀释倍数为10-6的细胞单层上可见较小的单个空斑;4个孔的空斑个数分别为5、3、4、6,共18 个。挑取单个空斑继续在BHK-21 细胞上传代,发现出现典型细胞病变的时间稳定在接种后16 h 左右(图2)。按沈强等[3]的方法计算0.1 mL 的空斑形成单位(PFU)为4.0×10-5。

图1 BHK-21细胞病变
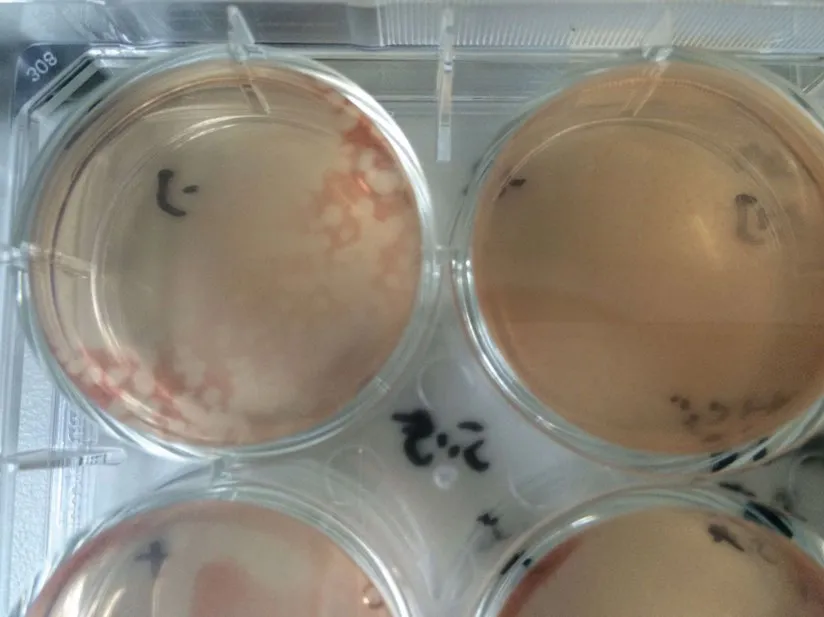
图2 病毒蚀班
2.2.3 BHK-21细胞间接免疫荧光抗体(IFA)鉴定 病料接种BHK-21细胞的IFA检测结果显示,细胞胞浆和胞核呈现明显的特异荧光(图3-A),证明病毒液接种细胞能与PRV单抗特异性结合,表明所分离的毒株为PRV,而未接种的BHK-21细胞未见绿色荧光(图3-B)。

图3 BHK-21细胞间接免疫荧光抗体(IFA)鉴定结果
2.2.4 病毒毒价测定 将分离到的1株病毒接种到BHK-21细胞,连续传代培养20 代,每隔5 代取样测定病毒滴度,发现滴度分别为10-4.8、10-5.0、10-5.3、10-5.6TCID50/0.1 mL,表明病毒分离初期毒价较低,经细胞传代,毒价有所提高,至第20 代,病毒滴度稳定在10-5.6TCID50/0.1 mL。
2.2.5 家兔接种试验 4只家兔接种病料稀释液24 h后,表现精神沉郁、发热、呼吸加快,并出现局部奇痒症状,用力撕咬接种点,引起局部脱毛、皮肤破损出血,严重者出现角弓反张,4~6 h后衰竭而亡(图5)。对照组家兔不表现临床症状。
3 讨论

图5 家兔接种试验
2014—2015年,上海市定点监测猪群中共检出48份PRV核酸阳性,总阳性率为2.6%(48/1 863),2015年的PRV核酸阳性率较2014年大幅下降。从本中心实验室2006年以来的检测数据看,2009年后PR在本市定点监测猪群中病原学阳性率直线上升,至2013年达到31.1%,2014年以后阳性率快速回落,2015年达到最低水平。分析其原因:一是前两年PRV变异株的流行对大多数养殖场造成了很大损失,养殖场普遍加强了PR免疫,对该病的防控意识进一步加强;二是上海市自2015年开始,开展了大规模的退养和整治措施,取缔了周边所有散养户和大部分中小规模养猪场,只保留了大型规模场和种猪场。
2014—2015年诊断中心检出29份PRV核酸阳性样品,占比60.42%(29/48),分析其原因可能与诊断中心的样品主要来源于病死猪有关。2015年的4份内脏阳性样品分别来源于4个规模猪场。经调查,这4家规模猪场未从2014年精液阳性种猪场引进猪只,不存在流行病学关联。上述情况表明,这4家规模猪场可能存在PRV野毒感染。
2014年检出的39份PRV核酸阳性样品中,有15份来自种公猪精液,2015年采集的78份精液中未检出PRV核酸阳性,表明种猪场通过加强PR净化和淘汰阳性种猪取得了良好的防控效果。携带PRV的种公猪基本不表现临床症状,但可通过引种和人工授精方式将疫病传给生产母猪,导致母猪发生流产、难产等繁殖障碍症状,会给养殖场带来严重的疫情威胁和经济损失[5]。因此,及时淘汰阳性种公猪显得尤为重要。通过检测,及时督促种猪场淘汰隐性带毒种公猪,是做好种公猪PR净化的关键,也可为种猪场PR净化方案的制定提供依据。
将采集的样品处理后接种BHK-21细胞增殖,通过观察特异性细胞病变,以及荧光PCR、IFA及动物接种试验,共分离鉴定出12株流行毒株,并对其中1株毒株进行了病毒毒价测定,获得了稳定的毒价,这为进行下一步的动物试验奠定了良好的基础。

