基于气相色谱-质谱联用技术的食管鳞癌细胞代谢组学分析
崔艳艳,张彦婷,张璐玉,王文杰,马珊珊,刘红涛,杨大伟,关方霞
1)郑州大学生命科学学院 郑州 450001 2)聊城市人民医院中原生物医学研究院 山东聊城 252002
食管鳞癌(esophageal squamous cell carcinoma,ESCC)是我国乃至世界范围内较为常见的消化系统恶性肿瘤之一,其恶性程度高、易转移、预后差[1]。由于ESCC早期无明显症状,并且缺乏有效的早期诊断方法,很多临床上确诊的ESCC患者已到中晚期,只能采取以手术为主、放化疗为辅的综合治疗,往往预后差、生存期短[2],因此寻找早期诊断的特异标志物及有效治疗靶点是提高ESCC治疗效果的主要途径。代谢组学是以小分子代谢物为研究对象,对组织、细胞及体液中所有代谢产物进行定性和定量分析[3]。肿瘤的产生是环境因素与遗传因素共同作用的结果,这些因素将导致与肿瘤相关的基因及蛋白质表达异常,同时也体现在代谢物水平的改变[4]。通过代谢组学揭示肿瘤细胞中整体代谢物的改变,发现和筛选基于代谢物的特征性生物标志物,将有助于揭示肿瘤发生发展的代谢机制,为早期诊断和发病机制的研究提供新的思路和理论依据[5]。随着代谢组学技术的不断发展,大量肿瘤代谢标志物[6]已被鉴定,如卵巢癌[7]、前列腺癌[8]、结直肠癌[9]等疾病,越来越多的标志性差异代谢产物被用于辅助临床诊断与治疗。本研究利用气相色谱-质谱(GC-MS)联用技术对人ESCC细胞及正常食管上皮细胞的代谢差异进行探究,应用多变量统计分析对代谢产物进行模式识别,筛选重要的差异代谢物,并结合代谢通路分析,揭示ESCC整体性代谢的改变。
1 材料与方法
1.1仪器、试剂及细胞①主要仪器和试剂:GC-MS仪7890-5975(美国安捷伦公司);真空浓缩仪(德国Labconco公司);甲氧基胺盐酸盐、吡啶、N-甲基-N-(三甲基硅基)三氟乙酰胺(MSTFA)均购自美国Sigma公司。②细胞株及培养基:人ESCC细胞株EC1、Eca109、TE1和正常食管上皮细胞Het-1A由郑州大学第一附属医院细胞生物学实验室保存;DMEM高糖培养基、标准胎牛血清、PBS购自以色列Biological Industries公司。
1.2细胞培养细胞在75 cm2的培养瓶中用含体积分数10%胎牛血清和双抗的培养基于37 ℃、体积分数5%CO2条件下培养,每种细胞培养4瓶,1瓶进行细胞计数,3瓶用于实验,当细胞融合度达到85%时进行后续实验。
1.3细胞样品制备弃细胞培养基,用PBS洗涤3次后将培养瓶放在冰上并加入4 mL体积分数为80%的冷甲醇,-80 ℃放置20 min后,于冰上用细胞推刮器刮下细胞,转移到2 mL离心管中。4 ℃、14 000 r/min离心5 min,取上清置于新的15 mL离心管中,细胞沉淀中加入500 μL冷甲醇,涡旋振荡1 min后继续在4 ℃、14 000 r/min条件下离心5 min,取上清和之前的上清混合在一起,均分成3管,每个细胞系均分装9个平行管,然后用真空离心仪离心浓缩。
1.4样品衍生在每个样品中加入50 μL 20 g/L的甲氧基胺盐酸盐溶液(溶解于吡啶),40 ℃振荡90 min。待其冷却到室温后,每个样品中加入50 μL MSTFA,40 ℃反应60 min。12 000 r/min离心10 min后,取上清液,转移到含有衬管的自动进样瓶中。
1.5GC-MS分析进样口温度:280 ℃;柱始温:70 ℃,保持3 min,再以5 ℃/min升温至300 ℃,保持5 min;载气:高纯氦,流速为1.2 mL/min;进样方式:5∶1进样;进样体积:1 μL。
电子轰击离子源:70 eV;传输线温度:280 ℃;溶剂延迟:4.8 min;离子源温度:230 ℃;四级杆温度:150 ℃;扫描范围:33~600 m/z。
1.6数据处理将GC-MS数据从Agilent MSD ChemStation导出为netCDF格式,采用自动质谱解卷积与识别系统(AMDIS)在批处理模式下对netCDF文件进行去卷积处理,AMDIS去卷积设置为:分辨率中等、灵敏度低、形状要求中等,元件宽度设为10。经过AMDIS处理后得到两种格式的数据:*.ELU和*.FLN。将*.ELU文件上传到SpectConnect(www.spectconnect.mit.edu,可以校正保留时间漂移和选择出现75%以上的代谢物),然后得到相对量、保留时间、积分峰和基峰4个数据集,用于统计分析。*.FLN文件用于搜索NIST质谱库(包括NIST 08、Wiley、Replib和Fiehn数据库),定性代谢物。多元统计分析和单变量统计分析所用软件为加拿大阿尔伯特大学开发的集质谱数据处理、多元统计分析和代谢途径分析为一体的MetaboAnalyst。
2 结果
2.1代谢谱分析EC1、Eca109、TE1和Het-1A细胞经过GC-MS联用技术检测分析后,获得典型的总离子流色谱图,见图1。共鉴定出103种化合物,包括各种氨基酸、糖类、脂类、类固醇类及尿素、磷酸等小分子代谢物。

A:Het-1A;B:EC1;C:Eca109;D:TE1
2.2主成分分析对4种细胞的代谢物进行主成分分析,得分图见图2。主成分1解释了总差异的36.8%,主成分2解释了总差异的19.0%;4株细胞在主成分分析得分图中得到了很好的区分。

图2 4种细胞代谢轮廓的主成分分析得分图
2.3差异代谢途径的筛选数据经过预处理后得到代谢途径差异图,见图3,颜色越深说明代谢差异性越显著,圆圈越大说明检测到该代谢途径的代谢产物越多。根据图3共筛选出9条ESCC细胞与正常食管上皮细胞的差异代谢途径,包括类固醇激素的生物合成,初级胆汁酸的生物合成,脂肪酸代谢,半乳糖代谢,赖氨酸降解,丙酮酸代谢,氨基酰基-tRNA生物合成,半胱氨酸和蛋氨酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢。共涉及氨基酸代谢、能量代谢及糖代谢,其中氨基酸代谢途径中检测到的差异性代谢物最多。
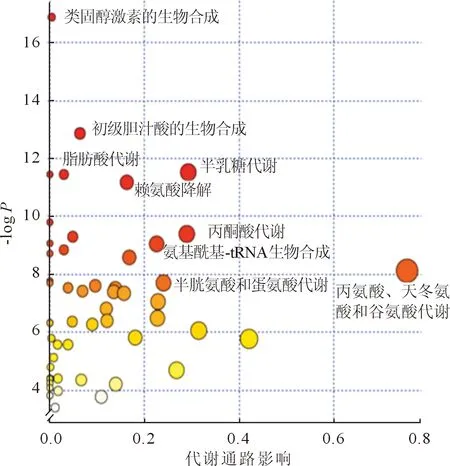
图3 ESCC细胞与Het-1A细胞差异代谢途径分析
2.4差异代谢物的筛选及其变化趋势分析ESCC细胞与Het-1A细胞的差异代谢物基本可以分为下面几类:氨基酸类物质,赖氨酸、苯丙氨酸、天冬酰胺、丙氨酸、谷氨酸、色氨酸、蛋氨酸、酪氨酸和缬氨酸等在ESCC细胞中上调;糖代谢物质,塔格糖在ESCC细胞中上调,葡萄糖下调;脂类物质,单棕榈酸酯和胆固醇在ESCC细胞中上调。
3 讨论
代谢组学通过考察生物体系受刺激或扰动前后的代谢物谱及其动态变化来研究生物体系的代谢网络。与基因组学、转录组学和蛋白质组学相比,代谢组学更接近于表型,能更直接、更准确地反映生物体的生理、病理状态[10]。肿瘤细胞为满足快速增殖的需求,必须改变细胞内的代谢模式来产生大量的能量和物质,因此肿瘤的发生发展过程中必然伴随着代谢改变,在当前肿瘤研究中,代谢组学的应用发挥着越来越重要的作用[11]。
本研究通过基于GC-MS的代谢组学分析了ESCC细胞与Het-1A细胞的代谢差异,结果表明差异代谢途径主要涉及氨基酸代谢、糖代谢及能量代谢,其中赖氨酸、苯丙氨酸、丙氨酸、谷氨酸、天冬酰胺、色氨酸、蛋氨酸、酪氨酸、缬氨酸、塔格糖、单棕榈酸酯及胆固醇等小分子代谢物在ESCC细胞中的含量均升高,葡萄糖含量减少。Wang等[12]同样发现在食管癌组织中缬氨酸和蛋氨酸含量升高,葡萄糖含量降低。Yang等[13]也发现在食管癌组织中丙氨酸和谷氨酸含量升高。本研究中作者发现ESCC细胞中氨基酸含量明显升高,这提示肿瘤细胞为实现快速增殖而摄取大量的氨基酸。而ESCC细胞中葡萄糖减少,说明常伴有糖代谢紊乱,可能是由于Warburg效应的存在,肿瘤细胞更多地消耗葡萄糖来维持自身的能量需求,是肿瘤细胞糖酵解增强的结果[14]。此外,ESCC细胞中胆固醇含量高于正常细胞,研究[15]表明,胆固醇代谢异常会引起各种疾病,其含量升高与某些恶性肿瘤的风险增加有关,且高胆固醇是肿瘤治疗的一个不良预后因素。
主成分分析得分图可以反映组间离散程度,图中每一个点代表一个样本,可以较直观地显示不同组别之间的整体差异。该研究结果显示,主成分1解释了总差异的36.8%,主成分2解释了总差异的19.0%。4株细胞在主成分分析得分图中得到了很好的区分,说明4株细胞在代谢上有明显的差异。
总之,肿瘤的发生发展往往伴随着代谢物的改变。本研究中所发现的这些差异代谢物为进一步理解肿瘤的病理机制及筛选早期诊断标志物提供了一定的理论依据。当然,这些结果还需大量临床样本和进一步的细胞及动物实验进行验证,还需结合患者血清、血浆、尿液或组织的代谢组学分析,以获得更加完整全面的代谢物图谱。

