重组人MG53蛋白激活Akt/GSK-3β通路降低LPS诱导的hUC-MSCs氧化损伤
王亚苹,张振坤,李 喆,刘腾飞,黄团结,周馨魁, 麻建杰,关方霞,马珊珊
1)郑州大学生命科学学院 郑州450001 2)美国俄亥俄州立大学戴维斯心肺研究所 哥伦布市 43210
人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)是一种常见的种子细胞,为创伤性脑损伤(traumatic brain injury,TBI)等难治性疾病的治疗带来希望。但是,TBI后由于组织缺血和炎症反应会导致细胞内活性氧(reactive oxygen species,ROS)水平上升,继而引起组织病变和细胞死亡,抑制外源干细胞的迁移和存活,降低了干细胞的治疗效果。MG53蛋白(mitsugumin53 protein)是心肌、骨骼肌特异性蛋白,主要存在于细胞浆和细胞膜内侧。在细胞膜结构损伤后,MG53 蛋白可在胞外钙的作用下由胞浆转移到胞膜破裂位点,修复受损细胞[1]。外源性给予重组人MG53蛋白,还可修复非肌细胞的膜损伤,对多种细胞和组织损伤具有保护作用[2-4]。研究[5]证明,MG53蛋白能够和磷脂酰肌醇3-激酶(phosphatidylinositol 3 kinase,PI3K)的p85亚基结合,使其下游的Akt和GSK-3β的磷酸化增加,激活RISK信号通路,从而减轻心肌梗死的严重程度。我们的前期研究[6]发现重组人MG53蛋白对H2O2诱导的hUC-MSCs氧化损伤具有保护作用。脂多糖(lipopolysaccharide,LPS)能够引起多种细胞氧化损伤。本研究利用LPS诱导hUC-MSCs氧化损伤细胞模型,评价重组人MG53对hUC-MSCs氧化损伤的保护作用,探讨可能的分子机制。
1 材料与方法
1.1材料hUC-MSCs由课题组前期培养冻存。重组人MG53蛋白(相对分子质量53 000,干粉)由美国俄亥俄州立大学麻建杰教授赠送,LPS购于美国Sigma公司,标准胎牛血清(FBS)、DMEM/F-12(HAM)1∶1培养基和磷酸盐缓冲液(PBS)购于以色列BI公司,CCK-8试剂盒购于苏州宇恒生物科技有限公司,AO-EB试剂盒和JC-1 线粒体膜电位荧光探针购于北京索莱宝公司,ROS检测试剂盒购于碧云天公司,丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)酶标法测定试剂盒购于南京建成生物工程研究所,β-actin兔多克隆抗体购于武汉三鹰生物有限公司,磷酸化(p-)Akt、Akt、p-GSK-3β和GSK-3β兔多克隆抗体购于万类生物有限公司。
1.2hUC-MSCs氧化损伤模型的建立第3代hUC-MSCs 培养至对数生长期后,用胰蛋白酶消化,接种于96孔板,每孔加入100 μL(密度为2.5×103个/mL)细胞悬液,于37 ℃、体积分数5%CO2培养箱内培养。16~18 h后,待细胞融合度达60%,弃去原培养液,PBS清洗2次,加入完全培养基配制的不同质量浓度的LPS(0.5、1.0、10.0、25.0、50.0、100.0、200.0 mg/L),每个浓度组设3个复孔,继续在37 ℃、体积分数5% CO2、饱和湿度的培养箱中培养;分别于24、48和72 h后,弃培养液,每孔加入100 μL含体积分数10% CCK-8溶液的无血清培养基,37 ℃继续孵育2 h,酶标仪测定450 nm波长处的吸光度(A)。以不加LPS处理的细胞为对照。空白孔只加含体积分数10%CCK-8的培养基。存活率=[(A实验孔-A空白孔)/(A阴性对照孔-A空白孔)]×100%。实验重复3次。根据实验结果,后续实验条件设定为200 mg/L LPS处理hUC-MSCs 48 h。
1.3CCK-8法测定细胞活力取对数生长期的hUC-MSCs接种于96孔板。实验设4组,分别为CON组(不处理)、LPS组(加入200 mg/L LPS)、MG53组(加入30 mg/L重组人MG53蛋白)和LPS+MG53组(同时加入重组人MG53蛋白和LPS),每组设3个复孔。处理48 h后CCK-8法测定450 nm波长处的A,计算细胞存活率。实验重复3次。
1.4细胞凋亡检测取对数生长期的hUC-MSCs 接种于6孔板,按1.3分组处理48 h后,弃去原培养基,PBS洗去残余培养基和未贴壁细胞,加入1 mL PBS。将AO溶液和EB溶液按1∶1混合成工作液(现用现配)。每孔添加20 μL工作液,轻轻摇匀,室温放置5 min后,在荧光显微镜下观察、拍照。细胞凋亡率为红绿荧光的比值。实验重复3次。
1.5线粒体膜电位检测取对数生长期的hUC-MSCs 接种于6孔板,按1.3分组处理48 h后,弃去培养基,PBS清洗2次,将细胞与5 μmol/L JC-1在37 ℃下孵育20 min,弃上清,然后用JC-1染色缓冲液洗涤2次,洗去未反应的探针,每孔加入2 mL细胞培养基,30 min内于荧光显微镜下观察和拍照。荧光强度使用Image J软件分析。用绿红荧光的比值来衡量线粒体去极化的比例,代表线粒体膜电位。实验重复3次。
1.6细胞内ROS水平检测取对数生长期的hUC-MSCs 接种于6孔板,按1.3分组处理48 h后,收集细胞,用以无血清培养液按1∶1 000稀释的DCFH-DA悬浮细胞,置于细胞培养箱内孵育20 min。期间每隔3 min上下颠倒混匀一次,使探针和细胞充分接触。装载完成后用无血清培养液洗涤细胞3次,充分去除多余的DCFH-DA。30 min后,设置488 nm激发波长,525 nm发射波长,使用流式细胞仪检测荧光强度,代表ROS水平。实验重复3次。
1.7细胞内MDA含量、SOD活性和CAT活性测定取对数生长期的hUC-MSCs接种于96孔板,按1.3分组处理48 h后,收集细胞并计数,调整细胞密度为1×106个/mL,超声波细胞破碎仪破碎细胞,用微量分光光度计测定蛋白浓度,按照MDA、SOD和CAT测定试剂盒的说明书操作。实验重复3次。
1.8Western blot法检测Akt/GSK-3β信号通路蛋白的表达取对数生长期的hUC-MSCs 接种于6孔板,按1.3分组处理48 h后,收集细胞提取蛋白,利用BCA试剂盒测定蛋白浓度后,进行SDS-PAGE电泳,随后将蛋白转移到PVDF膜上,然后在室温下用80 g/L(TBST)脱脂乳封闭2 h,加一抗 (β-actin兔多克隆抗体按1∶2 000稀释,p-Akt、Akt、p-GSK-3β和GSK-3β兔多克隆抗体按1∶500稀释),4 ℃孵育过夜,TBST洗膜3次,加二抗(山羊抗兔HRP按1∶2 000稀释)室温孵育2 h,TBST洗膜3次,化学发光法显色,暗室曝光,所得条带用Image J软件进行灰度分析。目的蛋白表达水平=目的蛋白条带灰度值/内参条带灰度值。实验重复3次。
1.9统计学处理应用SPSS 19.0处理数据。采用3×7析因设计的方差分析比较不同质量浓度LPS作用不同时间后hUC-MSCs存活率的差异;4组细胞存活率、凋亡率、线粒体膜电位、ROS水平、MDA含量、SOD活性和CAT活性以及相关蛋白表达的比较采用2×2析因设计的方差分析;检验水准α=0.05。
2 结果
2.1hUC-MSCs氧化损伤模型的建立结果见表1。LPS对hUC-MSCs的损伤和抑制作用具有浓度和时间依赖性。200 mg/L LPS处理48 h后,hUC-MSCs存活率接近50%,故选用此实验条件用于后续实验。

表1 不同质量浓度LPS对hUC-MSCs存活率的影响(n=3) %
F时间=279.770,F浓度=360.018,F交互=22.900,P均<0.001
2.2重组人MG53蛋白对LPS诱导的 hUC-MSCs细胞活力和凋亡的影响结果见表2。与LPS组相比,LPS+MG53组细胞存活率升高,凋亡率下降。
2.3重组人MG53蛋白对LPS诱导的 hUC-MSCs线粒体膜电位变化的影响由图1和表3可知,与CON组相比,LPS组线粒体膜电位升高,而LPS+MG53组较LPS组降低。
2.4重组人MG53蛋白对LPS诱导的hUC-MSCs内ROS水平、MDA含量、SOD和CAT活性的影响结果见表3,由表3可知,与CON组相比,LPS组hUC-MSCs内ROS和MDA含量增加,SOD和CAT活性降低。然而,重组人MG53蛋白处理较好地逆转了LPS诱导的这些变化。
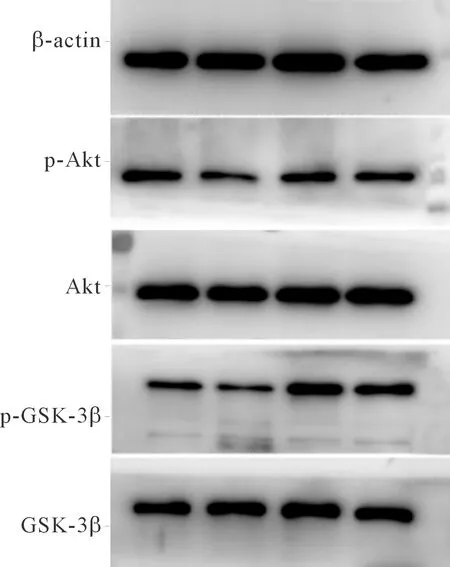
2.5重组人MG53蛋白对LPS诱导的hUC-MSCs Akt/GSK-3β信号通路的影响由图2和表4可知,LPS抑制p-Akt和p-GSK-3β的表达,而LPS+MG53组 p-Akt 和p-GSK-3β表达增加,但是Akt和GSK-3β的表达没有明显变化。

表2 4组hUC-MSCs存活率、凋亡率的比较 %

组别线粒体膜电位ROS水平MDA含量/(nmol/mg)SOD活性/(U/mg)CAT活性/( U/mg)CON组7.60±0.2573 075.77±2 842.030.52±0.16610.39±18.67637.34±4.18LPS组42.95±2.57125 393.30±5 410.000.95±0.01284.09±9.86377.18±11.49MG53组7.68±0.5561 488.07±3 341.130.54±0.09644.60±27.55727.50±4.99LPS+MG53组19.75±3.6484 088.23±3 694.470.65±0.01415.68±39.45570.25±20.06FLPS(P)403.836(<0.001)301.615(<0.001)31.172(<0.001)351.079(<0.001)1 001.982(<0.001) FMG53(P)95.998(<0.001)150.341(<0.001)8.841(0.018)31.308(<0.001)461.338(<0.001)F交互(P)97.343(<0.001)47.457(<0.001)10.722(0.011)10.798(0.011)60.912(<0.001)
1~4:分别为CON组、LPS组、MG53组、LPS+MG53组

表4 4组hUC-MSCs Akt/GSK-3β信号通路蛋白表达的比较(n=3)
3 讨论
重组人MG53蛋白在组织损伤和细胞膜损伤修复中发挥关键性的作用,应用于神经退行性疾病、缺血再灌注损伤、心肌损伤和骨骼肌损伤中均显示出损伤修复的作用[7-8]。本研究建立了LPS诱导hUC-MSCs氧化损伤的细胞模型,与LPS诱导骨髓干细胞和神经干细胞损伤表现[9-11]一致。本研究发现,重组人MG53蛋白显著改善了受损的hUC-MSCs的存活,并抑制了凋亡。此外,氧化应激诱导的细胞凋亡与线粒体途径功能障碍有关[12]。我们发现LPS诱导hUC-MSCs损伤后,细胞内线粒体膜电位降低,而重组人MG53蛋白则可改善这种情况。ROS为氧化应激反应的关键因素,本课题组前期实验[13]证明重组人MG53蛋白对LPS处理后的HT22细胞发挥了抗氧化作用,降低了细胞内ROS水平。本实验结果显示重组人MG53蛋白同样可逆转LPS刺激hUC-MSCs产生的ROS水平升高。在正常情况下,氧自由基的产生和消除由SOD、CAT和MDA等抗氧化物来维持平衡[14]。本实验结果显示重组人MG53蛋白升高了受损细胞中SOD和CAT活性,降低了MDA含量,减轻了LPS诱导的细胞损伤。
PI3K/Akt信号通路是非常重要的凋亡信号通路。报道[5]显示MG53通过与PI3K的p85亚基相结合来调控PI3K/Akt信号通路,进而对缺血再灌注的损伤心肌发挥保护作用。本实验结果显示,LPS诱导损伤的hUC-MSCs中p-Akt水平下降,其下游的信号分子p-GSK-3β水平也降低;重组人MG53蛋白干预治疗后,GSK-3β与Akt磷酸化水平在一定程度上得到恢复。
综上所述,重组人MG53蛋白可能通过激活Akt/GSK-3β信号通路,保护hUC-MSCs免受LPS刺激导致的氧化损伤。重组人MG53蛋白处理可能是一种促进植入脐带干细胞进行组织修复的有效方法。

