TCDD对小鼠腭突间充质细胞增殖和凋亡的影响
刘蔓蔓,陶宇昌,刘小转,高 湛,张秀丽,谭雪梅,余凯伦,陈 瑶,余增丽
1)郑州大学公共卫生学院营养与食品卫生学教研室 郑州 450001 2)河南省人民医院临床单细胞生物医学中心 郑州 450003 3)郑州大学第五附属医院妇产科 郑州 450052 4)郑州大学第一附属医院营养科 郑州 450052
腭裂是人类最常见的颅颌面部出生缺陷之一,遗传和环境因素是其主要的致畸因素[1]。近年来研究[2]表明,腭裂的发生可能与母亲怀孕期间胚胎所处的发育环境有关。2,3,7,8-四氯二苯并对二噁英(2, 3,7,8-tetrachlorodibenzo-p-dioxin,TCDD)是多氯联苯及其类似物中毒性最大的污染物之一[3],它可以通过食物链的富集轻易积聚在人体内。研究[4-5]表明TCDD是腭裂的强致畸剂,暴露于TCDD的胎鼠已经显示出腭裂和肾积水,但唇部并无明显变化。
腭的发育过程可简单概括为3个重要阶段:形成与垂直生长期、上抬期和接触融合期。任何直接干扰腭突生长、升高或融合的遗传或环境因素,以及破坏周围颅面结构(例如下颌骨和舌头)生长或形态发生的因素都可以引起腭裂[6]。研究[7]发现TCDD诱导的腭裂是由于腭突发育不良造成的,腭突尺寸太小而不能相互接触被认为是引起腭裂最常见的原因。腭突间充质(embryonic palatal mesenchymal,EPM)细胞是构成腭部的主体细胞,其正常增殖对于腭器官的发育至关重要。本项研究观察了TCDD暴露对胎鼠腭突生长,以及对体外EPM细胞生长的影响,探索TCDD诱发腭裂的机制,为预防腭裂的发生提供思路。
1 材料与方法
1.1主要试剂及仪器低速、高速台式离心机(德国Eppendorf公司),水平摇床(沃德生物医学仪器公司),JY-SCZ2 型 SDS-PAGE 蛋白电泳仪(北京六一仪器厂),多功能酶标仪(上海美谷分子仪器有限公司)。5-溴脱氧尿嘧啶核苷(Brdu)、TCDD和二甲基亚砜(美国Sigma公司),非转基因玉米油(山东三星产业科技有限公司),DMEM/F12细胞培养基(美国Hyclone公司),胎牛血清(杭州四季青有限公司),中性蛋白酶(瑞士罗氏公司)。Trizol(美国Life Technologies公司),UltraSYBR Mixture(北京康为有限公司),反转录试剂盒(大连宝生物工程有限公司),ABI Fast 7500实时荧光定量PCR仪(美国应用生物系统公司)。ECL 高效化学发光试剂盒(美国Genview公司),辣根过氧化物酶标记的山羊抗兔IgG、山羊抗小鼠IgG和小鼠抗β-肌动蛋白单克隆抗体(北京鼎国昌盛生物技术有限责任公司),小鼠抗Bax、Caspase3单克隆抗体和兔抗鼠PCNA抗体(武汉三鹰生物技术有限公司)。
1.2孕鼠的制备SPF级C57BL/6N小鼠,6~8周龄,购于北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2016-0006],置于检疫室观察1周无异常后,移入屏障环境饲养2周。于20:00按雌雄3∶1比例合笼,次日晨8:00检查雌鼠,查到阴栓者即为妊娠第0天(GD0)。
1.3胎鼠头部形态学观察于GD10,将30只孕鼠随机分为TCDD组和对照组,每组15只, TCDD组孕鼠于GD10 8:00以64 μg/kg灌胃TCDD,对照组给予等量玉米油。两组孕鼠分别于GD13、GD14和GD15 10:00用颈椎脱臼法处死5只,剖腹取出胎鼠头部,多聚甲醛固定48 h后,经梯度乙醇脱水,常规方法加工成石蜡包埋的5 μm冠状位连续切片,行HE染色,于光学显微镜下观察。
1.4TCDD对小鼠EPM细胞增殖的影响
1.4.1 小鼠EPM细胞分组 选取GD13未灌胃孕鼠,颈椎脱臼法处死,置体积分数75%乙醇的无菌缸中浸泡5 min,剖腹取出孕鼠子宫,PBS清洗以除去血污。将胎鼠小心从子宫中剥离,切取胎头用PBS清洗。从胎鼠口裂处沿口腔水平方向切开,去除舌体和下颚,使双侧腭板充分暴露。弯头镊沿腭板底部轻轻夹取两侧腭突,迅速放入PBS。将离体腭突放入中性胰蛋白酶消化液的无菌管中37 ℃恒温水浴15 min,待上皮片和间充质分离后,吸去上皮碎片,加入2.5 g/L胰蛋白酶消化液反复吹打直至呈单细胞悬液。加入含体积分数10%胎牛血清的DMEM/F-12 培养基终止消化,PBS洗涤2次,加入含体积分数10%胎牛血清的DMEM/F12培养基重悬细胞,并转移至培养瓶和6孔板,置于细胞培养箱(体积分数5%CO2、37 ℃饱和湿度)中连续培养。取第3代EPM细胞,调整细胞密度为5×103个/mL,按100 μL/孔接种到96孔板,分别加入0.0(对照)、0.1、1.0、10.0 nmol/L TCDD进行染毒,每个剂量设置6个平行孔,72 h后进行指标检测。以下实验均重复3次。
1.4.2 细胞增殖抑制率的检测 以20 μL/孔加入5 μg/L的MTT溶液继续培养4 h。吸去培养液,以150 μL/孔加入DMSO溶液,置于恒温箱中振荡30 min,用酶标仪在490 nm波长下检测吸光度(A)值,计算细胞增殖抑制率。细胞增殖抑制率=1-(实验组A-调零孔A)/(对照A-调零孔A)×100%。
1.4.3 Brdu阳性率的检测 在培养结束前,将细胞与Brdu(10 μmol/L)在黑暗中孵育6 h。培养结束后,用预冷的40 g/L多聚甲醛固定15 min,PBS洗涤细胞爬片,用含Triton-100的PBS透化细胞,加体积分数0.3%H2O2室温孵育10 min,正常羊血清孵育20 min,加BrdU抗体(1∶20稀释),37 ℃孵育2 h,加生物素化二抗,37 ℃孵育30 min,滴加DAPI染液避光室温封闭10 min,封片,于荧光显微镜下观察。细胞核红色为阳性细胞。随机选取10个非重叠视野(200×)计数,计算 BrdU阳性细胞占总细胞数的比例。
1.4.4 细胞中PCNA、Bax和Caspase-3 mRNA及蛋白的检测 ①分别收集4组细胞,Trizol法提取总RNA,测定浓度后反转录得cDNA,于荧光定量PCR仪中进行PCR。PCNA上游引物序列:5’-TTTGAG GCACGCCTGATCC-3’,下游:5’-GGAGACGTGAGACGAGTCCAT-3’;Bax上游引物序列:5’-CAGGAT GCGTCCACCAAGAA-3’,下游:5’-GTTGAAGTTGC CATCAGCAAACA-3’;Caspase-3上游引物序列:5’- CTGCCGGAGTCTGACTGGAA-3’,下游: 5’-ATCAGTCCCACTGTCTGTCTCAATG-3’;内参β-actin上游引物序列:5’-GTTGAAGTTGCCATCAGCAAACA-3’;下游:5’-CATCTCTTGCTCGAAGTCCA-3’。采用2-ΔΔCt法计算目的基因mRNA相对表达量。②常规法提取细胞总蛋白,BCA法检测蛋白浓度。蛋白100 ℃变性后,取40 μg进行SDS-PAGE电泳,200 V转膜1.5 h后,用50 g/L脱脂牛奶37 ℃封闭40 min。TBST洗涤3次,加入稀释的一抗(稀释度1∶2 500)于4 ℃孵育过夜。TBST洗涤3次,加入二抗,37 ℃孵育2 h。TBST洗涤3次,ECL发光。采用Image J软件分析图像,计算目的蛋白与 β-actin条带灰度值的比值,表示目的蛋白表达水平。
1.5统计学处理采用SPSS 17.0进行分析,各组细胞增殖抑制率,Brdu阳性率,PCNA、Bax、Caspase-3 mRNA和蛋白表达的比较采用单因素方差分析,两两比较采用LSD-t检验,检验水准α=0.05。
2 结果
2.1胎鼠头部组织学表现见图1。GD13,对照组和TCDD组的腭突沿着舌体两侧垂直生长。GD14,对照组舌体位置开始下降,双侧腭突抬升到舌体上方,并向中线水平生长;TCDD组双侧腭突虽能抬升到舌体上方,但没有相互接触,发育迟缓,留下相对较大的缝隙。GD15,与对照组形成完整的次级腭相比,TCDD组腭突仍然不能融合,证实腭裂表型的发生。

A、C、E:分别为对照组GD13、GD14、GD15;B、D、F:分别为TCDD组GD13、GD14、GD15;PS:腭板;T:舌体;N:鼻
图1两组胎鼠的腭发育(HE, ×40)
2.24组小鼠EPM细胞增殖状况的比较见图2、表1。随着TCDD作用浓度的增加,小鼠EPM细胞增殖抑制率逐渐升高,Brdu阳性率逐渐降低。

A、B、C、D:分别为0.0、0.1、1.0、10.0 nmol/L TCDD组
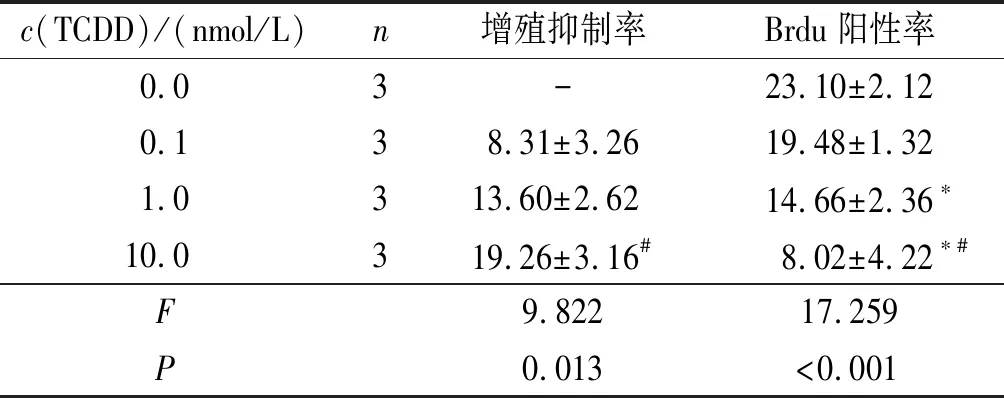
表1 4组小鼠EPM细胞增殖抑制率和Brdu阳性率的比较 %
*:与0.0 nmol/L组比较,P<0.05; #: 与0.1 nmol/L组比较,P<0.05
2.34组小鼠EPM细胞中PCNA、Bax和Caspase-3mRNA和蛋白表达的比较见图3和表2、3。随着TCDD作用浓度的增加,小鼠MEPM细胞中PCNA mRNA和蛋白表达降低,Bax、Caspase-3 mRNA和蛋白表达增加(P<0.05)。

1、2、3、4:分别为0.0、0.1、1.0、10.0 nmol/L TCDD组
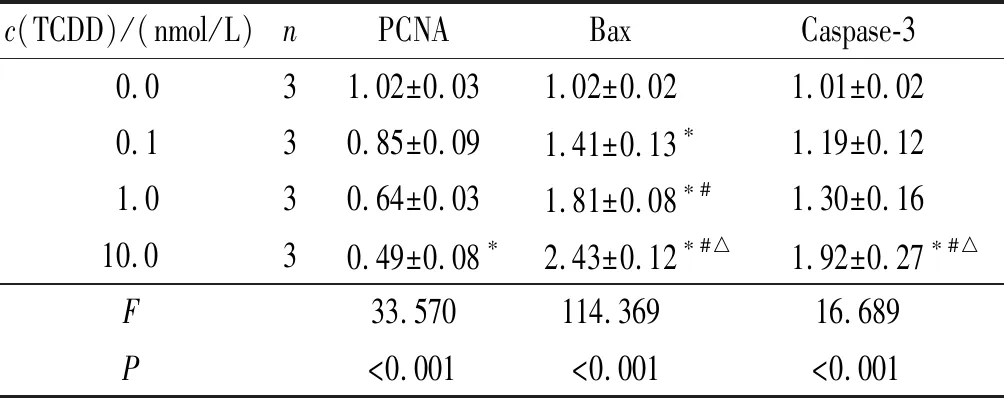
c(TCDD)/(nmol/L)nPCNABaxCaspase-30.031.02±0.03 1.02±0.021.01±0.020.130.85±0.091.41±0.13∗1.19±0.121.030.64±0.031.81±0.08∗#1.30±0.1610.030.49±0.08∗2.43±0.12∗#△1.92±0.27∗#△F33.570114.36916.689P<0.001<0.001<0.001
*:与0.0 nmol/L组比较,P<0.05;#:与0.1 nmol/L组比较,P<0.05;△:与1.0 nmol/L组比较,P<0.05

表3 4组小鼠EPM细胞增殖和凋亡相关蛋白的表达
*:与0.0 nmol/L组比较,P<0.05;#:与0.1 nmol/L组比较,P<0.05;△:与1.0 nmol/L组比较,P<0.05
3 讨论
哺乳动物腭的发育是由一系列复杂过程构成的,其中间充质细胞的生长是一个至关重要的过程。在腭发育过程中,间充质细胞的正常增殖受到任何外源性致畸因子的影响,都将引起腭的异常发育,最终导致腭裂的发生[8]。TCDD是一种潜在的环境毒物和致癌物质,TCDD暴露可能导致各种癌症、发育缺陷、免疫异常、造血功能障碍、神经细胞损伤、生殖和内分泌失调等[9-10]。 TCDD可通过调节细胞增殖、分化和细胞外软骨形成来干扰胚胎发育[11]。已经证实[12-13]TCDD能有效诱导小鼠腭裂的发生。一些研究[7,14]表明,TCDD不会改变中嵴上皮细胞分化,但会在初次接触前抑制腭突的发育和延迟腭突的抬升。还有研究[15]发现,EPM细胞的生长异常与腭发育早期腭裂的形成相关。本研究发现, TCDD组GD14~GD15胎鼠双侧腭突未能相互接触和融合。MTT比色法常用于检测细胞存活和生长,而Brdu是反映细胞增殖及跟踪监测增殖细胞的理想指标,对细胞动力学的研究具有重要意义。本研究结合两种方法来检测小鼠EPM细胞增殖情况,结果显示TCDD能有效抑制小鼠EPM细胞增殖,显著降低细胞增殖活力。这与TCDD单独暴露后抑制人乳腺癌MCF-7和卵巢癌细胞增殖的结果一致[10,16]。
增殖和凋亡过程会涉及一系列基因的激活、表达和调控。在人类滋养层样JAR细胞中,TCDD介导的细胞凋亡可能归因于线粒体功能障碍[17]。PCNA与细胞DNA合成密切相关,是异常细胞增殖的关键蛋白[18]。最近的证据[19]表明,PCNA是许多重要细胞过程的核心,例如DNA复制、DNA的损伤修复、染色质结构维持、染色体分离和细胞周期进展等。Bcl-2家族蛋白构成了不可逆细胞损伤上游的关键检查点,被认为是细胞凋亡的关键调节因子[20]。作为Bcl-2家族的成员,Bax过表达可抑制Bcl-2的功能并促进细胞凋亡[20]。在线粒体途径中,促凋亡蛋白被激活后,作为凋亡主要执行环节的Caspase蛋白酶发生级联反应,Caspase-3位于凋亡级联反应的下游,其激活标志着凋亡进入不可逆阶段[21]。对人宫颈癌HeLa细胞的实验[22]表明,细胞凋亡伴随着Bax的上调,线粒体细胞色素的释放,Caspase-9和Caspase-3的激活。本实验结果显示,TCDD可以降低小鼠EPM细胞中PCNA的表达,提高Bax、Caspase-3的表达;提示TCDD诱导的EPM细胞增殖-凋亡失衡可能与线粒体凋亡途径的激活有关。
综上所述,本研究表明TCDD可能是通过抑制EPM细胞的增殖,促进其凋亡诱发腭裂。

