重症肌无力患者胸腺组织中差异表达信号通路分子的筛查
宋 歌, 刘萍萍,李 静,李倩如,高 峰,张清勇,崔新征,杜 英
1)郑州大学基础医学院免疫学系 郑州 450001 2)河南省红十字血液中心 郑州 450008 3)郑州大学医药科学研究院 郑州 450052 4)河南省人民医院重症肌无力综合诊疗中心 郑州 450003
重症肌无力(myasthenia gravis,MG)是由针对乙酰胆碱受体(acetylcholine receptor,AChR)的高亲和力IgG抗体(AChR-Ab)介导的自身免疫性疾病[1],骨骼肌收缩无力为其主要症状。已证实胸腺是MG患者产生AChR-Ab的主要部位,MG患者胸腺不仅存在T细胞亚群比例异常,还存在异位生发中心,且能从其中分离出产生自身抗体的B细胞,切除胸腺能使病情得到缓解[2-3]。这些证据都提示胸腺与MG的发生、发展密切相关,但其机制迄今仍不清楚。研究[4]显示T细胞与胸腺发育分化中一系列的信号转导过程密切相关[5-6],而且多种信号通路分子与T细胞亚群形成相关[7]。目前在疾病状态下T细胞在胸腺分化异常中的机制尚不清楚。为进一步探讨MG的发病机制、揭示MG胸腺组织中影响免疫细胞分化的关键分子,本研究应用人信号转导通路发现者基因芯片筛查MG胸腺差异表达分子,并分析信号通路在MG患者T细胞异常分化中的作用,为进一步研究指明方向。
1 对象与方法
1.1研究对象临床确诊的MG患者3例(来自河南省人民医院重症肌无力综合诊疗中心),自身抗体AChR-Ab水平均高于正常,年龄12~17岁,男1例,女2例,患者均接受胸腺切除术,胸腺组织病理学分型为胸腺增生型对照组3例,男1例,女2例,年龄6~20岁,均为非自身免疫性心脏病患者(来自郑州大学第二附属医院胸外科),在接受心脏手术时因暴露手术视野切除部分胸腺组织。研究取材经郑州大学医学伦理委员会批准和患者知情同意。
1.2主要试剂Trizol试剂和cDNA合成反转录酶为Invitrogen公司产品,RNA纯化试剂盒为Qiagen公司产品,RNase Inhibitor为Epicentre公司产品,2×SuperArray PCR master mix (Cat. No. PA-112)和人信号转导通路发现者基因芯片为SABiosciences公司产品。Tris-HCl、EDTA、琼脂糖等购自华美生物工程公司,氯仿、异丙醇、乙醇、乙酸钠、甲醛等购自上海化学试剂有限公司。
1.3胸腺组织RNA抽提、纯化和cDNA合成每例均取50 mg胸腺组织,加入1 mL Trizol试剂研磨制成匀浆。常规提取RNA,经乙醇清洗、干燥,用不含RNA酶的水溶解。按照产品说明书将RNA溶液过柱(RNeasy MinElute Spin Column)、洗脱,获得纯化RNA,并检测RNA质量和纯度。取1.5 μg RNA,加入500 mg/L oligo(dT)1 μL,10 nmol/L dNTPs Mix 1 μL,加灭菌水至13 μL,混匀,置65 ℃ 5 min,冰上1 min,离心后依次加入5×First-Strand Buffer 4 μL、0.1 mol/L DTT 1 μL、RNase Inhibitor 1 μL、SuperScript Ⅲ RT 1 μL,混匀,50 ℃温育60 min,70 ℃ 15 min使酶失活。每20 μL cDNA加91 μL灭菌水混匀,-20 ℃保存。
1.4胸腺组织信号通路差异表达基因的检测分别取2组已稀释的cDNA 102 μL,加入2× SuperArray PCR master mix 550 μL,ddH2O 448 μL。取10 μL混合液加至人信号转导通路发现者基因芯片(表1),加盖密封,置于实时定量PCR仪进行PCR反应。95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,扩增40个循环。收集荧光,进行溶解曲线分析。采用2-ΔΔCt法计算目的基因的表达水平。

表1 人信号转导通路发现者基因芯片所含信号通路及基因
1.5qRT-PCR验证实验为进一步证实芯片的检测结果,针对FOSL1、SOCS3、CCL5基因进行qRT-PCR。取留存的胸腺组织提取RNA,经qRT-PCR分析,结果与芯片结果进行比对。所用引物序列如下,SOCS3:5’-CCCCAGAAGAGCCTATTACAT-3’,5’-TCCAGGAACTCCCGAGTG-3’;FOSL1: 5’-CTGCTGCTACTCTTGCGATG-3’,5’-TGACCACACACCCTCCCTAACT-3’; CCL5:5’-CCATATTCCTCGGACACCAC-3’,5’-GGTGACAAAGACGACTGCTG-3’。按照SYBR Premix Ex TaqTM(TaKaRa公司)产品说明书进行操作。同上计算目的基因表达水平。
1.6统计学处理采用SPSS 21.0处理数据。采用两独立样本t检验比较2组基因表达的差异,检验水准α=0.05。
2 结果
2.1RNA质量鉴定对照组和MG组胸腺组织总RNA经变性电泳,所有样本均显示出28S、18S和5S核糖体RNA条带,并可见弥散的mRNA,说明所提RNA样本符合后续实验要求。
2.2MG胸腺组织中信号通路差异基因的筛选芯片检测结果显示,与对照组比较,MG组18个基因表达升高,4个表达降低,见表2。

表2 MG组与对照组胸腺组织差异表达基因的表达水平
2.3验证结果见表3。MG组胸腺组织SOCS3、FOSL1的表达高于对照组,而两组CCL5的表达差异无统计学意义,与芯片结果基本一致。
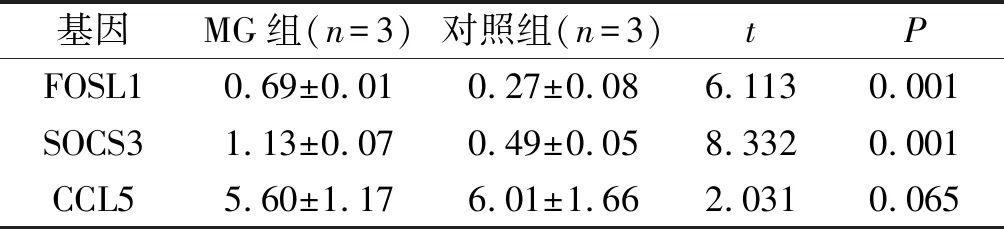
表3 SOCS3、FOSL1和CCL5mRNA表达的qRT-PCR验证结果
3 讨论
信号转导通路是决定T细胞发育、分化成熟和功能的关键因素。本研究对MG患者胸腺组织信号转导通路进行基因芯片检测,发现20多种差异表达的信号分子,涉及Notch、WNT、JAK/STAT、NF-κB、TGF-β等多条信号通路。文献[8]显示,细胞因子信号转导抑制分子SOCS1和SOCS3是早期胸腺细胞发育的关键调节因子,其缺乏会干扰胸腺发育。缺乏干扰素调节因子1(IRF1)的小鼠表现为胸腺和外周淋巴器官中成熟CD8+T细胞数量减少,说明IRF1在CD8+T细胞分化中起关键作用[9]。HES1是转录因子发状分裂相关增强子中的一个成员,是Notch信号通路中影响T细胞分化的关键分子[10]。WNT通路中FOS样抗原1(FOS-like antigen 1,FOSL1)的作用是与Jun蛋白形成二聚体,组成激活蛋白1,通过激活蛋白1与DNA结合,参与细胞的增殖和分化,抑制细胞凋亡[11]。上皮膜蛋白1(epithelial membrane protein 1,EMP1)、生长阻滞和DNA损伤诱生蛋白45B(growth arrest and DNA-damage-inducible protein 45β,GADD45B)是TGF-β信号通路分子。有报道[12]显示EMP1与细胞增殖、转化、恶化相关,也有报道[13]EMP1抑制细胞增殖和促进凋亡,这些结果的不一致提示EMP1在不同细胞中可能以不同的方式发挥作用。GADD45B是抑制细胞凋亡的基因, 主要通过调控p53和JNK发挥作用[14];GADD45B还是TGF-β的下游基因,即TGF-β通过调控GADD45B而抑制细胞生长及促进凋亡[15]。阻断GADD45B表达,TGF-β对M1细胞的促凋亡作用降低[16]。另外,在T细胞中,GADD45B基因可由TCR或炎症信号快速诱导产生,缺乏GADD45B的CD4+T细胞对T细胞受体刺激或炎症细胞因子的反应性降低,产生细胞因子的能力也降低[17]。Castellani等[18]发现,ADM及其共受体蛋白RAMP2存在于新生儿胸腺上皮细胞(thymic epithelial cells, TECs)内,并通过动物实验证实ADM在大鼠TECs中通过与细胞核内受体相互作用,调节NF-κB基因转录,减少IL-6分泌;因此认为ADM在自身免疫病中起保护作用,且TECs的ADM系统可能是免疫调节药物的一个新的潜在靶点。丝氨酸蛋白酶抑制剂家族E成员1(serine proteinase inhibitor family E member 1,SERPINE1)是一种损伤早期的反应因子,在细胞成熟和增殖中具有调节作用[19]。
综上所述,芯片筛查结果显示SOCS3、IRF1、HES1、FOSL1、EMP1、GADD45B、ADM、SERPINE1等在MG患者胸腺组织中的表达升高,提示它们与胸腺异常及MG疾病的发生有关。上述分子涉及不同信号通路,通过不同方式调节细胞增殖、分化和凋亡。本研究结果有助于开拓MG研究的新方向,也将为深入研究胸腺细胞异常发育、MG胸腺异常及疾病发生机制提供新思路。

