TLR4对H2O2诱导的PC12细胞凋亡及β-catenin、c-myc蛋白表达的影响
陈南耀,余 丹,陈晓东
1)海口市第四人民医院神经内科 海口 571199 2)海口市人民医院神经内科 海口 570208 3)海口市人民医院神经外科 海口 570208
脑栓塞、休克、颅脑损伤等诱导的脑缺血再灌注损伤是引起脑组织功能障碍的重要原因,其中氧化应激是缺血再灌注神经损伤发生的重要机制[1]。Toll样受体4(toll-like receptor-4,TLR4)在人类几乎所有的组织和器官中均有表达,是一个与炎症、细胞生长等有关的调控因子[2]。TLR4与神经损伤发生有关,其在缺氧复氧损伤的脑神经组织中高表达,表达水平与神经损伤程度呈正比[3-4]。H2O2可诱导多种细胞发生氧化应激反应[5-6]。本实验以负载TLR4 shRNA的慢病毒感染大鼠嗜铬细胞瘤PC12细胞,观察H2O2干预后细胞中TLR4的表达,以及细胞增殖、凋亡能力和Wnt/β-catenin信号通路相关蛋白β-连环蛋白(β-catenin)、c-myc表达的变化,探讨TLR4在PC12细胞氧化损伤中的作用,以期为明确神经系统损伤机制提供参考。
1 材料与方法
1.1材料PC12细胞由中科院细胞库提供;TLR4抗体购自Santa Cruz Biotechnology公司;cDNA合成试剂盒和qRT-PCR试剂盒均购自大连TaKaRa公司;引物由南京金斯瑞合成;TLR4 shRNA慢病毒及对照空病毒均由湖南丰晖生物科技有限公司构建;β-catenin抗体、c-myc抗体购自美国Abcam公司。
1.2实验分组将PC12细胞接种到6孔板(种植密度3×104个/孔),在显微镜下观察细胞融合为40%时,分别添加TLR4 shRNA慢病毒及空病毒液,感染复数设置为10。感染12 h后,弃掉培养上清液,添加细胞培养液继续培养。3 d后,于荧光显微镜下观察,证实干扰效率超过90%。取感染 TLR4 shRNA慢病毒及空病毒的PC12细胞,用200 μmol/L的H2O2(以细胞培养液配制)培养6 h,记为shRNA+H2O2组和空病毒+H2O2组。不感染慢病毒的PC12细胞分别用0和200 μmol/L的H2O2培养6 h,分别记为空白对照组和H2O2组。
1.34组细胞中TLR4mRNA的检测分别收集4组细胞,用PBS洗涤后,Trizol法提取总RNA,按照37 ℃15 min、85 ℃5 s、4 ℃10 min进行反转录,以合成的cDNA为模板进行荧光定量PCR。引物序列为:TLR4上游5’-GGTGGAAGTTGAAGGAAT-3’,下游5’-AGATGATACCAGCACGAC-3’;GAPDH上游5’-CAGTCAGCCGCATCTTCTTTT-3’,下游5’-GT GACCAGGCGCCCAATAC-3’。反应条件:95 ℃15 s,60 ℃60 s,40个循环。以GAPDH为参照,采用2-ΔΔCt法计算TLR4 mRNA表达水平。实验重复3次。
1.44组细胞中TLR4蛋白的检测分别收集4组细胞,用PBS洗涤后,加RIPA裂解液于冰上孵育20 min,转移到4 ℃离心机中,12 000×g离心10 min。用移液枪吸取上清,BCA法定量蛋白样品。常规方法配制SDS-PAGE凝胶。蛋白上样量40 μg,上样前用等体积缓冲液混合煮沸5 min。积层胶电泳电压为90 V,分离胶电泳电压为120 V,转膜电压90 V。蛋白转移到PVDF膜后,以BSA封闭非特异性位点。一抗按照1∶600稀释,二抗按照1∶4 000稀释。分别在封闭、一抗孵育和二抗孵育后以TBST洗膜3次。ECL发光,以Chemi Doc XRS成像。以目的蛋白与内参GAPDH条带灰度值的比值表示目的蛋白表达水平。实验重复3次。
1.5MTT法测定细胞存活率将PC12细胞按照3×104个/mL密度种植到96孔板,每孔100 μL,按照1.2分组处理后,每孔分别添加MTT溶液20 μL孵育4 h,弃上清,加DMSO溶解结晶,于酶标仪上测定490 nm处的吸光度(A)值。细胞存活率=实验组A/空白对照组A×100%。实验重复3次。
1.6Annexin V-FITC和PI双染法测定细胞凋亡分别收集4组细胞,以PBS配制成106个/mL的细胞悬液。吸取1 mL细胞悬液,离心,加200 μL结合缓冲液,加入各5 μL的PI和Annexin V-FITC染液混合孵育15 min,再添加300 μL缓冲液混匀,上流式细胞仪检测细胞凋亡率。实验重复3次。
1.7Western blot法测定细胞中β-catenin、c-myc蛋白表达水平分别收集4组细胞,用Western blot法测定细胞中β-catenin、c-myc表达水平。β-catenin、c-myc抗体分别以封闭液按照1∶500稀释,其余步骤同1.4。实验重复3次。
1.8统计学处理采用SPSS 22.0分析实验数据,4组细胞中TLR4 mRNA和蛋白表达水平、细胞存活率和凋亡率、细胞中β-catenin、c-myc蛋白表达水平的比较采用单因素方差分析,两两比较采用SNK-q检验,检验水准α=0.05。
2 结果
2.14组细胞中TLR4mRNA和蛋白表达水平的比较见图1和表1。H2O2组细胞中TLR4表达水平较空白对照组升高,shRNA+H2O2组细胞中TLR4的表达较H2O2组降低。
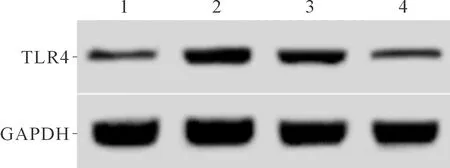
1、2、3、4:分别为空白对照组、H2O2组、空病毒+H2O2组、shRNA+H2O2组
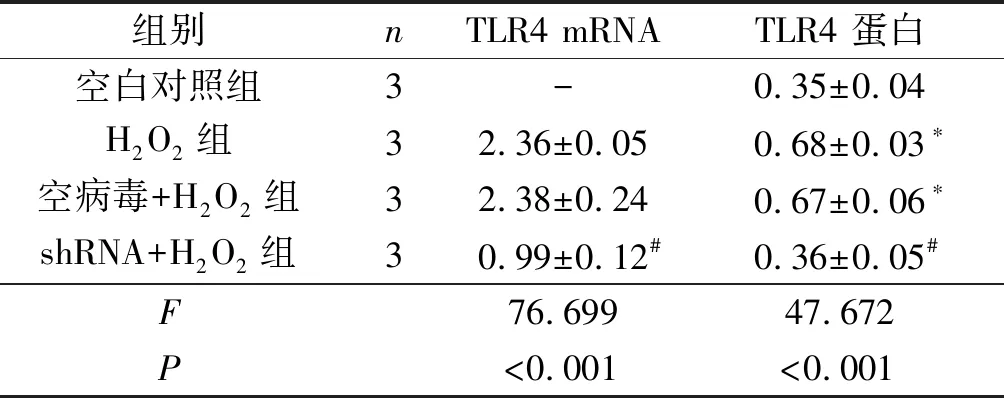
图1 4组细胞中TLR4蛋白的表达
*:与空白对照组比较,P<0.05;#:与H2O2组、空病毒+H2O2组比较,P<0.05
2.24组细胞存活率和凋亡率的比较见表2。H2O2组细胞存活率降低,细胞凋亡率增加。shRNA+H2O2组细胞凋亡率较H2O2组降低,存活率升高。
2.34组细胞中β-catenin、c-myc蛋白表达水平的比较见图2和表3。H2O2组细胞中β-catenin、c-myc蛋白表达水平较空白对照组降低。shRNA+H2O2组细胞中β-catenin、c-myc蛋白表达水平较H2O2组升高。
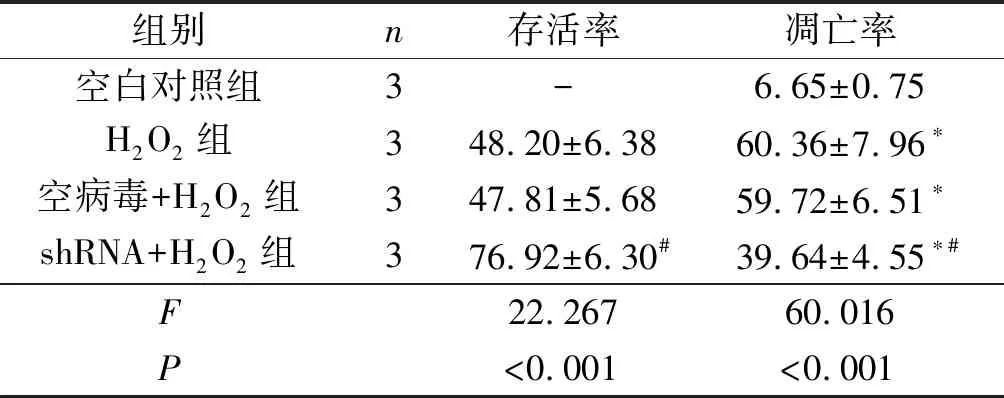
表2 4组细胞存活率和凋亡率的比较 %
*:与空白对照组比较,P<0.05;#:与H2O2组、空病毒+H2O2组比较,P<0.05
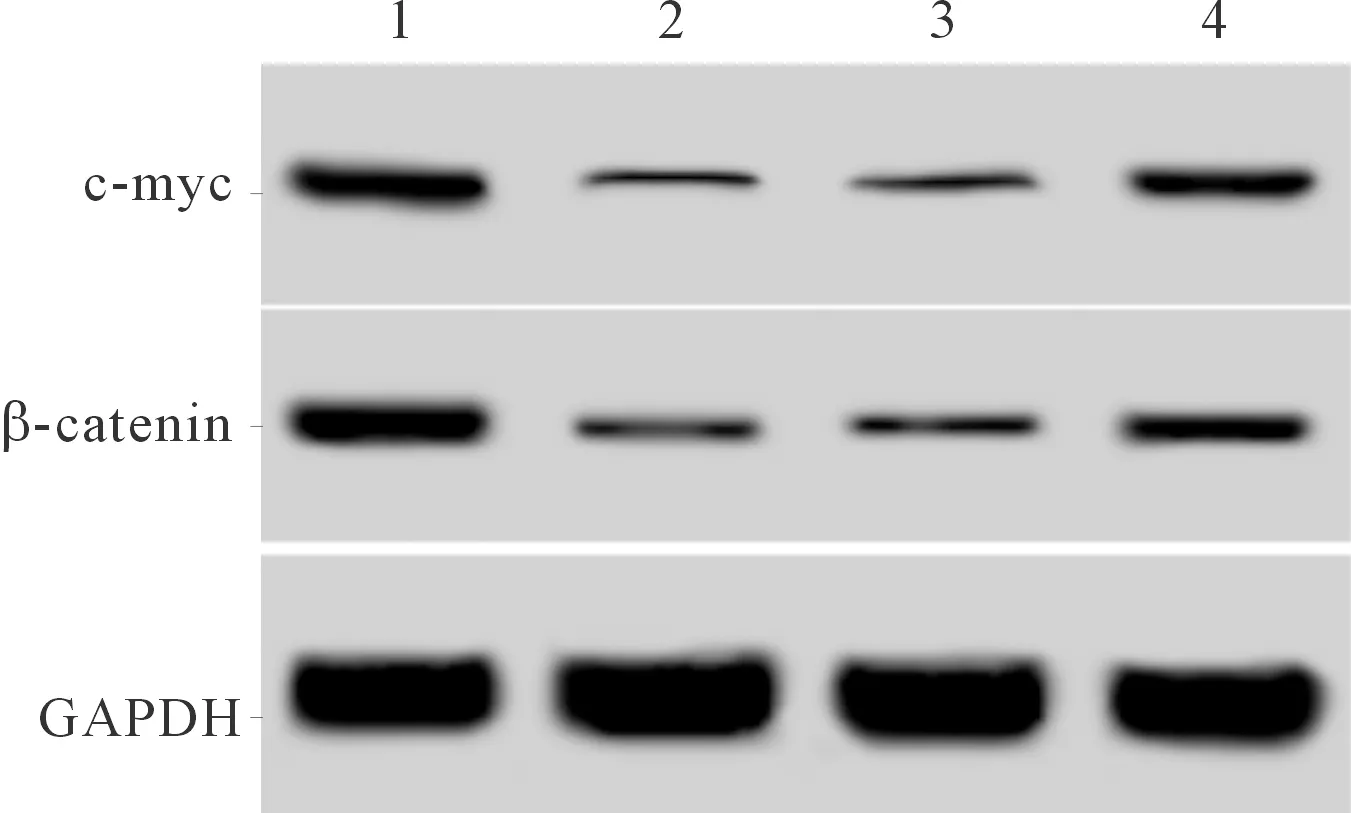
1、2、3、4:分别为空白对照组、H2O2组、空病毒+H2O2组、shRNA+H2O2组

图2 4组细胞中β-catenin、c-myc蛋白的表达
*:与空白对照组比较,P<0.05;#:与H2O2组、空病毒+H2O2组比较,P<0.05
3 讨论
脑血管疾病的发生与缺血再灌注损伤有关[7-9],氧化应激是脑组织缺血再灌注损伤的主要机制之一。氧化应激可以诱导神经细胞凋亡,抑制神经细胞生长,引起神经系统功能障碍[10-11]。本研究结果显示,H2O2处理后PC12细胞生长能力降低,凋亡细胞增多。
TLR4是Toll样受体蛋白家族成员,能够识别革兰阴性菌细胞壁的有效成分,其在氧化应激诱导的心肌损伤、肾小管上皮细胞损伤等多种细胞损伤中具有重要的调控作用[12-13]。目前的研究[14]显示,TLR4参与机体免疫反应和脑缺血损伤发生,脑缺血损伤可以诱导炎症反应,进而引起氧化应激,导致细胞组织结构破坏。研究[15]显示,黄芪甲苷在减轻缺氧复氧PC12细胞损伤的同时可以下调TLR4的表达,TLR4可能参与缺氧复氧PC12细胞凋亡过程。本实验结果显示,H2O2处理后PC12细胞中TLR4蛋白和mRNA表达水平均升高,敲减TLR4后H2O2诱导的PC12细胞凋亡率降低,细胞存活率增加,提示TLR4可能在PC12细胞氧化应激损伤中发挥促进作用。
TLR4具有调控细胞生长和凋亡的作用,并且对于不同细胞调控作用不同。有研究[16-19]表明,TLR4可以抑制神经细胞Wnt信号通路的激活;可以负调控破骨细胞Wnt信号通路,提高细胞增殖活性;可以激活乳腺癌、骨髓间充质干细胞中Wnt信号通路,促进细胞增殖。也有研究[20]表明,抑制Wnt信号通路可以加重百草枯诱导的PC12细胞凋亡。本实验结果表明,H2O2处理后的PC12细胞中Wnt/β-catenin信号通路中的关键蛋白β-catenin及下游靶基因c-myc表达下调,敲减TLR4可以提高H2O2诱导的PC12细胞中β-catenin、c-myc蛋白表达水平,说明敲减TLR4能够促进PC12细胞中的Wnt/β-catenin信号通路的激活,这可能是其抗PC12细胞损伤的作用机制。
总而言之,TLR4在神经细胞氧化损伤中可能发挥促进作用,作用机制可能与调控Wnt/β-catenin信号通路的激活水平有关。

