过表达受体活性修饰蛋白-1对人气道平滑肌细胞增殖和细胞周期的影响
吴 雷,叶树培,黄玉娥,陈翠仪,陈美华
东莞市第三人民医院呼吸内科 广东东莞 523326
支气管哮喘是一种由肥大细胞、嗜酸性粒细胞、T淋巴细胞、气道上皮细胞等炎症细胞和细胞组分所介导的具有复杂免疫机制的气道慢性过敏反应性疾病[1]。气道重塑是哮喘的重要特征,也是引起哮喘不可逆气流阻塞、难治性哮喘和激素抵抗的重要原因之一[2]。平滑肌细胞异常增殖是气道重塑的主要机制[3]。因此,探究气道重塑过程中平滑肌细胞异常增殖的分子机制,对于哮喘的防治具有重要意义。降钙素基因相关肽 (calcitonin gene related peptide,CGRP)是一种新的神经肽,其表达升高可减轻哮喘大鼠气道炎症及高反应性[4]。受体活性修饰蛋白-1(receptor activity modifying protein-1, RAMP-1)是CGRP家族受体的重要组成部分。既往研究[5]证实,血管平滑肌细胞中RAMP-1与CGRP表达呈正相关,且RAMP-1过表达是CGRP抑制血管平滑肌细胞增殖的主要机制。RAMP-1在哮喘中的作用目前尚未阐明。因此,本研究以人气道平滑肌细胞(airway smooth muscle cells,ASMCs)为研究对象,将pcDNA3.1-RAMP-1转染ASMCs,旨在探讨RAMP-1对ASMCs增殖和细胞周期的影响。
1 材料与方法
1.1主要试剂和仪器DMEM培养基、胎牛血清(FBS)均购自美国Gibco公司;LipofectamineTM2000试剂盒均购自美国Invitrogen;pcDNA3.1和pcDNA3.1-RAMP-1购自上海索莱宝生物有限公司;CCK-8试剂盒购自日本同仁化学研究所;BCA试剂盒购自美国Thermo公司;RNase、PI均购自江苏凯基公司;RAMP-1、IκBα、p65NF-κB、PCNA、CyclinD1抗体均购自美国CST公司;酶标仪购自美国Bio-Rad公司。
1.2ASMCs的分离培养采用组织块贴壁培养法。患者及家属知情同意后,无菌条件下取东莞市第三人民医院肺部良性肿瘤肺叶切除术患者的正常肺叶段支气管标本(组织标本均经病理学确诊)。去除周围结缔组织、软骨和血管后,预冷PBS冲洗。转移组织块至含血清的青霉素小瓶中,将其剪成1 mm3大小组织块,均匀铺在培养瓶底部,加含FBS的DMEM培养液,于体积分数5%CO2、37 ℃孵箱中培养,2 h后观察到组织块贴壁,翻转瓶底。继续培养,每3~5 d换液1次。胰蛋白酶消化传代。
1.3实验分组取3~8代ASMCs,待细胞达60%~70%生长融合时进行转染。实验分为空白组(不作转染)、pcDNA3.1组(转染pcDNA3.1)和pcDNA3.1-RAMP-1组(转染pcDNA3.1-RAMP-1),每组3孔。转染参照LipofectamineTM2000试剂盒说明操作。48 h后,Western blot检测RAMP-1蛋白转染效果。实验重复3次。
1.4CCK-8法检测细胞增殖取3~8代ASMCs,以每孔3 000个细胞接种于96孔板,每孔100 μL。按1.3分组,于转染24、48和72 h后,每孔中加入10 μL CCK-8试剂,于37 ℃、体积分数5%CO2培养箱培养2 h,酶标仪检测450 nm波长处的吸光度(A)值。实验重复3次。
1.5流式细胞术检测细胞周期取3~8代ASMCs,接种于75 cm2培养瓶中,于培养箱中培养,细胞达80%融合时,吸弃旧的培养液,加入含FBS的DMEM培养液,过夜,使细胞同步静止于G0期。按照1.3分组处理,于37 ℃、体积分数5%CO2培养箱孵育48 h,胰蛋白酶消化,制备成单细胞悬液,收集于离心管中。离心,弃上清,预冷PBS洗涤细胞,离心,弃上清,4 ℃预冷乙醇轻吹细胞使之完全重悬,4 ℃固定2 h,离心,收集固定细胞,PBS洗涤重悬细胞,并将细胞转移至EP管中,轻轻吹打,加10 μL RNase(10 g/L),37 ℃水浴10 min,再加入5 μL PI 37 ℃避光水浴染色30 min,过300目筛网。上流式细胞仪检测细胞周期。实验重复3次。
1.6Western blot检测细胞中p65NF-κB、IκBα、PCNA和CyclinD1蛋白的表达细胞转染48 h,使用适量的裂解液提取细胞总蛋白,BCA法对蛋白浓度进行检测。配制120 g/L分离胶及50 g/L浓缩胶,按照40 μg/孔上样蛋白,经SDS-PAGE、转膜、封闭后,洗膜,加入一抗稀释液(稀释浓度1∶800),4 ℃摇床孵育过夜,洗膜,加HRP标记的二抗稀释液,洗膜,室温摇床孵育1.0~1.5 h,ECL显色,曝光,采集图像,Quantity One软件分析。以目的蛋白与内参(GAPDH)灰度值的比值作为目的蛋白的相对表达量。实验重复3次。
1.7统计学处理采用SPSS 21.0分析,各组细胞RAMP-1蛋白表达,增殖情况,细胞周期和p65NF-κB、IκBα、PCNA、CyclinD1蛋白表达的比较采用单因素方差分析,两两比较采用SNK-q检验,检验水准α=0.05。
2 结果
2.1各组细胞RAMP-1蛋白的表达见图1和表1,pcDNA3.1-RAMP-1组RAMP-1表达升高。
2.2各组细胞增殖情况比较结果见表2。
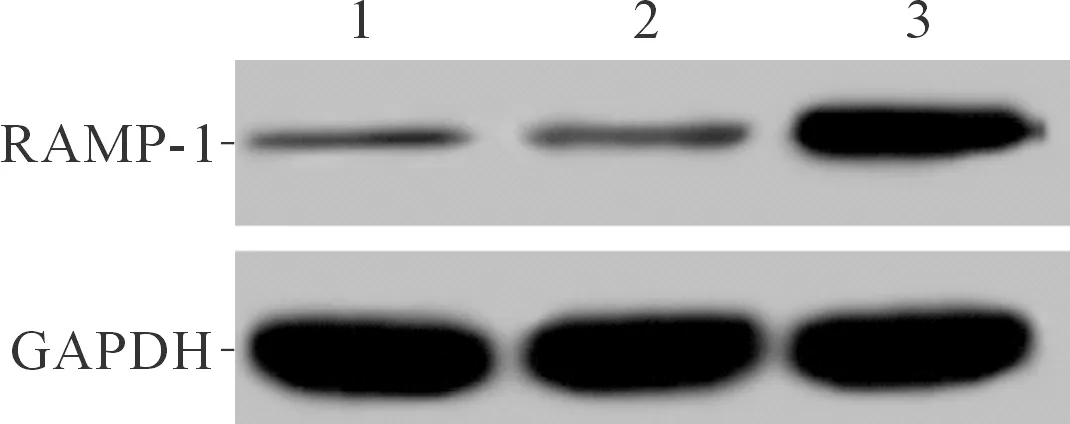
1~3:分别为空白组、pcDNA3.1组和pcDNA3.1-RAMP-1组
F=271.702,P<0.001;*:与空白组和pcDNA3.1组比较,P<0.05
表2各组细胞增殖A值比较(n=3)
*:与空白组和pcDNA3.1组比较,P<0.05
2.3各组细胞周期比较结果见表3。pcDNA3.1-RAMP-1组G0/G1期细胞比例升高,而S期和G2/M期细胞比例降低。
表3各组细胞周期比较
(n=3) %

*:与空白组和pcDNA3.1组比较,P<0.05
2.4各组细胞中NF-κB信号通路蛋白p65NF-κB、 IκBα、PCNA和CyclinD1的表达见图2和表4。pcDNA3.1-RAMP-1组IκBα表达升高,p65NF-κB、PCNA和CyclinD1表达均降低。
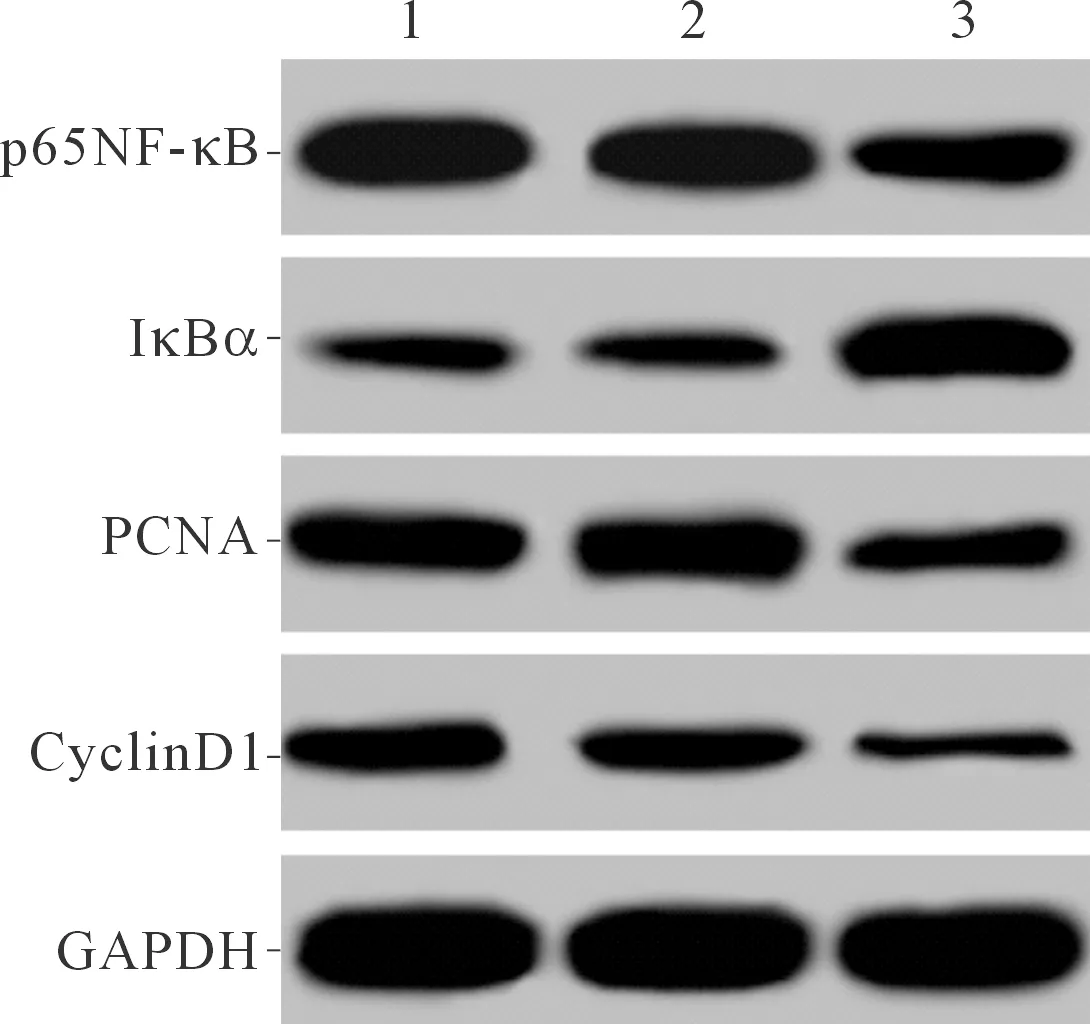
1~3:分别为空白组、pcDNA3.1组和pcDNA3.1-RAMP-1组
图2各组细胞中p65NF-κB、IκBα、PCNA和CyclinD1蛋白的表达
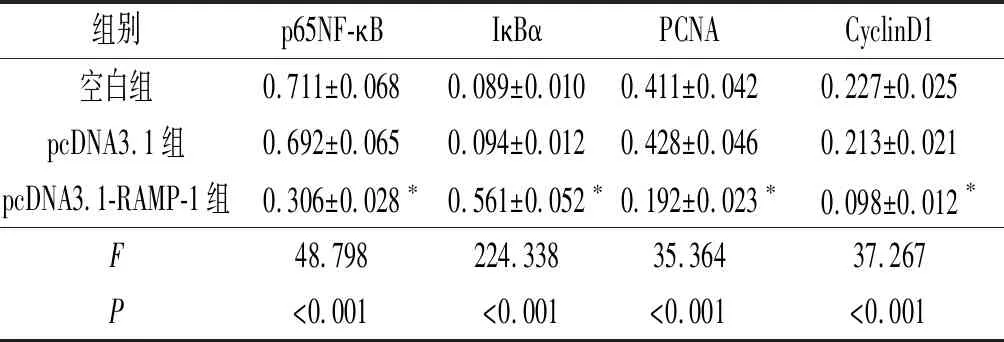
表4 各组细胞中p65NF-κB、 IκBα、PCNA和CyclinD1蛋白的相对表达量(n=3)
*:与空白组和pcDNA3.1组比较,P<0.05
3 讨论
支气管哮喘是一种常见的慢性疾病,近些年其发病率和病死率仍在不断上升,气道重塑是哮喘的关键特征之一,平滑肌细胞、上皮细胞、成纤维细胞、T辅助细胞等均参与哮喘的气道重塑过程[6]。ASMCs是气道重塑过程中主要的结构成分之一,参与哮喘的病理过程(气道重塑、气道炎症和气道高反应性)[7]。现有研究[8]发现,哮喘时ASMCs数目增加、体积增大、凋亡减少,气道壁明显增厚。因此,抑制哮喘过程中ASMCs增殖对于哮喘治疗有重要意义。
CGRP在体内广泛分布和表达,具有肺功能保护、神经系统保护、心血管系统保护、骨损伤修复等多种生物学活性[9-10]。RAMP-1是CGRP受体之一,是受体调节的限速蛋白[11]。有研究[12]显示,构建大鼠RAMP-1基因开放阅读框的真核表达载体,并将其转染入大鼠主动脉平滑肌细胞,可明显增强CGRP抑制的血管平滑肌细胞增殖。CGRP修饰的骨髓间充质干细胞能明显抑制血管平滑肌细胞的表型转化及细胞增殖,这可能与CGRP受体表达上调增强CGRP效应性有关[13]。本研究发现过表达RAMP-1可明显抑制ASMCs增殖,阻滞细胞周期进程。这与以往研究相符,提示过表达RAMP-1也可能是哮喘治疗的途径之一。
NF-κB是一个多向性核转录调节因子,目前研究[14-15]认为,NF-κB信号通路参与炎症、免疫反应、感染、细胞凋亡等多种生理和病理过程。NF-κB活化与支气管哮喘等疾病密切相关[16]。有研究[17]显示,增加胞浆IκBα含量,抑制NF-κB表达和激活,可有效抑制哮喘气道炎症;RAMP-1对可促进血管平滑肌细胞迁移,机制与抑制NF-κB信号通路有关[18]。NF-κB信号通路对细胞生物学特性的影响与调节的下游靶基因有关。PCNA是一种核内蛋白,其表达水平可反映细胞增殖情况,哮喘中气道平滑肌细胞PCNA表达水平升高[19]。CyclinD1是一个细胞周期蛋白,在调节细胞周期G1期向S期转变过程中发挥重要作用,主要存在于气道平滑肌细胞,在哮喘中表达水平升高[20]。本研究结果显示,过表达RAMP-1可上调ASMCs中IκBα蛋白的表达,下调p65NF-κB、PCNA和CyclinD1蛋白的表达,提示RAMP-1对ASMCs生长的影响与抑制NF-κB信号通路有关。
综上所述,过表达RAMP-1可抑制ASMCs增殖,阻滞细胞周期,机制与抑制NF-κB信号通路有关。RAMP-1可能是哮喘治疗的有效干预靶点,但还需更多研究证实。

