间质性肺病小鼠外周血循环纤维细胞的变化及依那西普的干预作用①
王慧选 殷寒秋 辜 冲 殷松楼
(徐州医科大学,徐州221000)
间质性肺病(Interstitial lung disease,ILD)是一类主要累及肺泡腔和肺间质,以不同程度的肺泡炎症和肺纤维化为病理特征的肺部疾病。约1/3的ILD患者继发于结缔组织疾病(Connective tissue disease,CTD),ILD常导致肺功能降低和生活质量下降,5年生存率仅为20%,缺乏有效的治疗方法[1]。已知肺成纤维细胞在ILD病理发生发展中有重要作用,循环纤维细胞(Circulating fibrocytes)是肺成纤维细胞的重要来源之一,可能参与了ILD的病理过程[2]。TNF-α是ILD发病的重要细胞因子,TNF-α拮抗剂依那西普在治疗结缔组织疾病中取得了较好的效果,但是,目前TNF-α拮抗剂对于结缔组织疾病相关性间质性肺病(CTD-ILD)的治疗效果尚存在较大争议[3,4]。本实验观察在BLM诱导小鼠ILD的病理进程中的循环纤维细胞的数量变化,以及依那西普对ILD的干预效果及对循环纤维细胞数量的影响。
1 材料与方法
1.1材料
1.1.1实验材料 9~11周龄SPF级雌性昆明小鼠60只购于徐州医科大学实验动物中心,重量(20±0.93)g。饲养在室温、相对湿度为(55±10)%的环境中,自主摄食和饮水。
1.1.2实验试剂 博来霉素针剂为日本化药株式会社生产,15 mg/支;依那西普为三生国健药业(上海)股份有限公司生产,12.5 mg/支;固定与透膜试剂盒、Percp标记抗小鼠 CD45 购自BD公司;兔抗小鼠ColⅠ抗体购自Rockland 公司;FITC 标记的山羊抗兔IgG 购自上海贝博生物;兔抗小鼠α-SMA抗体购自艾博拉(上海)贸易有限公司;生物素-链霉卵白素免疫组化检测试剂盒和DAB试剂盒购自北京中杉金桥生物技术有限公司; Masson染色试剂盒和羟脯氨酸试剂盒购自南京建成生物工程研究所;流式细胞仪为BD LSRFortessaTMCell Analyzer。
1.2方法
1.2.1分组与模型建立 实验小鼠随机分为3组:模型组(A组,n=20)、依那西普干预组(B组,n=20)、生理盐水对照组(C组,n=20)。
适应性饲养后,小鼠腹腔注射浓度为0.3%戊巴比妥钠溶液(30 mg/kg),麻醉后切开颈部逐层分离组织至气管。A组和B组用1 ml注射器吸取药量为5.0 mg/kg的BLM 溶液,缓慢滴入气管,滴入过程中将小鼠直立,使BLM溶液在肺内分布均匀,同时观察小鼠呼吸情况,进行创口缝合。C组小鼠经气管注入等体积的生理盐水。BLM给药24 h,B组皮下注射依那西普(0.4 mg/kg,2次/周),A组和C组给予等体积的0.9%氯化钠溶液,药物干预至小鼠处死前24 h。
1.2.2循环纤维细胞检测 3组小鼠均在BLM 给药后第7、14、21、28天时眼球取血法分别处死5只,取200 μl肝素钠抗凝血于流式管中,CD45单抗 25 ml(0.02 mg/ml),涡旋器振荡混匀,室温避光孵育15 min;离心机500 g离心5 min后,加入固定透膜液500 μl(1∶1),4℃孵20 min;每管加透膜洗涤液1 ml(1∶10),500 g/min 离心5 min,弃上清,重复上述操作1次;每管加兔抗小鼠Col Ⅰ 抗体2 μl(0.01 mg/ml),4℃避光孵育30 min,洗涤2次;每管加FITC 标记的山羊抗兔抗体27 μl(0.04 mg/ml)于管底,4℃避光孵育30 min,洗涤2次后,最后以300 μl PBS缓冲液重悬细胞。流式细胞仪检测,每管获取1×105个细胞,原始数据采用FloJo-V10软件处理。
1.2.3肺组织炎症、纤维化程度的病理学分析 小鼠右肺组织经4%多聚甲醛通用型组织固定液固定、脱水、石蜡包埋后,石蜡切片机制作3 μm的石蜡切片,常规HE染色及按照Masson染色试剂盒说明书进行染色。观察肺组织炎症改变和肺组织胶原沉积情况。肺部炎症评分:0分为无炎症细胞;1分为少量炎症细胞;2分为轻度炎症;3分为中度炎症;4分为重度炎症。肺部纤维化评分采用Ashcroft半定量法[5],0分:正常肺组织;1分:肺泡或细支气管壁轻微纤维增厚;3分:细支气管壁或肺泡壁增厚,肺泡结构无明显破坏;5分:纤维化程度增加,肺泡结构受到一定程度破坏,有纤维束或小纤维团形成;7分:严重的肺泡结构破坏,大面积纤维化;8分:肺几乎完全纤维化(2、4、6 分为上述各级的过渡阶段)。
1.2.4免疫组织化学法检测肺组织α-SMA 表达情况 石蜡切片脱蜡至水,热修复5~10 min,重复2~3次;PBS缓冲液洗涤3次,每次5 min;之后步骤按免疫组化试剂盒说明书进行操作。
1.2.5肺组织羟脯氨酸测定 取小鼠左肺组织,取合适重量按照羟脯氨酸试剂盒说明书进行操作,分光光度仪检测羟脯氨酸含量。

2 结果
2.1肺组织病理学改变 HE染色显示,A组第7天时肺间隔增宽且有大量炎症细胞浸润;第14天时肺部组织基本消失,肺泡结构几乎不可见;第21天时肺部斑片化;第28天时斑片面积减少,病理情况减轻。与A组同时期相比,B组病理情况轻于A组(图1)。Masson染色显示,A组第7天开始出现少量胶原纤维沉积,到第14天达到最高峰,随后逐渐减少。B组各时期的胶原纤维沉积程度较A组轻(图2)。
2.2肺部炎症及纤维化评分 根据肺部炎症分级和Ashcroft半定量法评分,结果显示A组炎症评分在第7、14、21天时较C组高(P<0.01),B组炎症评分在第14天和第21天较A组低(P<0.01),B组炎症评分仅在第14天时较C组高(P<0.01)。A组纤维化评分较各个时期的C组高(P<0.01),B组纤维化评分在第14、21和28天较A组低(P<0.01),B组纤维化评分较各个时期的C组高(P<0.01)(表1、表2)。
2.3羟脯氨酸含量 A组在各个时期的羟脯氨酸含量显著高于C组(P<0.01),B组羟脯氨酸含量在第7、14、21天时低于A组(P<0.05),B组在各个时期的羟脯氨酸含量高于C组(P<0.01)(表3)。

图1 A组、B组和C组小鼠肺组织HE染色(×200)Fig.1 HE staining of lung tissue in mice of groups A,B and C (×200)
2.4外周血循环纤维细胞百分比 A组循环纤维细胞百分比第7天达到最高(5.86±1.98)%,随后呈下降趋势;A组循环纤维细胞百分比在第7、14、21天时显著高于C组(P<0.01),B组循环纤维细胞数目在第7、14、21天时低于A组(P<0.01),B组循环纤维细胞百分比在第7、14天时高于C组(P<0.01)(图3)。
2.5肺组织α-SMA的表达情况 A组和B组免疫组化结果显示除了支气管和血管管壁表达α-SMA外,在肺组织实变处新出现了表达α-SMA的肌纤维母细胞。A组第7天出现α-SMA表达,至第14天达到最高;B组在第14、21天α-SMA表达量均少于A组;C组在各个时期除了支气管和血管管壁外,没有出现α-SMA表达情况(图4)。
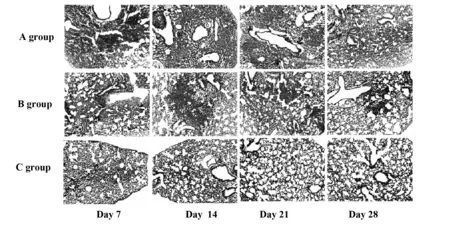
图2 A组、B组和C组小鼠肺组织的Masson染色(×200)Fig.2 Masson′s staining of lungs in mice of groups A,B and C (×200)



ItemDay 7Day 14Day 21Day 28Group A2.80±0.572)3.60±0.421)2)2.60±0.421)2)1.50±0.79Group B1.80±0.762.00±0.613)1.00±0.620.80±0.27Group C0.90±0.420.70±0.270.30±0.270.30±0.27
Note:1)Group A vs Group B,P<0.01;2)Group A vs Group C,P<0.01;3)Group B vs Group C,P<0.01.


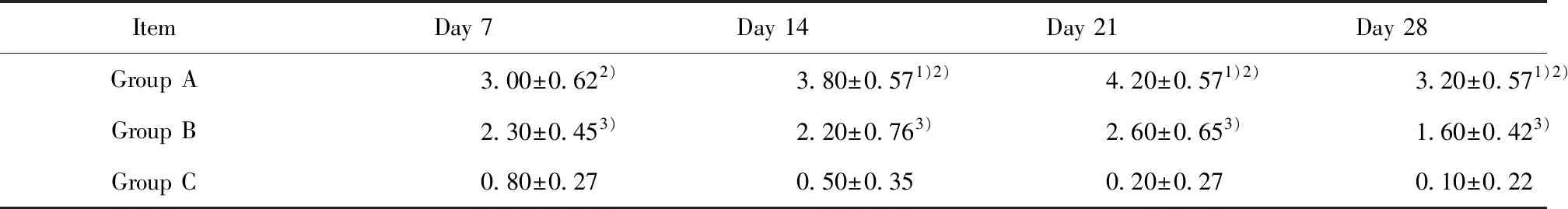
ItemDay 7Day 14Day 21Day 28Group A3.00±0.622)3.80±0.571)2)4.20±0.571)2)3.20±0.571)2)Group B2.30±0.453)2.20±0.763)2.60±0.653)1.60±0.423)Group C0.80±0.270.50±0.350.20±0.270.10±0.22
Note:1)Group A vs Group B,P<0.01;2)Group A vs Group C,P<0.01;3)Group B vs Group C,P<0.01.


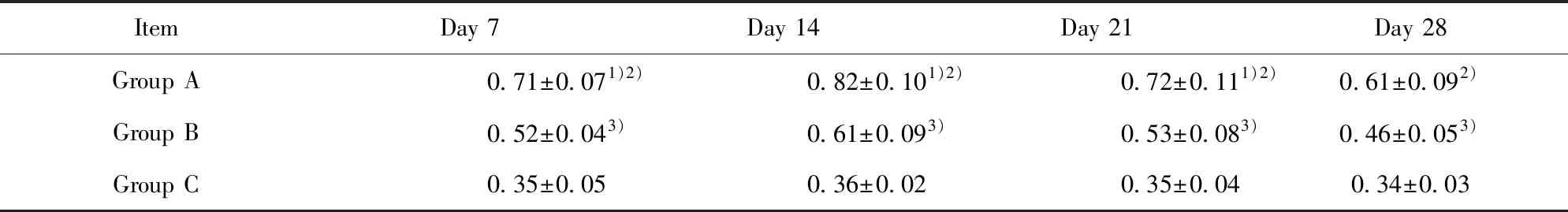
ItemDay 7Day 14Day 21Day 28Group A0.71±0.071)2)0.82±0.101)2)0.72±0.111)2)0.61±0.092)Group B0.52±0.043)0.61±0.093)0.53±0.083)0.46±0.053)Group C0.35±0.050.36±0.020.35±0.040.34±0.03
Note:1)Group A vs Group B,P<0.05,2)Group A vs Group C,P<0.01,3)Group B vs Group C,P<0.01.

图3 A组、B组和C组小鼠外周血循环纤维细胞趋势图和柱状图Fig.3 Trend chart and histogram of peripheral blood circulating fibrocytes in mice of groups A,B and CNote: *.P<0.01.

图4 A组、B组和C组小鼠肺组织α-SMA表达情况(×200)Fig.4 Expression of α-SMA in mice in groups A,B and C (×200)

图5 循环纤维细胞百分比与肺组织炎症评分、纤维化评分和羟脯氨酸含量的相关性Fig.5 Correlation of percentage of circulating fibrocytes with lung inflammation score,fibrosis score and hydroxyproline content
2.6循环纤维细胞百分比与肺组织炎症和纤维化评分、羟脯氨酸的相关性分析 Spearman分析结果显示,A组和B组小鼠外周血循环纤维细胞百分比与肺组织炎症评分、纤维化评分和羟脯氨酸含量呈正相关(r=0.540,0.384,0.535;n=40,P<0.05)(图5)。
3 讨论
ILD发病率呈逐年上升趋势,预后差,缺乏有效的治疗措施。为了提供新的诊断和治疗方法,本实验通过BLM诱导的小鼠ILD模型,初步探讨ILD的发病机制和依那西普对ILD的治疗作用。ILD的特征是不同程度的炎症和纤维化,是CTD的常见并发症,肺泡炎症导致肺上皮细胞异常损伤修复和细胞外基质的沉积,病理改变的最终结局是不可逆的肺纤维化,成纤维细胞在ILD进展中发挥重要作用,而循环纤维细胞是肺成纤维细胞的重要来源之一,因此减少成纤维细胞的来源至关重要。
Hashimoto等[6]在BLM诱导长期移植表达增强型绿色荧光蛋白转基因小鼠的肺损伤模型中,发现肺部表达胶原的细胞很大比例是骨髓来源的外周循环纤维细胞。循环纤维细胞从外周血迁移至肺部,增殖分化为肌纤维母细胞,肌纤维母细胞除了表达成纤维的部分标志外还特异性表达α-SMA[7]。肺组织免疫组化显示,循环纤维细胞在损伤部位特异性地分化为肌纤维母细胞并参与损伤组织的修复,且特异性表达α-SMA。循环纤维细胞同时具有血源性细胞和成纤维细胞的功能和特征,标志物CD45和ColⅠ双阳性常用来鉴别循环纤维细胞,实验结果为肺部炎症、纤维化评分和羟脯氨酸含量与循环纤维细胞数量呈正相关,外周血循环纤维细胞数量变化与BLM诱导的小鼠ILD病理进展一致,提示其参与该ILD模型的炎症和纤维化过程。
临床上常采用糖皮质激素或糖皮质激素联合环磷酰胺的用药方案治疗CTD-ILD,但常需要监测其毒副作用。最新口服药物尼达尼布(nintedanib)和吡非尼酮(pirfenidone),在特发性肺纤维化的治疗上有一定效果[8,9],但仅能延缓肺功能下降速度,并不能从根本上阻止和逆转肺纤维化的进程,并且其在CTD-ILD的疗效尚不清楚,因此尚需一种安全可靠的治疗方案。
肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)是在广泛的炎性和自身免疫性疾病中发挥重要作用的促炎介质,它是宿主对抗感染和炎症反应的一个重要组成部分。TNF-α促进成纤维细胞的增殖,增加成纤维细胞的转化和促进胶原纤维合成[10]。在CTD的发病机制中,TNF-α活动的失调是重要原因之一。近年来TNF-α抑制剂在CTD-ILD治疗上取得了一定效果,但偶尔有加重ILD的案例报道[4],因此需要更多研究来证实其效果。
依那西普是临床最常用的TNF-α抑制剂之一,它是一种二聚体融合蛋白,结构包含TNF-αⅡ型受体(TNF-RⅡ)的细胞外配体p75和人免疫球蛋白IgG的Fc部分。依那西普与TNF-α有更强、更特异的结合作用,对TNF-α的亲和力是单体TNF-RⅡ蛋白的1 000倍,半衰期是单体TNF-RⅡ蛋白的5倍,半衰期为70~100 h。依那西普通过竞争性阻断TNF-α与天然配体p55的结合,达到抑制TNF-α的目的[11]。本实验通过依那西普对间质性肺病小鼠进行干预,结果显示依那西普可以减轻BLM诱导的ILD小鼠的肺部炎症及纤维化症状,同时减少循环纤维细胞数量,提示减少循环纤维细胞数量可能是依那西普作用ILD的环节之一。
综上所述,循环纤维细胞可能参与BLM诱导小鼠ILD的病理进程,这为ILD的治疗和监测提供新的方法和思路;依那西普抑制循环纤维细胞的数量,减轻小鼠ILD的炎症和纤维化程度,为依那西普临床应用提供理论支持,但是依那西普抑制循环纤维细胞的机制有待进一步研究。

